信迪利單抗聯合化療用于膽管癌的安全性評價
關鍵詞信迪利單抗;化療;膽管癌;安全性評價;血小板減少
我國自主研發的信迪利單抗是一種靶向免疫檢查點蛋白程序性死亡受體1(programmeddeath-1,PD-1)的全人源化免疫球蛋白G4單克隆抗體,其可阻斷PD-1與程序性死亡受體配體1(programmeddeath-ligand1,PD-L1)和PD-L2相互作用介導的免疫抑制反應,從而增強抗腫瘤免疫效應[1]。2018年12月24日,信迪利單抗正式獲國家藥品監督管理局批準上市,并于2019年11月成為首個進入國家醫保目錄的PD-1抑制劑。截至2022年12月31日,信迪利單抗已正式獲批5個適應證,包括經典型霍奇金淋巴瘤、非小細胞肺癌、肝細胞癌、食管鱗癌、胃及胃食管交界處腺癌[2]。
膽管癌是一種罕見的惡性程度較高的消化系統腫瘤,約占胃腸道惡性腫瘤的3%,其全球發病率為0.003‰~0.06‰,死亡率為0.01‰~0.06‰,且在全球范圍內均呈逐年上升趨勢[3―4]。化療是治療膽管癌的標準一線方案,而吉西他濱聯合鉑類藥物作為膽管癌的標準一線藥物,其治療效果也極其有限[5]。隨著免疫治療的發展,免疫檢查點抑制劑如度伐利尤單抗[6―8]、特瑞普利單抗[9]、帕博利珠單抗[10]也逐步應用于膽管癌中,其與傳統的化療方案相比,能明顯提高患者的臨床療效。信迪利單抗作為免疫檢查點抑制劑,在晚期膽管癌患者的治療中逐漸受到關注。目前雖然已有信迪利單抗聯合化療藥物或抗血管生成藥物用于膽管癌的個案報道和臨床研究,且取得較顯著的臨床療效[11―15],但沒有大規模的臨床試驗研究驗證其用藥的安全性。為此,本研究回顧性分析了我院信迪利單抗用于膽管癌的安全性,旨在為臨床用藥提供參考。
1 資料與方法
1.1 納入與排除標準
本研究的納入標準為:(1)符合《中國臨床腫瘤學會(CSCO)膽道惡性腫瘤診療指南2021》[16]中膽管癌的相關診斷標準;(2)化療方案為吉西他濱+順鉑/奧沙利鉑或吉西他濱+順鉑/奧沙利鉑+信迪利單抗;(3)年齡>18歲。
本研究的排除標準為:(1)繼發性膽管癌者;(2)化療方案中使用了其他抗腫瘤藥物(除信迪利單抗±吉西他濱+順鉑/奧沙利鉑)者;(3)研究者認為的其他不適合納入本研究者,如缺乏完整的隨訪記錄、存在可能干擾研究結果的治療(放療、介入治療、手術)。
1.2 資料來源
通過醫院信息系統收集2021年1月1日-2022年12月31日于我院行化療的47例膽管癌患者資料,按用藥方案的不同分為對照組(29例)和觀察組(18例)。本研究方案經我院醫學倫理委員會審核批準,批號為:中大附三醫倫RG2023-247-01。
1.3 用藥方法
對照組患者給予注射用鹽酸吉西他濱[希臘VianexS.A.-PlantC,國藥準字HJ20160224,規格0.2g(按C9H11F2N3O4計)]1000mg/m2,靜脈滴注d1、d8+注射用順鉑[齊魯制藥(海南)有限公司,國藥準字H20073652,規格10mg]40mg/m2,靜脈滴注d1或注射用奧沙利鉑(江蘇恒瑞醫藥股份有限公司,國藥準字H20000337,規格50mg)80~120mg/m2,靜脈滴注d1,每3周為1個治療周期。觀察組患者在對照組用藥的基礎上加用信迪利單抗注射液[信達生物制藥(蘇州)有限公司,國藥準字S20180016,規格100mg(10mL)]200mg,化療藥使用前或使用后靜脈滴注,每3周1次。兩組患者每個治療周期開始前及結束后均檢查血常規、肝腎功能、生化指標等,并觀察不良反應發生情況。化療周期常規為8個治療周期(臨床根據患者的治療效果、耐受情況和疾病進展情況調整治療方案,故每個患者的治療周期不同)。
1.4 不良反應評價標準
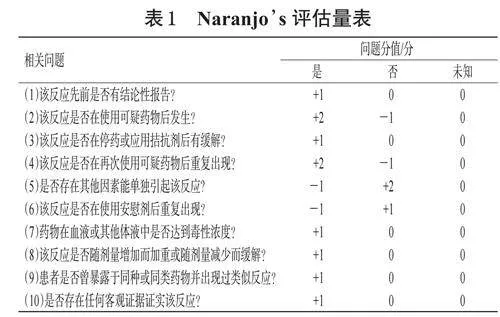
根據患者臨床癥狀和用藥情況,以Naranjo’s評估量表評分(表1)結合藥學知識及循證醫學證據,評價不良反應與使用藥物的相關性。總分≥9分,表示使用藥物與不良反應的相關性為“肯定”;5~8分為“很可能”;1~4分為“有可能”;≤0分為“可疑”[17]。采用《不良事件通用術語標準(CTCAE)》5.0版對Naranjo’s評估量表評分>1分的不良反應進行分級(1~5級)——1級:無癥狀或癥狀輕微,通常無需特殊處理;2級:有癥狀,需藥物治療,日常生活受影響;3級:癥狀嚴重,需住院治療;4級:危及生命,需緊急干預;5級:死亡[18]。
1.5 統計學方法
使用R-3.6.2軟件對數據進行統計分析。符合正態分布的計量資料以x±s表示,采用兩獨立樣本t檢驗;非正態分布的計量資料以M(P25,P75)表示,采用Wilcoxon秩和檢驗;計數資料以例數或率表示,采用χ2檢驗或Fisher確切概率法。檢驗水準α=0.05。
2 結果
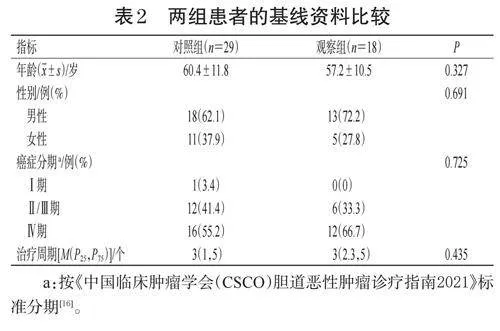
2.1 兩組患者的基線資料比較
兩組患者的年齡、性別等基線資料比較,差異均無統計學意義(P>0.05),具有可比性。結果見表2。
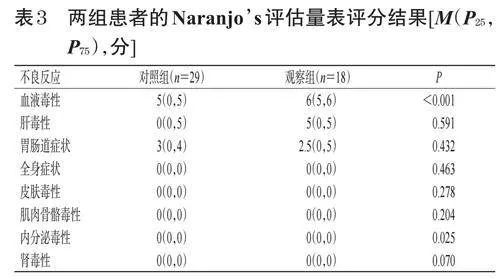
2.2 兩組患者的Naranjo’s評估量表評分及相關性評價結果
血液毒性方面,對照組患者的Naranjo’s評估量表評分為5(0,5)分,觀察組為6(5,6)分,表明血液毒性反應與兩組使用藥物的相關性均為“很可能”,且觀察組評分顯著高于對照組(P<0.001),提示觀察組的相關性更強。肝毒性方面,對照組患者的Naranjo’s評估量表評分為0(0,5)分,觀察組為5(0,5)分,表明肝毒性反應與對照組使用藥物的相關性為“可疑”,而與觀察組的相關性為“很可能”。胃腸道癥狀方面,對照組患者的Naranjo’s評估量表評分為3(0,4)分,觀察組為2.5(0,5)分,表明胃腸道反應與兩組使用藥物的相關性均為“有可能”。全身癥狀、皮膚毒性、肌肉骨骼毒性、內分泌毒性、腎毒性方面,兩組患者的Naranjo’s評估量表評分均為0(0,0)分,表明這幾種不良反應與兩組使用藥物的相關性均為“可疑”。結果見表3。
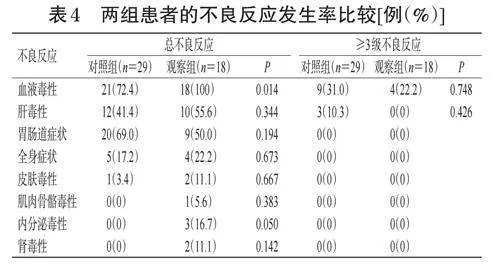
2.3 兩組患者的不良反應發生率比較
治療期間,兩組患者出現的不良反應主要包括血液毒性(中性粒細胞、血小板、血紅蛋白等降低)、肝毒性(轉氨酶升高)、胃腸道癥狀(惡心、嘔吐、食欲下降、腹瀉)、全身癥狀(頭暈、乏力不適、發熱)、皮膚毒性(皮疹、瘙癢)和肌肉骨骼毒性(關節痛)。
觀察組患者的血液毒性總發生率顯著高于對照組(P=0.014)。兩組患者的肝毒性、胃腸道癥狀、全身癥狀、皮膚毒性、肌肉骨骼毒性、內分泌毒性以及腎毒性的總發生率比較,差異均無統計學意義(P≥0.05)。兩組≥3級血液毒性、肝毒性發生率比較,差異均無統計學意義(P>0.05)。本研究未有患者死亡。結果見表4。
3 討論
吉西他濱聯合鉑類藥物是膽管癌的一線治療方案,但因療效有限,故常與免疫治療藥物(如度伐利尤單抗、信迪利單抗等)聯用,以給患者帶來更大的獲益[6,11]。信迪利單抗可通過與腫瘤細胞的PD-1結合,阻止PD-1與PD-L1的相互作用,解除對T細胞活化和增殖的抑制,從而使T細胞能夠重新識別并攻擊腫瘤細胞,抑制腫瘤的生長[19]。
本研究采用Naranjo’s評估量表對患者發生的不良反應進行評分,通過對比兩組患者不良反應發生率來評價信迪利單抗用于膽管癌的安全性。結果顯示,兩組患者均出現不同程度的血液毒性反應,主要表現為血小板減少、中性粒細胞減少、貧血等,且觀察組患者的血液毒性總發生率顯著高于對照組;對照組≥3級的血液毒性反應包括血紅蛋白、血小板以及中性粒細胞的減少(3級有7例,4級有2例),而觀察組則主要表現為血小板減少(3級有1例,4級有2例),提示信迪利單抗可能會增加血小板減少的發生風險。因此,臨床在應用信迪利單抗聯合化療時,需密切監測患者的血細胞計數,尤其是血小板計數,如出現血小板減少、中性粒細胞減少時,應及時予以對癥治療。
肝毒性反應主要表現為丙氨酸轉氨酶、天冬氨酸轉氨酶、堿性磷酸酶升高。雖然觀察組患者的肝毒性總發生率高于對照組,但差異無統計學意義;觀察組未有患者發生≥3級肝毒性反應,而對照組有3例患者發生≥3級肝毒性反應。發生肝毒性的患者經停藥、予以護肝對癥處理后均有所緩解。研究發現,信迪利單抗聯合化療可以改善腫瘤微環境,促進免疫活性細胞功能正常化,這可能有助于減少化療對肝功能的不利影響[20]。
在內分泌毒性方面,雖然兩組患者的總發生率比較,差異無統計學意義,但觀察組有3例患者出現輕度的促甲狀腺激素升高(1級),提示信迪利單抗可能會增加甲狀腺功能異常的發生風險。因此,臨床在應用信迪利單抗聯合化療時,應加強監測患者的甲狀腺功能,若出現臨床癥狀,應予以甲狀腺抑制/替代治療。
本研究中的胃腸道癥狀主要表現為食欲下降、嘔吐,這可能與鉑類藥物的高致吐風險有關,治療前予以護胃、止吐預處理,可有效緩解患者的胃腸道癥狀。在腎毒性方面,觀察組有2例患者出現輕度的尿素水平升高(1級),無臨床癥狀,無需干預。皮膚毒性主要表現為瘙癢,對患者給予外用糖皮質激素治療后好轉。在肌肉骨骼毒性方面,觀察組有1例患者出現關節痛,給予止痛處理后緩解。全身癥狀主要表現為乏力和發熱,對患者給予物理降溫或退熱處理后均好轉。
綜上所述,信迪利單抗聯合化療可能會增加膽管癌患者血液毒性反應的發生風險,尤其是血小板減少,但不良反應在可控范圍內,總體安全性良好。然而,信迪利單抗用于膽管癌屬于超適應證用藥,臨床應用時醫師需根據患者情況評估益處/風險比,同時做好超說明書用藥備案以及風險告知。基于現有的療效證據[11―15],本研究對信迪利單抗用于膽管癌的安全性數據進行了補充,可為其適應證增加膽管癌領域提供醫學依據。由于本研究納入的樣本量較小、觀察時間較短,所得結論尚需更多大規模、多中心的前瞻性研究進一步證實。

