干酪乳清中乳鐵蛋白分離純化的研究
蔣超,張彧,陳歷俊,姜鐵民
(1大連工業大學,遼寧大連 116034;2北京三元食品股份有限公司,北京 100085)
干酪乳清中乳鐵蛋白分離純化的研究
蔣超1.2,張彧1,陳歷俊2,姜鐵民2
(1大連工業大學,遼寧大連 116034;2北京三元食品股份有限公司,北京 100085)
采用超濾、陽離子交換層析方法從熱鈣法處理過的干酪乳清中分離純化乳鐵蛋白。結果表明,經預處理后的干酪乳清加入經過磷酸鹽緩沖液(pH值為8.0)平衡的樹脂中,分別用濃度為0.3 mol/L和0.8 mol/L的NaCl進行階躍洗脫,所得乳鐵蛋白經SDS-PAGE和免疫印跡法(Western Blotting)檢測,純度達93.6%。
干酪乳清;乳鐵蛋白;離子交換層析
0 引 言
乳清作為生產干酪的副產物,含有多種功能性蛋白,如β-乳球蛋白、α-乳白蛋白、免疫球蛋白、乳鐵蛋白等[1],其中乳鐵蛋白(Lactoferrin,LF)具有促進鐵的吸收,抑菌、抗病毒感染,調節骨髓細胞的生成,調節機體免疫功能,增強機體抗病能力等生理作用[2-5],已成為當前研究的“熱點”。
在我國,對乳鐵蛋白分離純化的研究多以牛初乳和脫脂乳為原料[6-8],而直接從干酪乳清中分離純化乳鐵蛋白的研究卻未見報道。相比牛初乳和脫脂乳,干酪乳清存在混濁度較高,處理過程復雜等問題,因此從乳清中分離純化乳鐵蛋白較困難。本研究以干酪乳清為原料,經熱鈣法澄清乳清,并優化離子交換層析條件,建立適合工業化生產乳鐵蛋白的工藝路線,為合理利用乳清資源提供理論依據。
1 材料與方法
1.1 原料、試劑及儀器
干酪乳清,乳鐵蛋白標品,乳鐵蛋白抗體,堿性磷酸酶標記兔抗羊IgG,BCIP/NBT,CM-Sepharose FastFlow。
穩壓電泳儀,GIS-2010凝膠成像系統,板式超濾設備,YC-1層析實驗冷柜,ALPHA1-2冷凍干燥機,LC-6M大容量冷凍離心機,Cintra 20分光光度計。
1.2 干酪乳清預處理
采用熱鈣法預處理干酪乳清[9],向干酪乳清中加入氯化鈣,攪拌后用濃度為2 mol/L的NaOH調pH值至7.4,在50℃保溫8 min,冷凍離心8 min后取上清液,通過測定上清液的混濁度判斷乳清處理程度[10]。將獲得的上清液通過超濾,進一步去除乳糖等小分子雜質,制備層析樣品。
1.3 離子交換層析
乳清經預處理后,加入經濃度為0.02 mol/L的磷酸鹽緩沖液平衡的CM-Sepharose Fast Flow離子交換柱,以30 cm/h的速度進行洗脫。同時,根據收集乳鐵蛋白的純度及回收率結果,優化層析條件,提高乳鐵蛋白的分離純化效果。
1.3.1 平衡緩沖液pH值選擇
選擇不同pH值 (6.3~8.0)緩沖液平衡離子交換樹脂,通過SDS-PAGE電泳檢測樹脂對蛋白的吸附程度,確定平衡緩沖液pH值范圍;并在該范圍內,選取不同pH值緩沖液平衡樹脂,通過動態吸附確定最適pH值。
1.3.2 洗脫離子強度選擇
用含NaCl濃度為0.3~1 mol/L的磷酸鹽緩沖液平衡樹脂,通過檢測樹脂與乳鐵蛋白結合程度確定洗脫鹽范圍;在選定范圍內,選取不同鹽濃度通過階躍洗脫收集乳鐵蛋白。
1.3.3 洗脫方法選擇
使用5倍于樹脂體積pH值為8.0濃度為0.02 mol/L的磷酸鹽緩沖溶液平衡樹脂,采用兩種洗脫方法分離乳鐵蛋白。方法一采用濃度為0~1 mol/L的NaCl磷酸鹽緩沖液梯度洗脫;方法二采用1.3.2確定的最適洗脫離子強度 (含有濃度為0.3和0.8 mol/L的NaCl磷酸鹽緩沖液)進行階躍洗脫。通過比較確定最佳洗脫方法。
1.4 蛋白檢測方法
(1)總蛋白質量濃度的測定:原料預處理過程中總蛋白質量濃度檢測采用Lowry法[11]。
(2)乳鐵蛋白質量濃度的測定:原料及凍干后乳鐵蛋白質量濃度的測定采用SDS-PAGE法[12],并采用Bandscan分析軟件對電泳條帶純度進行檢測。
1.5 乳鐵蛋白免疫原性分析
將純化的乳鐵蛋白經SDS-PAGE電泳后,通過電轉儀轉移至硝酸纖維素膜上,利用Western Blotting進行免疫原性分析[13]。
2 結果與分析
2.1 總蛋白、脂肪質量濃度及混濁度變化
由于車間生產干酪的乳清,混濁度很高,其中殘余酪蛋白、脂類會嚴重影響分離效果。因此,在上樣液準備前需進行處理。表1為熱鈣處理對乳清中總蛋白、乳鐵蛋白質量濃度及混濁度的影響。由表1可以看出,熱鈣處理后總蛋白及乳鐵蛋白質量濃度有所下降,原因可能是在處理過程中殘余酪蛋白減少以及脂肪、酪蛋白與乳鐵蛋白結合減少所致。但經過處理后的乳清,混濁度(500 nm吸光值)由2.74減小到0.07,可以極大改善后期分離純化的效率。

表1 熱鈣處理對乳清的影響
2.2 乳鐵蛋白分離純化條件的確定
2.2.1 平衡緩沖液pH值
平衡緩沖液pH值主要取決于與被分離物質的等電點,根據文獻報道,乳鐵蛋白等電點在8.0~9.0[14],因此選擇pH值小于8.0的緩沖液平衡離子交換樹脂,通過電泳檢測樹脂與目的蛋白及雜蛋白的結合程度,確定平衡緩沖液pH值范圍,結果如圖1所示。圖1中,1為乳鐵蛋白標品;2~9為平衡緩沖液pH值分別為6.3,6.5,6.8,7.0,7.3,7.5,7.8,8.0。
由圖1可以看出,在pH值為6.3~8.0范圍內,每毫升樹脂都可以結合15 mg左右的乳鐵蛋白,但是pH值低于6.8時,雜蛋白也與樹脂結合,這在洗脫過程中可能會影響到乳鐵蛋白的純度,因此確定平衡緩沖液pH值范圍為6.8~8.0。
在確定緩沖液pH值范圍條件下,分別用pH值為6.8,7.3,7.8,8.0磷酸鹽緩沖液平衡樹脂,通過對洗脫蛋白進行檢測,結果如表2所示。由表2可以看出,乳鐵蛋白得率及純度隨著平衡緩沖液pH值增加逐漸增加,在平衡緩沖液pH值為8.0時,獲得的乳鐵蛋白得率和純度均高于其他pH值,因此,確定平衡緩沖液最適pH值為8.0。
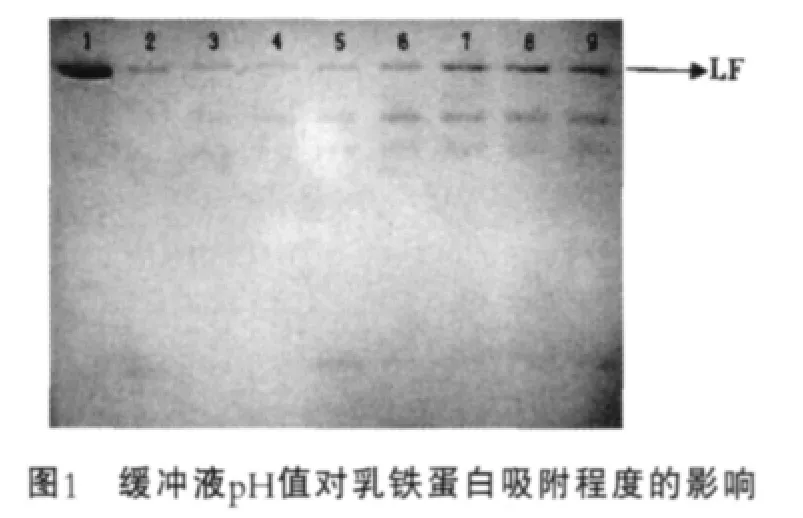
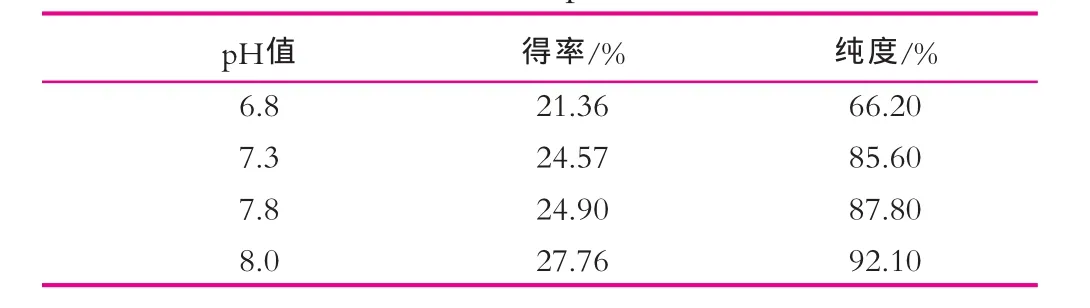
表2 不同緩沖液pH值效果比較
2.2.2 洗脫離子強度
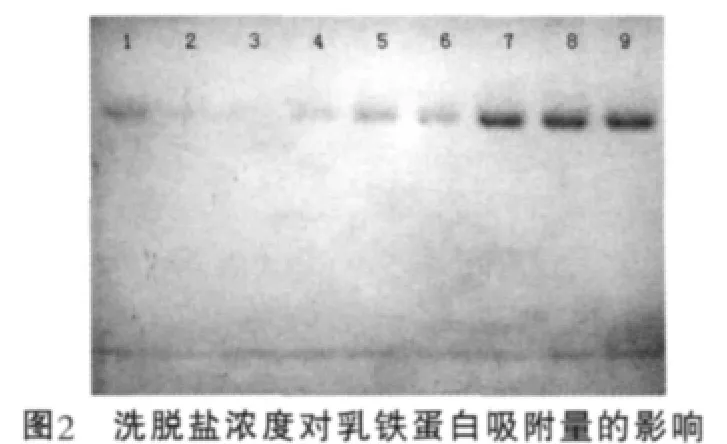
在優化洗脫離子強度前,首先確定了洗脫鹽濃度范圍,選擇含有NaCl濃度為0.3~1 mol/L的磷酸鹽緩沖液平衡樹脂,將乳鐵蛋白樣品加入樹脂中,通過SDSPAGE電泳檢測樹脂上清液中蛋白,由電泳圖可知(圖2),在洗脫鹽濃度為0.3 mol/L時,沒有乳鐵蛋白條帶,這說明在此濃度下,可以很好的洗脫雜蛋白,而不會導致乳鐵蛋白的損失;當隨著洗脫離子強度達到0.6 mol/L后,出現明顯的蛋白條帶并逐漸變寬,但在濃度達到0.8 mol/L之后,條帶不再變化,因此在試驗中選擇濃度為0.6,0.8,1.0 mol/L的NaCl洗脫乳鐵蛋白,確定最佳洗脫離子強度。圖2中,1為乳鐵蛋白標品;2~9為洗脫鹽質量濃度為0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mol/L。
按照電泳確定的洗脫離子強度范圍,在優化試驗中選擇濃度為0.3 mol/L的NaCl洗脫雜蛋白,然后分別采用濃度為0.6,0.8,1.0 mol/L的NaCl洗脫乳鐵蛋白。結果表明,采用濃度為0.8 mol/L的NaCl洗脫乳鐵蛋白的得率為29.56%,純度為93.60%,結果如表3所示。由表3可以看出,雖然純度比濃度為0.6 mol/L的NaCl洗脫略低,但是得率是最高的。因此,從工業化生產考慮,確定最佳洗脫鹽濃度為0.8 mol/L的NaCl。
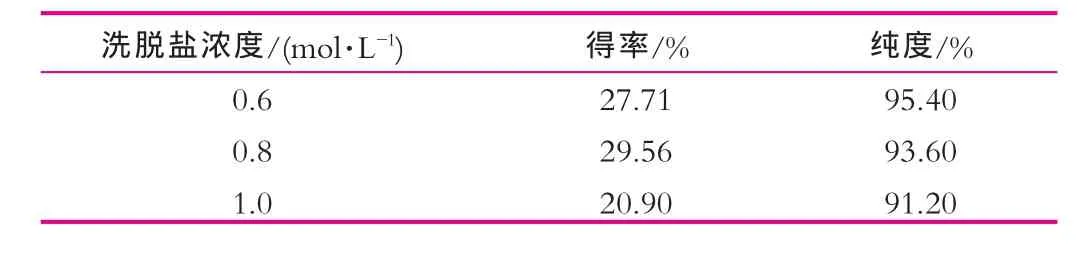
表3 洗脫鹽濃度效果比較
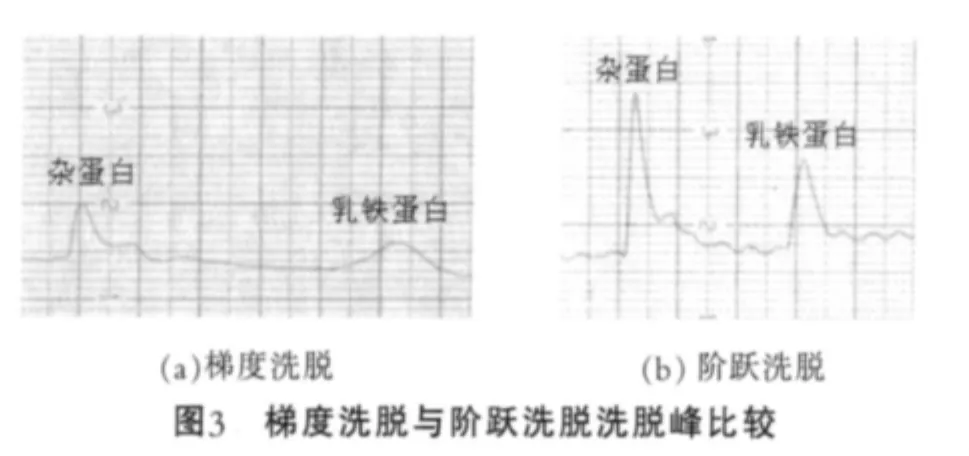
2.2.3 洗脫方法
為確定乳鐵蛋白最佳洗脫方法,試驗中比較了梯度洗脫和階躍洗脫兩種方法對乳鐵蛋白分離效果的影響,由收集峰圖可知(圖3),采用梯度洗脫,收集峰變化緩慢,很難將乳鐵蛋白收集,原因可能是流動相的濃度增大太慢,導致峰型變寬,影響分離效果;而換用濃度為0.3 mol/L與0.8 mol/L的NaCl進行階躍洗脫,則會出現兩個尖銳的峰,可以很好的收集乳鐵蛋白。
根據對不同洗脫方法收集的乳鐵蛋白進行檢測,結果如表4所示。由表4可以看出,在上樣量相同條件下,階躍洗脫與梯度洗脫相比,用時較短,得率較高。因此,試驗中選擇階躍洗脫,這樣可以省去梯度洗脫裝置、節約時間,有利于大規模生產。

表4 梯度洗脫與階躍洗脫結果比較
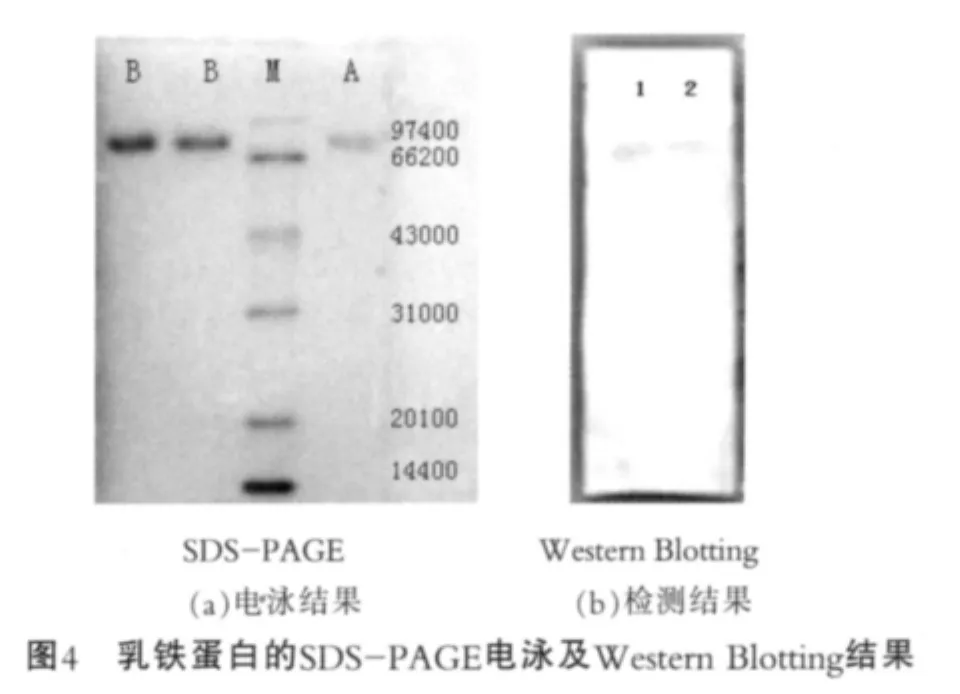
2.3 優化后分離LF的SDS-PAGE及WesternBlotting結果
最終對純化的蛋白與乳鐵蛋白標品進行SDSPAGE電泳和Western Blotting檢測。圖4為乳鐵蛋白的SDS-PAGE電泳及Western Blotting結果。 由圖4(a)可以看出,純化蛋白分子量在78 000 u左右,與標準乳鐵蛋白分子量一致;由圖4(b)可以看出,樣品經Western Blotting檢測,在標準品相同位置出現特異性條帶,由此證明分離純化的乳鐵蛋白具有免疫活性;在試驗中采用的一抗是通過人乳鐵蛋白制備的抗體,這說明牛乳鐵蛋白與人乳鐵蛋白有較高同源性,免疫血清有較強的交叉反應能力,這與其他人報道的試驗結果是一致的[15]。圖4中,M為marker(低分子量標準蛋白);A為乳鐵蛋白標品;B為分離純化樣品;1為乳鐵蛋白標品;2為分離純化樣品。
3 結 論
本研究主要以生產干酪的副產物乳清為原料分離純化乳鐵蛋白,通過熱鈣法預處理干酪乳清,經超濾、離子交換層析,最終獲得分子量為78 000 u,純度為93.6%的乳鐵蛋白,此法簡單易行,成本較低,為工業化分離乳鐵蛋白及乳清的合理利用提供了理論依據。
[1]MADUREIRA A R,PEREIRA C I,GOMES A M P,et al.Bovine Whey Proteins-Overview on Their Main Biological Properties[J].Food Res Int,2007,40:1197-1211.
[2]CONNEELY O M.Antiinflammatory Activities of Lactoferrin[J].J Am Coll Nutr,2001,20(5):389-395.
[3]LEVAY P F,VILJOEN M.Lactoferrin:A General Review[J].Haematologica,1995,80:252-267.
[4]GONZALEZ-CHAVEZ S A,AREVALO-GALLEGOS S,RASCON-CRUZ Q.Lactoferrin:Structure,Function and Applications[J].Int J Antimicrob Agents,2008,33(4):301.
[5]WAKABAYASHI H,YAMAUCHI K,TAKASE M.Lactoferrin Research,TechnologyandApplications[J].IntDairyJ,2006(16):1241-1251.
[6]呂立獲,周曉云,姚婷婷,等.乳鐵蛋白的分離工藝研究[J].中國乳品工業,2005,33(8):10-13.
[7]凌雪萍,龐廣昌,李國強.乳鐵蛋白的分離及純化[J].食品與發酵工業,2003,29(5):7-10.
[8]葉震敏,王志耕,余為一.牛初乳中乳鐵蛋白的分離純化與免疫功能檢測[J].食品科學,2005,26(7):208-211.
[9]WOLMAN F J,GONZALEZ MAGLIO D,GRASSELLI M,et al.OnestepLactoferrinPurificationfrom BovineWhey and Colostrum by Affinity MembraneChromatography[J].JMembrSci,2007,288:132-138.
[10]HWANG D,DAMODARAN S.Selective Precipitation and Removal of Lipids from Cheese Whey Using Chitosan[J].Agric Food Chem,1995,43:33-37.
[11]汪家政,范明.蛋白質技術手冊[M].北京:科學出版社,2002:47-50.
[12]李珊珊,王加啟,魏宏陽,等.乳及乳制品中乳鐵蛋白定量測定法SDS-PAGE法的建立[J].中國乳業,2008,(9):42-46.
[13]TSUJI S,HIRATA Y,MATSUOKA K.Two Apparent Molecular forms of Bovine Lactoferrin[J].J Dairy Sci,1989,72:1130-1136.
[14]BrockJH.ThePhysiologyofLactoferrin[J].BiochemCellBiol,2002,80:1-6.
[15]林成招,張彥明,陳偉華,等.肝素親和柱分離純化乳鐵蛋白[J].色譜,2003,21(4):434.
Study on separation and purification of lactoferrin in cheese whey
JIANG Chao1,2,ZHANG Yu1,CHEN Li-jun2,JIANG Tie-min2
(1.Dalian Polytechnic University,Dalian 116034,China;2.Beijing Sanyuan Foods Co.Ltd.,Beijing 100085,China)
This paper was intended to separate and purify lactoferrin from cheese whey through thermocalcic?precipitation,ultrafiltration and cation-exchange chromatography.It was showed that the pretreated cheese whey was applied to the resin,which was previously equilibrated on static state with phosphate buffer(pH=8.0)at 4℃,and eluted with 0.3 mol/L and 0.8 mol/L NaCl respectively in two stages.In addition,lactoferrin was analyzed qualitatively and quantitatively by Western Blotting and SDS-PAGE.The purity of lactoferrin product reached 93.6%.
cheese whey;lactoferrin;cation-exchange chromatography
TS252.59
A
1001-2230(2010)02-0010-03
2009-09-04
蔣超(1983-),男,碩士研究生,研究方向為乳品科學。
陳歷俊

