膽鹽水解酶的研究現(xiàn)狀
岳婷婷,侯紅漫
(大連工業(yè)大學(xué)生物與食品工程學(xué)院,遼寧大連 116034)
膽鹽水解酶的研究現(xiàn)狀
岳婷婷,侯紅漫
(大連工業(yè)大學(xué)生物與食品工程學(xué)院,遼寧大連 116034)
闡述了膽鹽水解酶(BSH)的功能、特性以及對宿主微生物產(chǎn)生的影響;介紹了膽鹽水解酶基因、基因調(diào)節(jié)及同系物;討論了膽鹽水解酶未來研究方向和應(yīng)用的前景。
膽鹽水解酶;膽鹽水解酶基因;次級膽汁酸
0 引 言
眾所周之,人體血清膽固醇含量過高是引發(fā)動(dòng)脈粥樣硬化和心腦血管疾病的重要因素之一。經(jīng)常食用含有益生菌的發(fā)酵制品有助于降低血清膽固醇,選擇在胃腸道中有效的發(fā)揮降膽固醇作用的益生菌菌株是當(dāng)前重要的研究課題之一。
膽鹽水解酶(Bile Salt Hydrolase,BSH)是微生物生長、繁殖過程中產(chǎn)生的一種代謝產(chǎn)物。該酶能水解結(jié)合膽鹽形成氨基酸和游離膽汁酸,從而降低血清中膽固醇含量。本文介紹了有關(guān)膽鹽水解酶的催化機(jī)理,探索了膽鹽水解酶產(chǎn)生的生態(tài)意義,簡要闡述了膽鹽水解酶對人類生理上的影響,對今后膽鹽水解酶的研究工作和合理應(yīng)用提供一些建議和幫助。
1 膽鹽水解酶特性
1.1 膽鹽水解酶降膽固醇概述
膽固醇是一種環(huán)戊烷多氫菲核27碳化合物,分子結(jié)構(gòu)式如(圖1)所示。正常人血清膽固醇含量為1.50~2.50 g/L。在肝臟中,膽固醇的主要去路是轉(zhuǎn)變成膽酸。膽酸衍生的甘氨膽酸和牛磺膽酸是人類的主要膽汁酸,具有促進(jìn)脂類的消化與吸收和抑制膽汁中膽固醇的析出的作用。
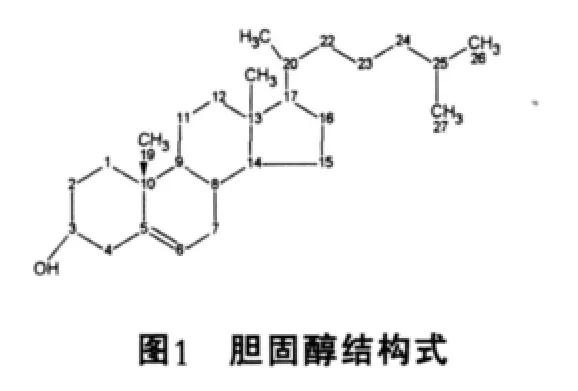
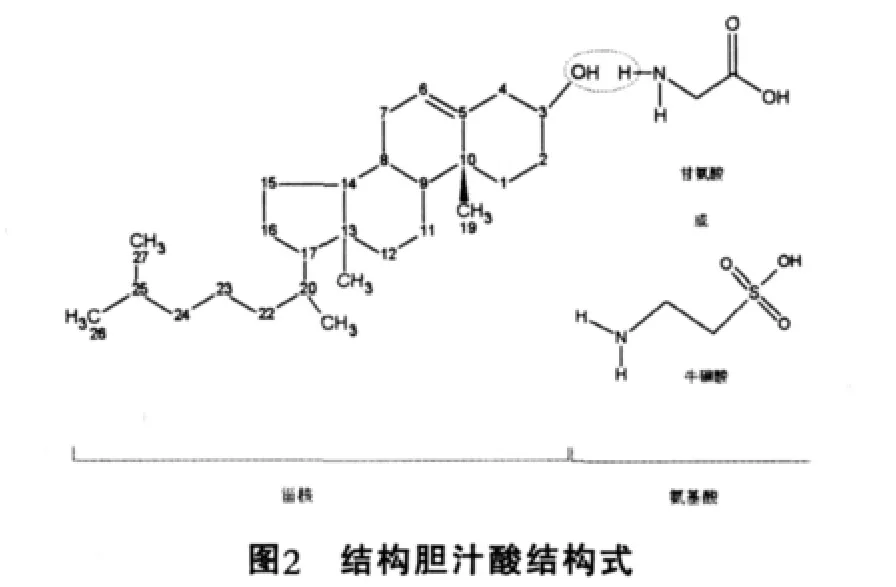
膽汁酸按其結(jié)構(gòu)可分為兩類:一類是游離膽汁酸,包括膽酸,脫氧膽酸,鵝脫氧膽酸和石膽酸;另一類是上述膽汁酸分別與甘氨酸和牛磺酸相結(jié)合的產(chǎn)物,成為結(jié)合膽酸(圖2),主要是甘氨膽酸,牛磺膽酸,甘氨鵝脫氧膽酸和牛磺鵝脫氧膽酸。從來源分可分為兩類:由肝細(xì)胞合成的膽汁酸稱為初級膽汁酸,包括膽酸,鵝脫氧膽酸及其與甘氨酸和牛磺酸的結(jié)合產(chǎn)物;初級膽汁酸發(fā)生7α-脫羥基作用,形成脫氧膽酸和石膽酸稱為次級膽汁酸(圖3)。
膽鹽水解酶是微生物在生長代謝過程中的代謝產(chǎn)物,它可以水解結(jié)合膽鹽形成游離膽汁酸和氨基酸,游離膽汁酸與膽固醇形成復(fù)合物共沉淀下來,從而降低膽固醇含量(圖4)。大量研究表明,BSH具有降低血清中膽固醇的作用。Verstrate認(rèn)為乳酸菌的高膽鹽水解酶活力這一特征在降膽固醇含量方面起著重要作用。Ahn認(rèn)為乳酸菌的BSH在降低膽固醇方面具有重要作用[1]。

1.2 膽鹽水解酶特性
膽鹽水解酶已經(jīng)從很多微生物中提取并鑒定(表1),通常為胞內(nèi)酶,對氧不敏感,最適pH表現(xiàn)為弱酸性(一般為5~6)。膽鹽水解酶催化結(jié)合膽鹽的水解,膽鹽的解離是指酶水解C-24 N末端與氨基酸結(jié)合的酰胺鍵。這個(gè)反應(yīng)是底物限制性反應(yīng)并在大腸中完成。膽鹽水解酶(BSH)屬于膽酰甘氨酸水解酶系,與球形桿菌青霉素V酰胺酶有一些共同的保守性氨基酸的活性位點(diǎn)(Cys2,Arg18,Asp21,Asn175和Arg228)和高度相似的氨基酸序列。青霉素V酰胺酶的Tyr82與BSH Asn82的保守性很可能是因?yàn)樗鼈兏髯缘孜锼枨蟮目臻g不同所導(dǎo)致的[2]。結(jié)構(gòu)顯示Cys2殘基位于N-末端酰胺鍵親核攻擊的位點(diǎn)上。長雙歧桿菌和雙歧桿菌的BSH Cys2殘基的定向誘變和一些BSH的巰基抑制作用都說明了這個(gè)殘基在催化中的重要性[3]。BSH氨基酸順序的排列顯示了在所有BSH的Cys2殘基都是保守的。廣泛的底物特異性有一個(gè)潛在的功能,產(chǎn)氣莢膜桿菌膽鹽水解酶基因編碼產(chǎn)物(CBAH-1)的底物結(jié)構(gòu)域能結(jié)合缺少保守性的殘基,而這些殘基可以通過與其他BSH氨基酸多重序列比對進(jìn)行預(yù)測。 在產(chǎn)氣莢膜桿菌的CBAH-1中固醇官能團(tuán)和羧基上的氫鍵一樣最初是通過疏水性相互作用相連接的。CBAH-1的結(jié)晶結(jié)構(gòu)并未顯示出對牛磺/甘氨官能團(tuán)特異識別,但在一些BSH的動(dòng)力學(xué)數(shù)據(jù)表明軛合物對底物特異性很重要(表1)。因此,對不同菌種的BSH進(jìn)行額外的結(jié)晶化和定向誘變(最好對Cys2的誘變)對解釋底物特異性的動(dòng)力學(xué)觀測是非常有幫助的[4]。
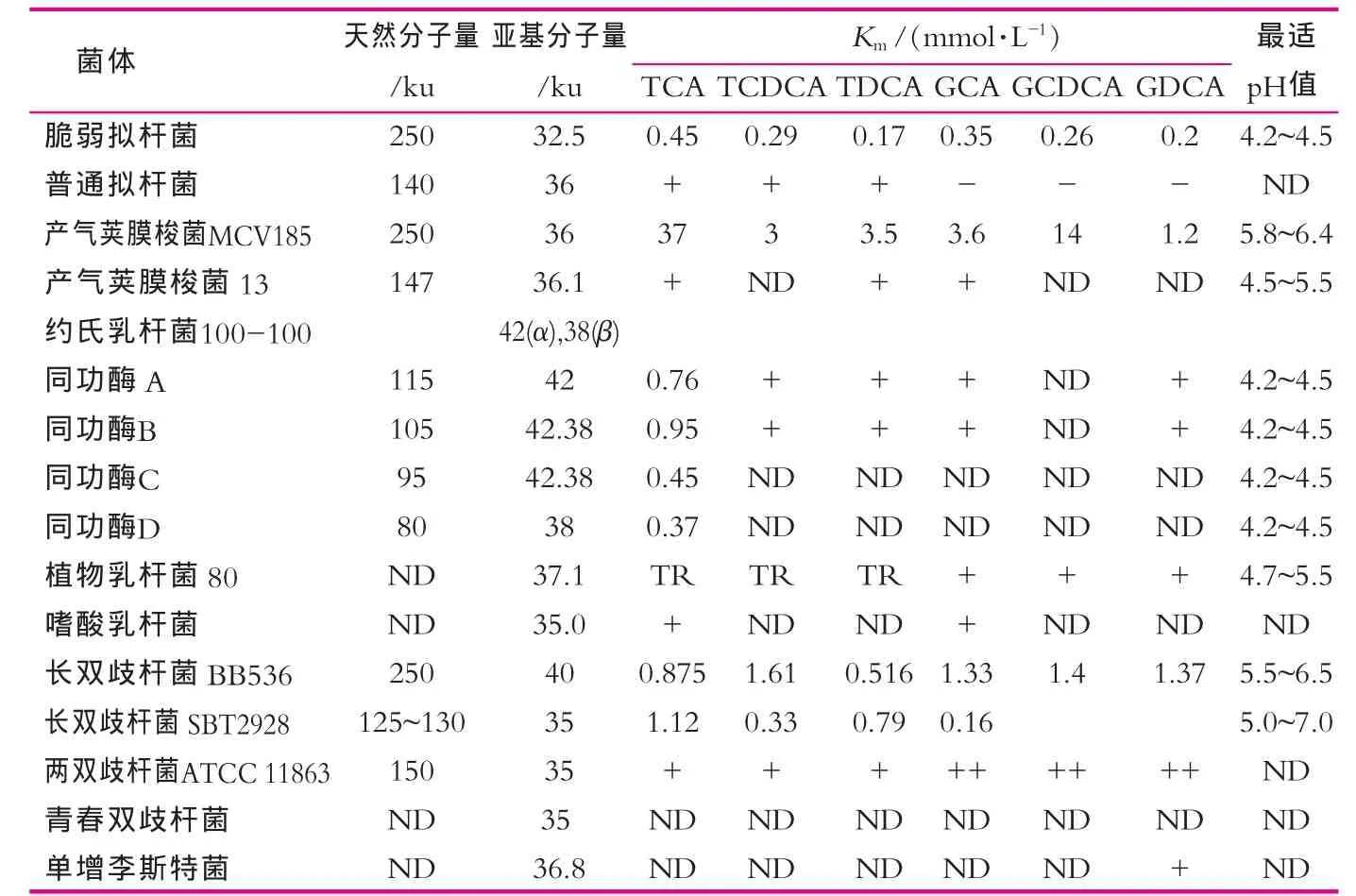
表1 人類腸細(xì)菌BSH特性
1.3 膽鹽水解酶生產(chǎn)菌
乳酸桿菌,雙歧桿菌,腸道球菌,梭狀芽孢桿菌和擬桿菌屬均能檢測到BSH活性。乳酸桿菌和雙歧桿菌為益生菌;腸道球菌,梭狀芽孢桿菌和擬桿菌屬是也是腸道內(nèi)的共生菌群。迄今為止,在缺少膽鹽的環(huán)境下生長的細(xì)菌(如乳酸乳球菌和嗜熱鏈球菌)中還檢測到有活性的BSH[5,6]。除了擬桿菌屬的兩株菌之外,其余所有的BSH陽性菌均是革蘭氏陽性菌。其余所有腸道內(nèi)革蘭氏陰性菌檢測發(fā)現(xiàn),既沒有BSH活性,而且基因也不具有bsh同源性[7]。
革蘭氏陽性腸道致病菌單增李斯特菌不是正常的腸道菌,但具有BSH活性[6]。有1%~10%的人體內(nèi)有單增李斯特菌,但并沒有病癥的出現(xiàn),所以推斷該菌是界于致病菌和共生菌之間的[8]。糞腸球菌是人類腸道內(nèi)的正常菌群,它是一種條件性致病菌,在致病基因片段上發(fā)現(xiàn)bsh同系物(EF0040,AAM75246)[9],但是這個(gè)基因片段的功能特性還尚未清楚。麥芽黃單胞菌是一種革蘭氏陰性條件病原體,它能引起許多疾病,但是大多數(shù)患者能通過呼吸系統(tǒng)的作用自然康復(fù)。Dean等從該菌中分離純化出一種具有膽鹽水解活性的蛋白質(zhì)[10],N-末端序列顯示該蛋白質(zhì)與其他特性BSH并不一樣。它可能不是“真”的BSH,它的缺乏bsh同源性將會給BSH蛋白家族帶來較大的分歧。
2 膽鹽水解酶對菌體的意義
BSH可以提高高等動(dòng)物下胃腸道菌體的群集。BSH的生理學(xué)意義還沒有完全的了解,而且在不同的種屬間也會存在差異。有人推測膽鹽的解離可能是一種解毒機(jī)制。De Smet等發(fā)現(xiàn)在植物乳桿菌發(fā)現(xiàn)甘氨酸結(jié)合膽鹽的解離率明顯高于牛磺酸結(jié)合膽鹽。人類腸道內(nèi)乳酸菌分泌的BSH通常對甘氨酸軛合物有較高的親和力[11]。體外實(shí)驗(yàn)顯示,在各種pH值條件下牛磺氨酸結(jié)合膽鹽對細(xì)菌細(xì)胞的毒害都很微弱,而甘氨酸結(jié)合膽鹽在酸性pH值條件下對細(xì)菌細(xì)胞的毒害很強(qiáng)。因此,在低pH值條件下(如膽汁進(jìn)入十二指腸,胃酸回流的部位,乳酸菌作用下的腸道環(huán)境)BSH降低甘氨酸結(jié)合膽鹽的毒害性的作用就更加重要[12]。
病原體抵抗膽鹽毒性的辦法就是移居在腸道內(nèi)。近期,在單增李斯特菌的BSH發(fā)現(xiàn)一種異常的致病因子。經(jīng)過染色體組比對分析,在與單增李斯特菌非常相似的無害李斯特菌中發(fā)現(xiàn)缺失了一種bsh基因[13]。這個(gè)基因被PrfA正向調(diào)節(jié),PrfA是單增李斯特菌中一種為數(shù)眾多的毒性基因的轉(zhuǎn)錄激活因子。這個(gè)bsh基因的缺失導(dǎo)致在或體內(nèi)對膽鹽的抗性的減少和侵染力明顯減少。這些結(jié)果說明了BSH活性對于李斯特菌在活體內(nèi)的存活和在腸道和肝的感染力是非常重要的。單增李斯特菌BSH活性能提高存活力和毒力的機(jī)制還尚不清楚。
另外,解離可能是為一些菌種提供細(xì)胞內(nèi)的碳,氮和硫的一種途徑。這已經(jīng)在擬桿菌屬和長雙歧桿菌中得到了證實(shí)[14,2]。事實(shí)上,長雙歧桿菌的bsh基因與編碼谷氨酰胺合成腺苷酰基轉(zhuǎn)移酶(glnE)的基因發(fā)生共轉(zhuǎn)錄,glnE是氮調(diào)節(jié)酶系的組成部分。基于這個(gè)觀點(diǎn),結(jié)合膽汁酸的水解提供了氨基氮,也為表面上看似生理上沒有聯(lián)系的基因的協(xié)同調(diào)控提供了一個(gè)可能的解釋[2]。牛磺酸的利用也是非常廣泛的,可以在有氧和無氧條件下作為能源物質(zhì)[15]。甘氨酸可以作為特定梭菌屬Stickland反應(yīng)的能源物質(zhì)[16]。Stickland反應(yīng)是一種氨基酸發(fā)酵的形式,就是一個(gè)氨基酸提供電子被另一個(gè)不同的氨基酸獲得。另一種假說就是BSH是一種去垢劑,它可以撞擊蛋白質(zhì),微生物在有刺激的外界環(huán)境下可以存活[17]。但是De Smet等在用不同的去垢劑培養(yǎng)乳酸菌后對這個(gè)假說并沒有得到證實(shí)[11]。
BSH在腸道菌的廣泛分布加上它廣泛的底物特異性,遺傳調(diào)節(jié),和特定菌株的多重亞基的存在,使得在結(jié)合膽汁酸水解對菌體本身的生理益處出現(xiàn)了不一致的報(bào)道。BSH幫助哺乳動(dòng)物腸道內(nèi)細(xì)菌的群集決定性機(jī)制,尤其是關(guān)于菌體發(fā)病機(jī)理的研究將會受到廣泛的關(guān)注。
3 膽鹽水解酶基因,基因調(diào)節(jié)及同系物
3.1 膽鹽水解酶基因及基因調(diào)節(jié)
在產(chǎn)氣莢膜桿菌,植物乳桿菌,約氏乳桿菌,兩歧雙歧桿菌,長雙歧桿菌,和單增李斯特菌中克隆出編碼BSH的基因,并在大腸桿菌中得到表達(dá)。最近通過微生物染色體組分析已經(jīng)鑒定出同系物并推測出bsh基因。編碼BSH的基因和基因調(diào)節(jié)因種屬的不同而不同。目前已經(jīng)報(bào)道了植物乳桿菌,約氏乳桿菌,單增李斯特菌和兩歧雙歧桿菌中單順反子的BSH基因。一個(gè)從產(chǎn)氣莢膜桿菌克隆出的編碼BSH(CBAH-1)的基因片段在大小和氨基酸序列上與從另一株不同的產(chǎn)氣莢膜桿菌有著明顯的不同。編碼CBAH-1的基因的失活會導(dǎo)致BSH活性的部分減少 (在野生型中86%BSH活性),表明了產(chǎn)氣莢膜桿菌bsh基因的多重性。此外,CBAH-1是以有活性的同源四聚體存在的[18]。盡管目前對從產(chǎn)氣莢膜桿菌獲得的bsh基因的基因組和基因調(diào)節(jié)還不明確,但以上這些觀察,加上對細(xì)胞內(nèi)和細(xì)胞外BSH的觀測,為多重亞基提供了更多的證據(jù)。在約氏乳桿菌和嗜酸乳桿菌已經(jīng)測出有關(guān)膽鹽解離的多順反子操縱子編碼的3個(gè)基因(cbsT1,cbsT2,cbsHβ),cbsT1和cbsT2編碼牛磺膽酸鹽/CA主要超家族成員的反向運(yùn)輸?shù)鞍祝鴆bsHβ則編碼BSH β-亞型[19]。另外,在約氏乳桿菌100-100中發(fā)現(xiàn)了一種未知細(xì)胞外因子,它可以激活BSH的活性并可以在停滯期時(shí)促進(jìn)結(jié)合膽鹽的吸收[20]。
3.2 益生菌bsh基因同系物
根據(jù)益生菌細(xì)菌的基因序列數(shù)據(jù)庫,在所有的腸道菌中鑒定出了bsh同系物(表2)。值得注意的是,有些菌(植物乳桿菌WCFS1)具有一種以上的不同的bsh同系物。這對之后的BSH同系物的多重性的討論有重要的意義。所有的菌種的序列分析顯示bsh區(qū)域在染色體上的位置是不同的[21]。
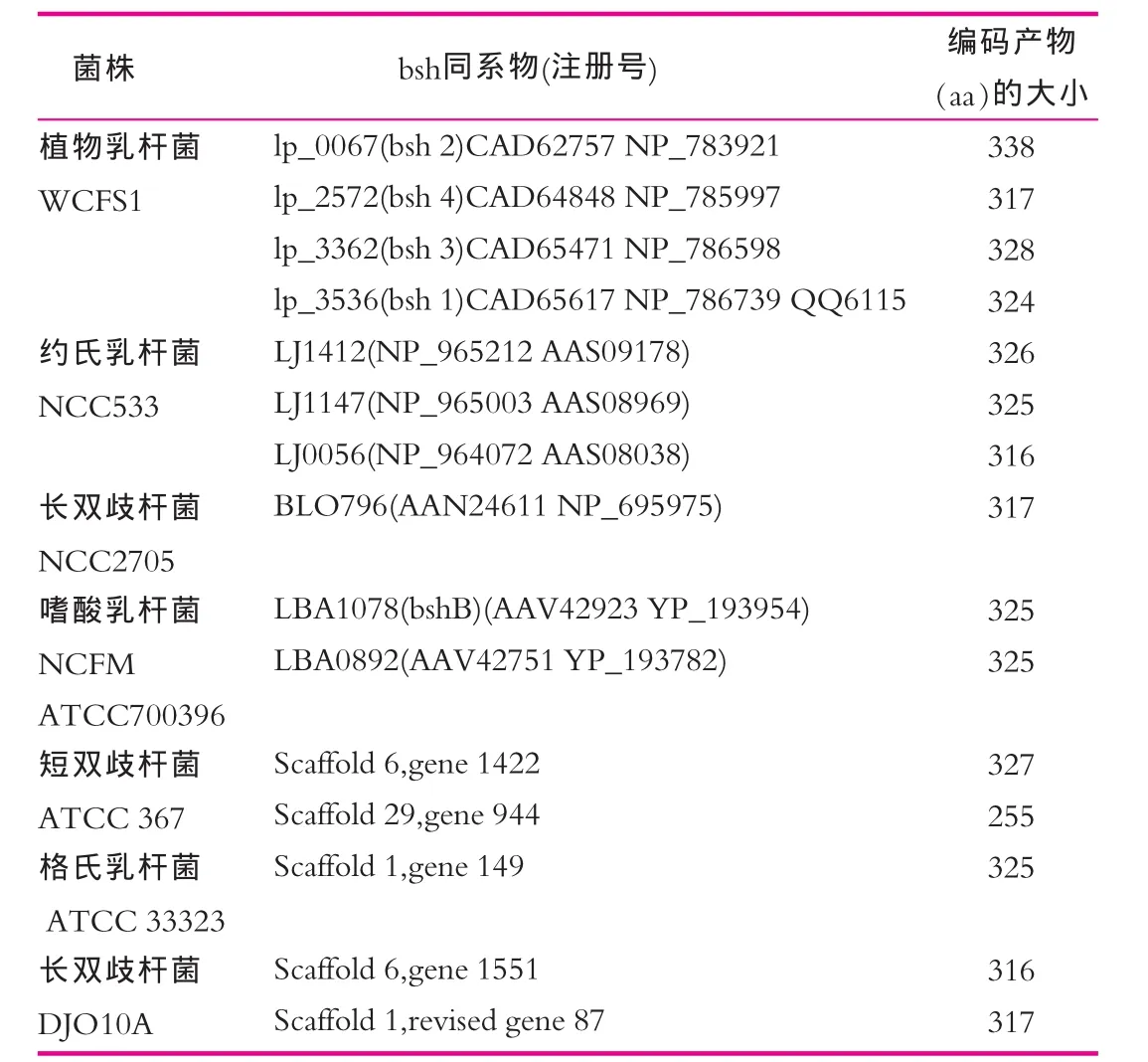
表2 益生菌中bsh基因同系物[7]
3.3 bsh基因的平行傳遞
在一些獨(dú)自隔離生長的菌種中發(fā)現(xiàn)了不同的BSH表型,從中可以推斷bsh基因可以后天獲得。Elkin等人對嗜酸乳桿菌KS-13和約氏乳桿菌100-100進(jìn)行了研究,發(fā)現(xiàn)他們的bsh基因與其周圍的基因序列相比,在bsh上幾乎沒有側(cè)翼[22]。另外,約氏乳桿菌100-100 bsh基因下游編碼一組內(nèi)含子組II蛋白,這類蛋白質(zhì)具有反轉(zhuǎn)錄酶的活性,具有成熟酶,核酸內(nèi)切酶的功能,還可以是cDNA更容易移動(dòng)和連接到基因組中去。內(nèi)含子組II蛋白通常會連接在可動(dòng)的遺傳因子上,進(jìn)而bsh基因的平行傳遞。嗜酸乳桿菌NCFM完全基因組序列的測定揭示了這個(gè)菌種具有兩種bsh基因(bshA,bshB),這兩種基因各自編碼的蛋白的相似性確遠(yuǎn)遠(yuǎn)低于其他乳酸菌的BSH,說明這兩個(gè)基因的來源是不同的[23]。
單增李斯特菌的bsh基因在非致病菌無害李斯特菌中并沒有發(fā)現(xiàn),而側(cè)翼區(qū)兩者的組成都是相同的。另外,單增李斯特菌的bsh基因的G+C含量比相鄰的基因低(36%:38~41%),但是同植物乳桿菌bsh基因G+C含量相近,而且編碼的蛋白與乳酸桿菌的BSH有著高度的同源性(有67%的同一性)[6]。這些觀察加上在生命循環(huán)中與乳酸桿菌享有相同的微環(huán)境(腸道,衰弱的機(jī)體,食物和蔬菜),有力的表明了李斯特菌的基因很可能是從乳酸桿菌中獲得的。
還有值得注意的是長雙歧桿菌SBT2928中bsh基因的側(cè)翼是反向重復(fù)序列,這個(gè)反向重復(fù)序列可能起著基因的平行傳遞的作用[2]。Kim等研究表明bsh基因在所有雙岐桿菌屬測試菌株中都顯示了高度的保守性,并且bsh基因的G+C含量反映了基因組的所有G+C含量。目前為止,并沒有有關(guān)其他高G+C含量革蘭陽性菌的BSH活性的相關(guān)報(bào)道,但在所有的雙岐桿菌中均發(fā)現(xiàn)了BSH活性,說明在雙岐桿菌屬基因組中bsh基因很可能是一個(gè)平行進(jìn)化同源基因[24]。
綜上所述,BSH存在于胃腸道環(huán)境下所有的雙岐桿菌屬和乳酸桿菌中,但這bsh基因也可被其他腸道菌從這些菌中獲得(如單增李斯特菌)。
4 膽鹽水解酶對人體的影響
血清中膽固醇水平增高是誘發(fā)冠心病、動(dòng)脈粥樣硬化等心血管疾病的重要危險(xiǎn)因子。口服益生菌能顯著降低血清中膽固醇水平達(dá)22%~33%或防止高脂肪喂小鼠的血清膽固醇水平的增高。這種降膽固醇作用可部分歸功于BSH活性。BSH水解膽鹽從而降低膽固醇水平,但是水解產(chǎn)物卻可能產(chǎn)生對人體不利的影響。
4.1 牛磺酸,硫化氫和結(jié)腸癌
膽汁酸結(jié)合甘氨酸和牛磺酸可以做為微生物新陳代謝的底物。和甘氨酸不一樣,牛磺酸含有酸性硫酸基,水解后一部分被解離,一部分異化生成硫化氫[25,26]。硫化氫具有較高的毒性并且能加速結(jié)腸細(xì)胞的更新[27]。還能抑制結(jié)腸細(xì)胞丁酸鹽的代謝,而丁酸鹽是腸道內(nèi)關(guān)鍵的營養(yǎng)物質(zhì)和細(xì)胞更新的調(diào)節(jié)者[27]。飲食較多肉類則膽汁酸中的牛磺酸軛合物的水平和結(jié)腸內(nèi)產(chǎn)生的硫化氫會明顯增高[28]。
4.2 次級膽汁酸與疾病
在人類的排泄物中,次級膽汁酸(脫氧膽酸和石膽酸)含量是相對較高的。因此,在人體結(jié)腸細(xì)菌膽鹽的生物轉(zhuǎn)化是非常重要的。7α-脫羥基作用只發(fā)生在游離膽汁酸上。所以腸細(xì)菌起7α-脫羥基作用的一個(gè)前提就是通過BSH將甘氨酸/牛磺酸結(jié)合膽汁酸水解。
血清,膽汁和糞便中高含量的脫氧膽酸會增加患膽結(jié)石和結(jié)腸癌疾病的危險(xiǎn)。排泄物中膽酸7α-脫羥基作用的菌量增多會使膽汁中脫氧膽酸的含量升高,這是膽結(jié)石病人的一個(gè)癥狀。使用抗生素可以明顯減少這種病人排泄物中膽酸7α-脫羥基作用菌,減少膽汁中的脫氧膽酸,降低膽汁中的膽固醇飽和指數(shù)[28]。此外,膽汁中過量的脫氧膽酸會減少膽固醇結(jié)晶的成核時(shí)間[33]。多數(shù)的動(dòng)物實(shí)驗(yàn)表明脫氧膽酸是致癌作用的啟動(dòng)子。還有一些研究者爭論膽汁酸在人體內(nèi)可能會使DNA損壞成為致癌物[30]。而石膽酸是一種很好的維生素D受體的激活劑。腸的表皮細(xì)胞內(nèi)這個(gè)受體的激活可以激活基因使石膽酸代謝[31]。這可能就是腸道表皮細(xì)胞限制石膽酸毒性的保護(hù)機(jī)制。
益生菌中的BSH活性是否是人們所期待的?綜上所述,有力的說明了微生物BSH具有解毒作用,可以提高腸道存活率。BSH活性可以最大程度的提高益生菌在宿主腸道環(huán)境中的存活率,同時(shí)也提高了益生菌對人體的有利效應(yīng),這個(gè)結(jié)果是人們所期待的。
膽鹽的解離會對宿主帶來一些負(fù)面的影響(如前描述),關(guān)于BSH-陽性益生菌充當(dāng)藥物的安全性越來越受到人們的關(guān)注。大部分益生菌沒有脫羥基作用來解離膽鹽的能力,所以大部分益生菌產(chǎn)生的有活性的BSH產(chǎn)物被解離和隨糞便排出(因人結(jié)腸pH值和腸道通過時(shí)間的不同而不同)[5,32]。另外有研究表明,防止腸道內(nèi)其他細(xì)菌作用而使解離產(chǎn)物進(jìn)一步修飾是有可能的(梭狀芽胞桿菌和真細(xì)菌類兩種菌株具有脫羥基活性)。首先,Jones等將一株BSH陽性菌植物乳桿菌包埋在人工膜中來水解膽鹽,實(shí)驗(yàn)表明微囊包埋菌株可以有效的防止生理環(huán)境下高濃度膽鹽對菌株的破壞,水解產(chǎn)物也包在膜里[33]。第二,Kurdi等人的研究揭示了在腸道內(nèi)BSH作用膽鹽水解產(chǎn)物為膽汁酸,主要為游離膽汁酸,只要給雙岐桿菌屬和乳酸菌菌株提供能量,游離膽汁酸就會積累。大量的積累會加強(qiáng)細(xì)胞外pH值的降低,表明腸道pH值的降低因子是乳酸桿菌在體內(nèi)作用產(chǎn)生膽汁酸積累[34]。
綜上所述,BSH活性對益生菌在腸道環(huán)境下生存提供了有利的條件。菌株的微膠囊化,淘汰沒有對未解離膽鹽進(jìn)一步修飾功能和在醫(yī)藥方面產(chǎn)生副作用的菌株,都是BSH活性研究的方面。
5 展 望
未來的研究中為了更好的了解BSH的功能,要對高產(chǎn)膽鹽水解酶益生菌進(jìn)行合理的選擇,雖然已明確BSH能明顯的促進(jìn)菌株在腸道內(nèi)對膽鹽的耐受性,提高存活率和持久性,還應(yīng)進(jìn)一步確定膽鹽水解酶在胃腸道微生物中所發(fā)揮的具體作用;研究利用基因工程技術(shù),更簡單、快速的找到高產(chǎn)BSH的益生菌株;研究利用膽鹽水解活性菌株給藥的方法,來控制血清膽固醇也是非常令人期待的。食用含有益生菌的食物的生物方法比其他降膽固醇的方法更天然,更會被現(xiàn)代的健康理念所接受。
[1]王玉文.開菲爾源干酪乳桿菌產(chǎn)膽鹽水解酶的研究[D].中國農(nóng)業(yè)大學(xué),2006.
[2]TANAKA H,HASLUBA H,KOK J,et al.Bile Salt Hydrolase of Bifidobacterium longum:Biochermical and Genetic Characterization[J].Appl Environ Microbiol,2000,66:2502-2512.
[3]ELKINS C A,MOSER S A,SAVAGE D C.Genes Encoding Bile Salt Hydrolases and Conjugated Bile Salt Transporters in Lactobacillus Johnsonii 100-100 and Other Lactobacillus species[J].Microbiology,2001,147:3403-3412.
[4]JASON M RIDLON,DAE-JOONG KANG,PHILLIP B HYLEMON.Bile Salt Biotransformations by Human Intestinal Bacteria[J].J Lipid Research,47:241-259.
[5]KIM G B,LIM Y S,BAEK Y J,et al.Deconjugation of Bile Salts by Lactobacillus acidophilus[J].Int Daity J,2003,13:303-311.
[6]GAHAN C G M,HILL C.The Contribution of Three Bile-associated loci(bsh,pva,and btlB)to Gastrointestinal Persistence and Bile Tolerance of Listeria monocytogenes[J].Infect Immun,2005,73:894-904.
[7]BEGLEY MAIRE,HILL COLIN G M,GAHAN CORMAC.Bile Salt Hydrolase Activity in Probiotics[J].American Society for Microbiology,2006,72(3),1729-1738.
[8]CABANES D,DEHOUX P,LECUIT M,et al.Listeria monocutogenes Bile Salt Hydrolase is a PrfA-regulated Virulence Factor Involved in the Intestinal and Hepatic Phases of Listeriosis[J].Mol Microbiol,2002,45:1095-1106.
[9]BAGHDAYAN A S,GILMORE M S..Modulation of Virulence Within a Pathogenicity Island in Vancomycin-resistant[J].Enterococcus faecalis Nature,2002,417:746-750.
[10]DEAN,M CERVELLATI,CASANOVA E,et al.Characterization of Cholylglycine Hydrolase From a Bile-adapted Strain of Xanthomonas maltophilia and its Application for Quantitative Hydrolysis of Conjugated Bile Salts[J].Appl Environ Microbiol,2002,68:3126-3128.
[11]DE SMET,L VAN HOORDE,M VANDE WOESTYNE,et al.Significance of Bile Salt Hydrolytic Activities of Lactobacilli[J].J Appl Microbiology,1995,79:292-301.
[12]牛治霞,劉恩梅,李曉東等.益生菌中膽鹽水解酶(BSH)研究進(jìn)展[J].中國乳品工業(yè),2007,35(9):35-39
[13]GLASER P,FRANGEUL L,BUCHRIESER C,et al.Comparative Genomics of Listeria species[J].Science,2001,294:849-852.
[14]VAN ELDERE J,CELIS P,DE PAUW G,et al.Tauroconjugation of Cholic Acid Stimulates 7α-dehydroxylation by Fecal bacteria[J].Appl Environ Microbiol,1996,62(2):656-661.
[15]COOK A M,DENGER K.Dissimilation of the C2 Sulfonates[J].Arch Microbiol,2002,179:1-6.
[16]LENGELER J W,DREWS G,SCHLEGEL H G.Biology of the Prokaryotes[M].New York:Blackwell Science,1999,756-758.
[17]ADAMOWICZ M,P M KELLEY,K W NICKERSON.Detergent(Sodium Dodecyl Sulfate)Shock Proteins in Escherichia coli[J].J Appl Bacteriol,1991,137:229-233.
[18]ROSSOCHA M,SCHULTZ-HEIENBROK R,VON MOELLER H,et al.Conjugated Bile Acid Hydrolase is a Tetrameric N-terminal Thiol Hydrolase with Specific Recognition of its Cholyl but not of its Tauryl Product[J].Biochemistry,2005,44(15):5739-5748.
[19]ELKINS C A,SAVAGE D C.CbsT2 from Lactobacillus johnsonii 100-100 is a Transport Protein of the Major Facilitator Superfamily that Facilitates Bile Acid Antiport[J].Mol Microbiol Biotechnol,2003,6(2):76-87.
[20]LUNDEEN S G,SAVAGE D C.Multiple Forms of Bile Salt Hydrolase from Lactobacillus sp.Strain 100-100[J].J Bacteriol,1992,172(22):7217-7220.
[21]BEGLEY MAIRE,HILL COLIN,GAHAN CORMAC G M.Bile Salt Hydrolase Activity in Probiotics[J].American Society for Microbiology,2006,72(3),1729-1738.
[22]ELKINS C A,MOSER S A,SAVAGE D C.Genes Encoding Bile Salt Hydrolases and Conjugated Bile Salt Transporters in Lactobacillus johnsonii 100-100 and Other Lactobacillus species[J].Microbiology,2001,147:3403-3412.
[23]MC AULIFFE O,CANO R J,KLAENHAMMER T R.Genetic Analysis of Two Bbile Salt Hydrolase Activities in Lactobacillus acidophilus NCFM[J].Appl Environ Microbiol,2005,71:4925-4929.
[24]KIM G B,MIYAMOTO C M,MEIGHEN E A,et al.Cloning and Characterization of the Bile Salt Hydrolase Genes(bsh)from Bifidobacterium bifidium Strains[J].Appl Environ Microbiol,2004,70:5603-5612.
[25]LAUE H,FRIEDRICH M,COOL A M.Dissimilatory Sulfite Reductase(Desulfoviridin)of the Taurine-degrading,Nnon-sulfate-reducing Bacterium Bilophila Wadsworthia RZATAU Cntains a Fused DsrBDsrD Subunit[J].J Bacteriol,2001,183(5):1727-1733.
[26]LIE T J,CLAWSON M L,GODCHAUX W,et al.Sulfidogenesis from 2-aminoethanesulfonate(Taurine)Fermentation by a Morphologically Unusual Sulfate-reducing Bacterium,Desulforhopalus singaporensis sp.[J].nov App Environ Microbiol,1999,65(8):3328-3334.
[27]CHRISTL S U,EISNER H D,DUSEL G,et al.Antagonistic Effects of Sulfide and Butyrate on Proliferation of Colonic Mucosa:a Potential Role for these Agents in the Pathogenesis of Ulcerative Colitis[J].Dig Dis Sci.1996,41(12):2477-2481.
[28]MAGEE E A,RICHARDSON C J,HUGHES R,et al.Contribution of Dietary Protein to Sulfide Production in the Large Intestine:an in Vitro and a Controlled Feeding Study in Humans[J].Am J Clin Nutr,2000,72:1488-1494.
[29]BERR F,KULLAK-UBLICK G A,PAUMGARTNER G,et al.7αdehydroxylating Bacteria Enhance Deoxycholic Acid Input and Cholesterol Saturation of Bile in Patients with Gallstones[J].Gastroenterology,1996,111(6):1611-1620.
[30]BERNSTEIN H,BERNSTEIN C,PAYNE C M.Bile Acids as Carcinogens in Human Gastrointestinal Cancers[J].Mutat Res,2005,589(1):47-65.
[31]ADACHI R,HONMA Y,MASUNO H,et al.Selective Activation of Vtamin D Receptor by Lithocholic Acid Acetate,a Bile Acid Derivative[J].J Lipid Res,2005,46(1):46-57.
[32]TAKAHASHI T,MOROMI M.Absence of Cholic Ccid Droxylase Activity in the Strains of Lactobacillus and Bi?dobact[J].Dairy Sci,1994,77:3275-3286.
[33]JONES M L,CHEN H,OUYANG W,et al.Microencapsulated Genetically Engineered Lactobacillus plantarum 80(pCBH1)for Bile Acid Deconjugation and its Implication in Lowering Cholesterol[J].J Biomed Biotechnol,2004,1:61-69.
[34]KURDI P H,VAN VEEN H W,TANAKA H,et al.Cholic Acid is Accumulated Spontaneously,Driven by Membrane ΔpH,in Many Lactobacilli[J].J Bacteriol,2003,182:6525-6528.
Study of the bile salt hydrolase
YUE Ting-ting,HOU Hong-man
(College of Biology and Food Engineering of Dalian Polytechnic University,Dalian 116034,China)
This review explained the function of bile salt hydrolase(BSH)lowering cholesterol,and the characteristics of BSH and the impact activity of BSH on bacterium and the human;introduced genetic organization and regulation of BSH,homologues of bsh in bacterium;discussed the future direction and applied prospect of BSH.
bile salt hydrolase;genome;secondary bile acid
Q556
A
1001-2230(2010)02-0033-05
2009-09-22
遼寧省教委創(chuàng)新團(tuán)隊(duì)項(xiàng)目(20061015)。
岳婷婷(1984-),女,研究生,從事食品微生物研究。
侯紅漫
book=37,ebook=61

