自體肺體外循環與常規體外循環對細胞因子影響的實驗對比研究①
林柏松 張秀和 張柏民 姜亦忠 李 哲 (吉林大學中日聯誼醫院心臟外科,長春 130033)
自體肺體外循環與常規體外循環對細胞因子影響的實驗對比研究①
林柏松 張秀和 張柏民 姜亦忠 李 哲 (吉林大學中日聯誼醫院心臟外科,長春 130033)
目的:探討以自體肺取代人工肺的體外循環方法對犬體外循環相關性炎癥反應的影響。方法:將12只雜種犬隨機分為對照組及實驗組(每組6只)。對照組在體外循環(CPB)期間使用膜式氧合器,實驗組在CPB期間使用自體肺進行氧合,兩組均阻斷主動脈90分鐘、輔助循環30分鐘,于CPB前(T1)、轉流后60分鐘(T2)、停機后60分鐘(T3)、停機后120分鐘(T4)抽取動脈血,測定血漿腫瘤壞死因子α(TNF-α)、白細胞介素6(IL-6)、白細胞介素8(IL-8)和白細胞介素 10(IL-10)濃度。結果:兩組實驗犬血漿TNF-α、IL-6、IL-8和IL-10的濃度,在T2~T4各時點與體外循環前比較均明顯增加(P<0.01);T2~T4時點實驗組血漿TNF-α、IL-6和IL-8濃度明顯低于對照組(P<0.01),IL-10濃度明顯高于對照組(P<0.05)。結論:自體肺體外循環可抑制體外循環過程中促炎細胞因子TNF-α、IL-6和IL-8的釋放,促進抗炎細胞因子IL-10的釋放,從而減輕常規體外循環引起的全身炎癥反應。
自體肺;炎癥反應;細胞因子;體外循環
心臟外科的飛速發展離不開體外循環(Cardiopulmonary bypass,CPB)的廣泛支持,但體外循環期間血液成分與體外循環的人工表面接觸可引起急性階段性炎癥反應,進而引起嚴重的術后并發癥。心臟外科醫生始終進行不懈努力以減少血液與異物的接觸面積、增加組織相容性,并不斷開發毒性更低的體外循環管路。自體肺擁有良好的組織相容性,最大限度地降低體外循環相關性炎癥反應的程度,有效地減輕了全身炎癥反應引起的肺損傷。該方法雖然在閉式心臟手術有良好的效果,但在心內直視手術中空氣極易直接進入切開的左心房或經心內缺損進入左心房,造成致命的體循環氣栓,這是該方法在心臟外科早期曇花一現、當前無法廣泛使用的根本原因,近四十年內全球尚無在打開心臟的心內直視手術中使用該方法的報道。本研究為對比使用自體肺體外循環和常規體外循環的實驗研究,觀察圍手術期細胞因子的變化,為進一步在心內直視手術中使用該方法提供依據。
1 材料與方法
1.1 實驗分組 雜種犬12只,體重17~22千克,隨機分為對照組和實驗組,每組6只:對照組為常規體外循環組:在體外循環期間使用膜式氧合器;實驗組在體外循環期間使用自體肺進行氧合。
1.2 方法 實驗犬以苯巴比妥鈉25 mg/kg誘導麻醉后,氣管內插管,人工呼吸機容量控制模式輔助呼吸,吸入氧濃度100%(FiO2=1.0),靜注潘可羅寧0.3 μg/kg,芬太尼100μg/kg,靜點芬太尼[50μg/(kg·h)]維持麻醉。心電監護,右側股動脈置入測壓管,股靜脈置入Swan-ganz導管。胸部正中切口,顯露心臟。肝素化,經升主動脈插入動脈管,經上、下腔靜脈插入靜脈管,建立體外循環。對照組為常規體外循環:在體外循環期間使用膜式氧合器,平均動脈壓在50~70mmHg,阻斷循環期間停止肺通氣。實驗組在體外循環期間使用自體肺進行氧合,肺動脈灌注壓不高于20 mmHg。在鼻溫降至25℃時阻斷上、下腔靜脈及升主動脈,經主動脈根部灌注冷晶體心肌停跳液。心臟阻斷90分鐘,開放上、下腔靜脈、升主動脈、肺動脈。當鼻溫達到 36.5℃、心跳有力、平均動脈壓在60mmHg(8.0 kPa)、再灌注30分鐘時,停體外循環機。
1.3 檢測指標 對照組及實驗組均在體外循環前(T1)、轉流后60分鐘(T2)、停機后 60分鐘(T3)、停機后120分鐘(T4)抽取動脈血,血樣采集入肝素銨試管,用酶聯免疫吸附(ELISA)法測定血漿腫瘤壞死因子α(TNF-α)、白細胞介素 6(IL-6)、白細胞介素8(IL-8)和白細胞介素10(IL-10)濃度。由于CPB期間的血液稀釋程度在不斷變化中,為排除血液稀釋對測定值的影響,所有數據都按下列公式進行矯正,矯正值=實測值×(術前HCT/采樣時HCT)。
1.4 統計學處理 采用SPSS11.0統計軟件進行統計學處理,結果用±s表示,以Studentt檢驗評價兩組配對樣本的差別。P<0.05時雙尾檢查的差別有明顯統計學意義。
2 結果
2.1 各組腫瘤壞死因子α(TNF-α)結果 兩組實驗犬血漿TNF-α濃度在T2~T4各時點與體外循環前比較均明顯增加(P<0.05);T2~T4時點實驗組血漿TNF-α濃度明顯低于對照組(P<0.01)(表1)。
2.2 各組白細胞介素6(IL-6)結果 兩組實驗犬血漿IL-6的濃度在T2~T4各時點與體外循環前比較均明顯增加(P<0.05);T2~T4時點實驗組血漿IL-6濃度明顯低于對照組(P<0.01)(表2)。
2.3 各組白細胞介素8(IL-8)結果 兩組實驗犬血漿IL-8的濃度在T2~T4各時點與體外循環前比較均明顯增加(P<0.01);T2~T4時點實驗組血漿IL-8濃度明顯低于對照組(P<0.01)(表3)。
2.4 各組白細胞介素10(IL-10)結果 兩組實驗犬血漿IL-10的濃度在T2~T4各時點與體外循環前比較均明顯增加(P<0.01);T2~T4時點實驗組血漿IL-10濃度明顯高于對照組(P<0.05)(表4)。
表1 各組腫瘤壞死因子α(TNF-α)結果(n=6,±s,pg/ml)Tab.1 Plasma concentration of TNF-αin each group(n=6,±s,pg/m l)

表1 各組腫瘤壞死因子α(TNF-α)結果(n=6,±s,pg/ml)Tab.1 Plasma concentration of TNF-αin each group(n=6,±s,pg/m l)
Note:T1.Pre-operation,T2.60m in of CPB,T3.1 hour after CPB,T4.2 hour after CPB.1)P<0.01 vs T1;2)P<0.01 vs controlgroup.
T2 T3 T4 3 8.21±0.841)21.57±7.761)12.81±1.561)Study group 3.72±0.51 6.06±0.921)2)9.24±4.251)2)7.32±1.331)2)
表2 各組白細胞介素6(IL-6)結果(n=6,±s,pg/m l)Tab.2 Plasma concentration of IL-6 in each group(n=6,±s,pg/m l)

表2 各組白細胞介素6(IL-6)結果(n=6,±s,pg/m l)Tab.2 Plasma concentration of IL-6 in each group(n=6,±s,pg/m l)
Note:T1.Pre-operation,T2.60m in of CPB,T3.1 hour after CPB,T4.2 hour after CPB.1)P<0.01 vs T1;2)P<0.01 vs controlgroup.
Groups T1 T2 T3 T4 Control group 3.06±0.76 9.96±2.121)54.65±21.131)14.35±2.161)Study group 2.89±0.57 6.58±1.931)2)35.44±10.451)2)7.02±1.471)2)
表3 各組白細胞介素8(IL-8)結果(n=6,±s,pg/m l)Tab.3 Plasma concentration of IL-8 in each group(n=6,±s,pg/m l)

表3 各組白細胞介素8(IL-8)結果(n=6,±s,pg/m l)Tab.3 Plasma concentration of IL-8 in each group(n=6,±s,pg/m l)
Note:T1.Pre-operation,T2.60m in of CPB,T3.1 hour after CPB,T4.2 hour after CPB.1)P<0.01 vs T1;2)P<0.01 vs controlgroup.
Groups T1 T2 T3 T4 Controlgroup 11.56±1.16 29.36±2.421) 56.45±5.731)69.28±7.161)Study group 12.32±1.35 20.58±1.971)2)38.45±7.401)2)40.13±9.471)2)
表4 各組白細胞介素10(IL-10)結果(n=6,±s,pg/ml)Tab.4 Plasma concentration of IL-10 in each group(n=6,±s,pg/ml)
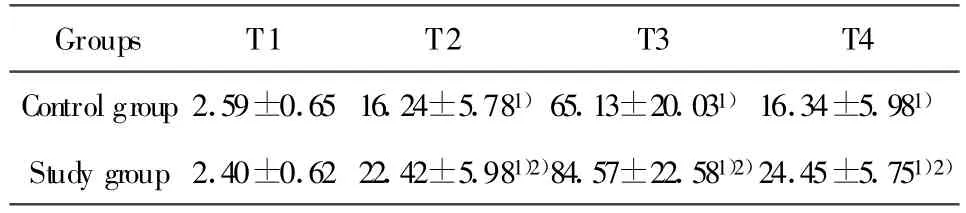
表4 各組白細胞介素10(IL-10)結果(n=6,±s,pg/ml)Tab.4 Plasma concentration of IL-10 in each group(n=6,±s,pg/ml)
Note:T1.Pre-operation,T2.60m in of CPB,T3.1 hour after CPB,T4.2 hour after CPB.1)P<0.01 vs T1;2)P<0.05 vs controlgroup.
Groups T1 T2 T3 T4 Controlgroup 2.59±0.65 16.24±5.781)65.13±20.031)16.34±5.981)Study group 2.40±0.62 22.42±5.981)2)84.57±22.581)2)24.45±5.751)2)
3 討論
CPB經半世紀的探索與改進,技術日益成熟,其安全性得以明顯增加,使得重癥和復雜心臟直視手術死亡率和并發癥明顯下降。但CPB后的全身炎癥反應仍然是心血管外科患者的一個主要并發癥,已成為目前心血管外科的重要研究課題。
CPB的機械剪切作用、血液與體外循環的人工材料表面接觸,可啟動并激活中性粒細胞[1]。致炎介質隨后通過擴增中性粒細胞激活而進一步加重肺損傷[2]。人工氧合器具有巨大的人工表面,是激活凝血反應的強烈刺激[3],即使使用大劑量肝素也不能完全抑制凝血酶的激活,從而進一步激活血小板和白細胞[4],激活的中性粒細胞可在體循環及肺組織內進一步釋放一定數目的蛋白水解酶和氧化化學產物。這些產物包括降解的基質金屬蛋白酶(MMP)、彈性蛋白酶、氧自由基(如髓過氧化物酶、過氧化氫、過氧化物)。這些物質可破壞肺組織的超微結構,導致肺泡-內皮通透性增加而影響氣體交換和肺結構,產生CPB后肺損傷[5]。常規體外循環期間,肺臟被排除在血液循環之外,肺動脈內的血流處于相對靜止狀態,引起血管內皮細胞功能紊亂,導致肺臟再灌注后嚴重的微循環障礙[6]。
本研究發現:實驗組及對照組實驗犬血漿TNF-α、IL-6、IL-8濃度在T2~T4各時點與體外循環前比較均明顯增加(P<0.01),進一步證實了體外循環可引起致炎性細胞因子的釋放,全身炎癥反應伴隨體外循環而存在。TNF-α是體外循環相關性炎癥反應的主要致炎因子,在炎癥瀑布級聯反應中起核心作用,是CPB后炎癥反應過程中釋放最早同時也是最重要的內源性介質之一,既可損傷血管內皮細胞,促進內皮細胞粘附分子的表達,又可促進白細胞介素的合成,激活血小板,誘導產生多種活性物質,增強炎癥反應,導致組織器官損傷[7]。IL-6是細胞因子釋放第二高潮中的主要因子,也是急性期反應蛋白合成和炎性細胞積聚的主要因素,它能整合早期炎癥反應信號,促進炎性因子的進一步釋放,其水平升高與CPB后心功能不全有關,是反映組織損傷的早期和敏感指標[7]。IL-8由活化的內皮細胞、單核細胞及T淋巴組胞產生,是最強的多形核白細胞和T淋巴細胞激活和趨化因子,它的血漿水平被認為是嚴重組織損傷的標志。本研究發現CPB開始后各組IL-8水平均明顯增高,提示IL-8共同參與了CPB炎癥反應。
自體肺體外循環方法有以下優點:(1)維持肺動脈灌注,肺動脈有持續血供,避免肺臟缺血再灌注損傷,繼承了體外循環期間維持肺動脈灌注的優良肺保護效果;(2)自體肺擁有良好的組織相容性,最大限度地降低體外循環相關性炎癥反應的程度,有效地減輕了全身炎癥反應引起的肺損傷;(3)氧合器的成本接近零,可直接降低患者手術費用。
本研究顯示 IL-10與 TNF-α、IL-6、IL-8同步升高,說明機體的炎癥反應中既有促炎細胞因子的產生,同時又有抗炎細胞因子的產生。IL-10是抗炎細胞因子,可抑制炎癥反應和免疫反應,對全身炎癥反應導致的臟器損傷有一定的保護作用。IL-l0的釋放增加代表著限制炎癥反應的內源性反應,大量強效抗炎因子的產生反映了人體自身也盡可能地限制過激的炎癥反應[8]。維持促炎細胞因子和抗炎細胞因子之間的平衡對減輕炎癥反應、降低術后并發癥有十分重要的意義。
本研究結果顯示:T2~T4時點實驗組血漿TNF-α、IL-6、IL-8濃度明顯低于對照組(P<0.01),IL-10濃度明顯高于對照組(P<0.05)。表明自體肺體外循環不僅可以有效抑制CPB期間促炎細胞因子TNF-α、IL-6和IL-8的釋放,還促進抗炎細胞因子IL-10的釋放,從而有效減輕體外循環相關性炎癥反應,減輕體外循環相關炎癥反應引起的重要器官損傷。其原因有二方面:(1)自體肺體外循環不使用人工肺,無表面接觸激活血液中有關成分的根本缺點;(2)心臟缺血期間,肺臟的血供或氧供未減少,從而預防了肺臟再灌注后的病理生理學改變。
1 Oliver JW,Amy LW,Katie LWetal.Theinflammatory response to cardiopulmonary bypass:part2—anti-inflammatory therapeutic strategies[J].JCardiothoracic Vascular Anesthesia,2009;23(3):384-393.
2 Sahin S,Fevzi T,Serdar Getal.The impactofallogenic red cell transfusion and coated bypass circuit on the inflammatory response during cardiopulmonary bypass:a randomized study[J].Interactive Cardio Vascular Thoracic Surgery,2009;8(1):93-99.
3 UmeadiC,Kandeel F,Al-Abdullah IH.Ulinastatin isanovelprotease inhibitor and neutral protease activator[J].Transplant Proceed,2008;40(5):387-389.
4 Banz Y,Rieben R,Zobrist Cetal.Addition of dextran sulfate to blood cardioplegia attenuates reperfusion injury in a porcinemodelof cardiopulmonary bypass[J].Eur Cardio-Thoracic Surg,2008;34(9):653-660.
5 Yang YM,Cai JM,Wang SMetal.Better protection of pulmonary surfactant integrity with deep hypotherm ia and circulatory arrest[J].Ann Thorac Surg,2006;82(06):131-137.
6 Liakopoulos O J,Schm itto JD,Kazmaier Setal.Cardiopulmonary and system ic effects of methylprednisolone in patients undergoing cardiac surgery[J].Ann Thorac Surg,2007;84(7):110-119.
7 Stoney W S.Evolution of cardiopulmonary bypass[J].Circulation,2009;119(6):2844-2853.
8 Evans B J,Haskard DO,Finch JRetal.The inflammatory effectof cardiopulmonary bypass on leukocyte extravasation in vivo[J].JThorac Cardiovasc Surg,2008;135(05):999-1006.
[收稿2009-09-24 修回2009-12-23]
(編輯 張曉舟)
The empirical study for the effect of extracorporeal circulation with autologous lung and conventional extracorporeal circulation as oxygenator on cytokine levels
LINBai-Song,ZHANGXiu-He,ZHANGBai-Min,JIANGYi-Zhong,LIZhe.DepartmentofCardiovascularSurgery,China-JapanUnionHospital,JilinUniversity,Changchun130033,China
Objective:To determine the protective effectof cardio-pu lmonary bypass(CPB)with autologous lungas oxygenatoron CPB-relative inflammatory response.Methods:Twelveadultmongrel dogswere randomly divided into controlgroup and study group.Cardiopulmonary bypass(CPB)using amembrane oxygenator(controlgroup)or using the autologous lung(study group)for gas exchangewas performed for 120min in an alternating series of 12mongrel dogswith the heart arrested for 90min by crystalloid cardioplegia and 30min reperfusion.The blood sampleswere collected at the same time pointof pre-operation(T1),60min of cardiopulmonary bypass(T2),and 1 hour(T3),2 hours(T4)after cardiopulmonary bypass.Plasma concentration of IL-6,IL-10,TNF-αwere detected with ELISA.Results:The plasma levels of IL-6,IL-8,IL-10,TNF-αin eachgroupwere significantly increased atT2,T3,T4.The plasma levels of IL-6,IL-8 and TNF-αin study groupwere significantly lower than in the control group at T2,T3,T4.The plasma levels of IL-10 in study group were significantly higher than the levels in control group at T2,T3,T4.Conclusion:Thisstudy indicates thatextracorporeal circu lationwith autologous lung asoxygenator cou ld reduce the increased amplitude of plasma levels of TNF-α,IL-6 and IL-8whereas enhance the increased amp litude of the p lasma IL-10 levels that result from CPB.Inotherword,extracorporeal circulationwith autologous lung asoxygenator possessestheeffect to regulate inflammatory cytokine balance and down-regulate CPB-relative inflammatory response.
Autologous lung;Inflammatory response;Cytokine;Cardiopulmonary bypass
R332 R654.1
A
1000-484X(2010)03-0278-03
①本文為吉林省科技廳科技發展計劃基金資助課題(20080742)
林柏松(1969年-),男,醫學博士,副教授,副主任醫師,碩士生導師,主要從事心肌保護和肺保護方面的研究。