溶血性鏈球菌LAMP檢測方法的建立
尹 歡,李 琦,陳江源,馬寅眾,李 睿,劉志國*
(武漢工業學院生物與制藥工程學院,湖北 武漢 430023)
溶血性鏈球菌LAMP檢測方法的建立
尹 歡,李 琦,陳江源,馬寅眾,李 睿,劉志國*
(武漢工業學院生物與制藥工程學院,湖北 武漢 430023)
目的:研究溶血性鏈球菌的環介導等溫擴增(loop-mediated isothermal amplification,LAMP)檢測方法,實現對溶血性鏈球菌的快速檢測。方法:針對溶血性鏈球菌的scpA基因設計4條特異性LAMP內外引物進行LAMP擴增;優化擴增反應條件;采用包括溶血性鏈球菌在內的6種不同菌株進行LAMP的特異性檢測,并酶切鑒定;對溶血性鏈球菌菌液以無菌水進行10倍系列梯度稀釋后,進行LAMP擴增檢測其靈敏度;將菌摻入牛奶樣本并進行LAMP檢測。結果:本法可快速靈敏地檢測出溶血性鏈球菌,反應特異性高,檢出限為16.7CFU/mL,而牛奶樣本的檢出限則達10CFU/mL。結論:LAMP法可用于食品溶血性鏈球菌的快速檢測。
溶血性鏈球菌;環介導等溫擴增(LAMP);檢測;檢出限
溶血性鏈球菌(Streptococcus hemolyticus)是一種常見的病原微生物,可引起食物中毒與臨床感染,感染人體可導致新生兒敗血癥、腦膜炎、肺炎等多種嚴重感染性疾病,甚至死亡[1-3]。根據溶血性鏈球菌族特異性抗原的不同,可將其分為18個族,其中A、B、C、D、F、G族對人類有致病能力。
傳統的溶血性鏈球菌分離鑒定法通常需要24~48h才能報告結果,且影響因素多,不適合體檢及大規模的診斷、篩查。隨著分子生物學的發展,現在已建立了以PCR為基礎的多項檢測技術如免疫PCR、實時定量PCR、多重PCR,及以抗原檢測為主的免疫學檢測法[4-8]。這些檢測方法快捷、靈敏,準確度較高。但是,這些針對單一族溶血性鏈球菌的現代檢測方法均需一定的設備和技術要求,且試劑費用較貴,難以推廣普及。因此,建立溶血性鏈球菌特別是致病性菌株的準確快速檢測對于控制該類細菌引起的食物中毒具有重要意義。
研究表明,溶血性鏈球菌感染人類宿主與scp基因編碼的C5a-肽酶有關[9-10],這一基因在不同的致病性溶血性鏈球菌中有很高的一致性,但不存在于其他菌株中。因此針對溶血性鏈球菌scp基因建立快速檢測方法具有重要價值。近年來,環介導恒溫擴增(loop-mediated isothermal amplification,LAMP)方法在微生物檢測中的作用受到關注。該方法由Notomi[11]等于2000年提出,它利用鏈置換DNA聚合酶在恒溫條件下自循環幾十分鐘,完成核酸擴增反應。LAMP法具有高特異性、高靈敏性、簡便、快速、低成本的特點,已在諸多
領域廣泛應用[12-13]。本實驗旨在建立溶血性鏈球菌的特異LAMP法,以便實現食品中溶血性鏈球菌的快速檢測。
1 材料與方法
1.1 材料與試劑
溶血性鏈球菌(Streptococcus hemolyticus CICC 10373)、福氏志賀氏菌(Shigella flexneri)、腸炎沙門氏菌(Salmonella enteritidis) 中國工業微生物菌種保藏中心;金黃色葡萄球菌(Staphylococcus aureus)、大腸桿菌(E.coli DH5α)、枯草芽孢桿菌(Bacillus subtilis)為本實驗室保藏菌株。
Bst DNA聚合酶 紐英倫生物技術有限公司;dNTP美國Promega公司;凍干脫纖維羊血 友康基業生物科技有限公司。
1.2 儀器與設備
電熱恒溫水浴箱 武漢市琴臺醫療器械廠;YJ-1450超凈工作臺 江蘇蘇州凈化設備公司;UNO Ⅱ聚合酶鏈式反應儀 德國Whatman Biometra公司;核酸電泳儀 北京六一廠;UV-2000 GIS紫外分析儀 日本Hitachi公司。
1.3 方法
1.3.1 DNA模板的制備
煮沸法[14-15]制備靶DNA:挑取溶血性鏈球菌單菌落溶于100μL 無菌水混勻后,于100℃水浴10min裂解,冰浴2min,然后4℃、12000r/min離心5min,含DNA模板的上清液備用。
1.3.2 引物設計與合成
根據Genbank公布的溶血性鏈球菌 scpA 基因序列,設計LAMP特異引物,包括兩條外引物F3、B3和兩條內引物FIP、BIP。引物由上海生工生物工程技術服務有限公司合成。引物序列見表1。

表1 擴增scpA基因的LAMP引物序列Table1 Design of LAMP primers for amplifying the scp A of Streptococcus hemolyticus
1.3.3 LAMP反應體系及條件優化
LAMP反應體系為25μL,包括內引物、外引物、Bst DNA聚合酶、dNTPs、1×ThermoPol buffer以及適量的DNA模板;LAMP產物進行1%瓊脂糖凝膠電泳分析。
選擇不同濃度比例的內外引物,改變反應時間和溫度進行LAMP反應,電泳觀察擴增效果,確定最佳反應條件。
1.3.4 LAMP特異性檢測
分別對包括溶血性鏈球菌在內的6種不同菌株進行LAMP擴增,檢測LAMP引物的特異性。由于擴增目標片段含有限制性內切酶Ta qⅠ的酶切位點,將模板DNA與酶混合,37℃酶切過夜,然后進行LAMP反應,驗證序列的特異性擴增。
1.3.5 LAMP靈敏度檢測
將培養2d的溶血性鏈球菌挑取單菌落,溶于1mL液體血培養基中,混勻后,以無菌水10倍梯度逐步稀釋菌液,分別取各稀釋菌液100μL進行平板計數,并煮沸制備DNA,取1μL含模板DNA的上清液進行LAMP擴增。
1.3.6 牛奶樣本中摻入的溶血性鏈球菌后的LAMP檢測
以濾過除菌的市售牛奶作為溶血性鏈球菌的稀釋液,10倍梯度逐步稀釋菌液,并取樣進行菌落培養計數,制備DNA模板,進行LAMP擴增。
2 結果與分析
2.1 LAMP方法的建立與反應條件優化
LAMP特異引物使溶血性鏈球菌基因組DNA擴增出陽性梯狀條帶,而無模板的無菌水的陰性對照沒有條帶出現。優化條件結果顯示:在其他反應條件不變且內引物與外引物的濃度比為3:1時擴增效果佳(圖1A);當反應進行到50min時即出現梯狀條帶,60min反應最佳,此時擴增穩定(圖1B);當反應溫度達55℃有階梯狀條帶,60℃為最佳擴增(圖1C)。
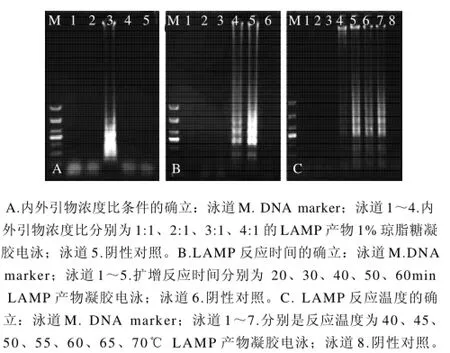
圖1 LAMP反應條件優化結果Fig.1 Optimal reaction conditions for LAMP method
2.2 LAMP的特異性
如圖2所示,僅溶血性鏈球菌出現陽性的梯狀條
帶,其他5株非溶血性鏈球菌均未呈陰性(圖2A);溶血性鏈球菌DNA模板被TaqⅠ酶切后,無LAMP擴增(圖2B),表明LAMP引物只針對溶血性鏈球菌特異基因序列。
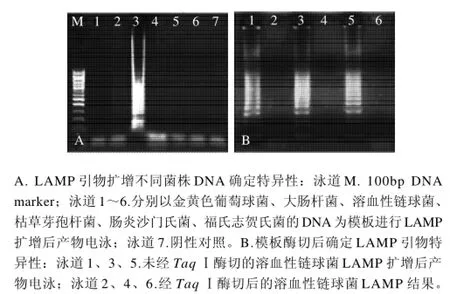
圖2 LAMP的特異性檢測結果Fig.2 Specificity of LAMP for the detection of Streptococcus hemolyticus
2.3 LAMP的靈敏度
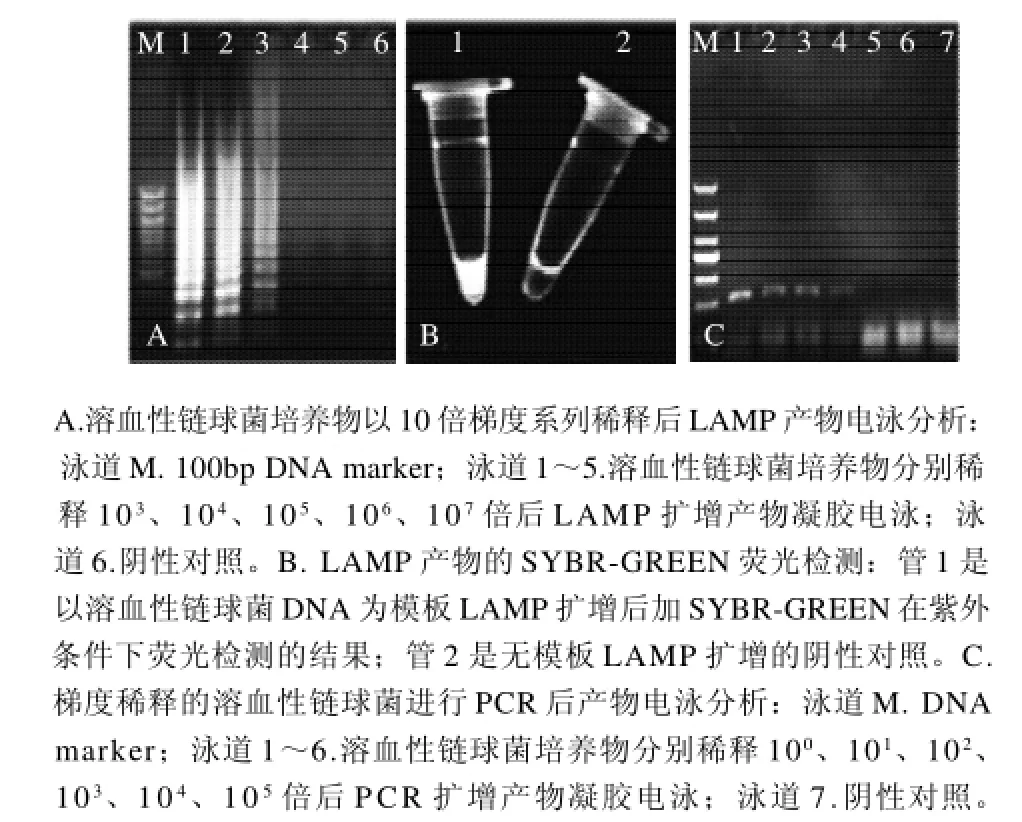
圖3 LAMP的靈敏度檢測結果Fig.3 Sensitivity of LAMP for the detection of Streptococcus hemolyticus
以無菌水將溶血性鏈球菌系列稀釋后,分別取樣LAMP 檢測(圖3A),并通過平板培養菌落計數,結果檢出限為16.7CFU/mL。擴增產物中加入0.1μL SYBRGREEN 在紫外光條件下可見熒光(圖3B)。將各稀釋的溶血性鏈球菌進行PCR檢測,結果顯示PCR法的檢出限為1.21×103CFU/mL(圖3C)。可見針對溶血性鏈球菌scpA基因擴增的LAMP法比PCR法更靈敏。
2.4 LAMP法檢測牛奶中的溶血性鏈球菌
牛奶樣本中摻入溶血性鏈球菌并進行系列梯度稀釋后進行LAMP反應,并平板計數,結果牛奶中溶血性鏈球菌的LAMP檢出限為1.0×101CFU/mL(圖4)。市售牛奶樣本未檢出溶血性鏈球菌。
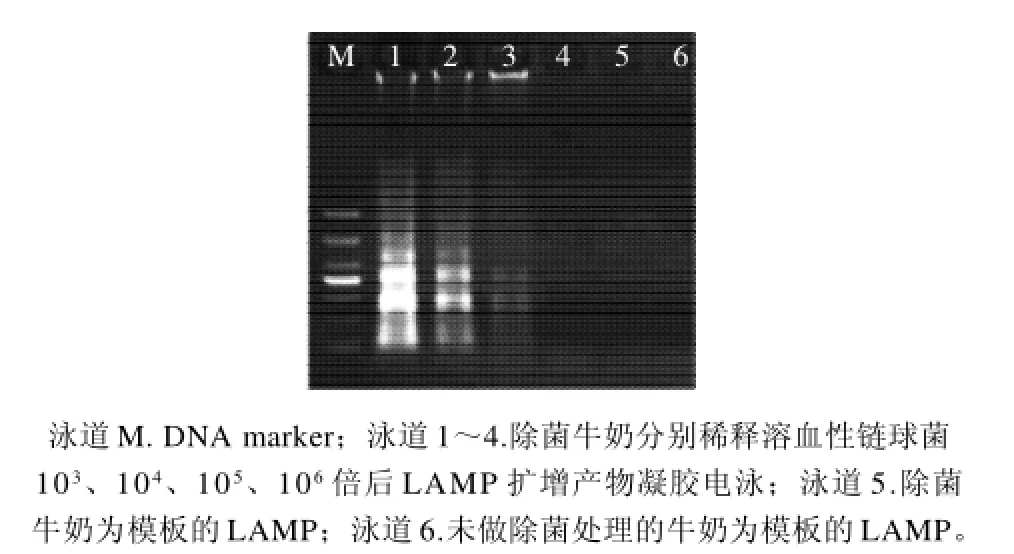
圖4 牛奶樣本的溶血性鏈球菌LAMP檢測Fig.4 LAMP detection of Streptococcus hemolyticus in milk samples
3 討 論
采用溶血性鏈球菌的scpA基因序列中的一段特異序列作為LAMP擴增的靶序列,針對6個不同區域,設計內外兩對引物,保證了LAMP反應的特異性擴增,并成功檢測出溶血性鏈球菌菌株,而其他菌的基因不能擴增出來,表明該引物針對溶血性鏈球菌的scpA基因特異序列有很高的特異性。
鑒于溶血性鏈球菌菌群中對食品危害最大的是帶有C5a-肽酶的致病菌株,因此檢出該類致病菌十分重要,針對溶血性鏈球菌scpA基因設計特異性LAMP擴增引物,進行等溫擴增,能有效地檢出致病性溶血性鏈球菌。LAMP檢測方法的靈敏度非常高[16-17]。本實驗中針對這一特異性基因設計的LAMP引物可檢出1.67× 101CFU/mL(相當于每個反應管最低檢測限為1.67CFU),而PCR法的檢出限為1.21×103CFU/mL,實驗表明LAMP法檢測溶血性鏈球菌的靈敏度更高。LAMP法產物的檢測多樣化[18-19],可通過肉眼觀察、添加熒光染料、瓊脂糖凝膠電泳檢測反應是否發生。
在市售牛奶樣本中未檢測到溶血性鏈球菌污染,通過將溶血性鏈球菌摻入到牛奶中檢測,LAMP法檢出限為10CFU/mL。可能牛奶比無菌水更適宜于菌的生長,提菌DNA前菌有少量增長,更易檢出。
綜上所述,本實驗建立的溶血性鏈球菌LAMP檢測方法具有特異性強、靈敏度高,方便快捷、成本低等優點,為溶血性鏈球菌的檢測提供了新的方法,可廣泛用于食品中致病性溶血性鏈球菌的快速檢測。
[1]陳木林. 快速檢測咽拭子中A群β溶血性鏈球菌結果的分析[J]. 現
代保健: 醫學創新研究, 2007, 35(4): 7.
[2]梁云梅, 楊永弘. A族β溶血性鏈球菌與猩紅熱的相關研究[J]. 微生物學雜志, 2009, 29(4): 89-92.
[3]張一舉. A組β型溶血性鏈球菌性咽炎的研究進展[J]. 新醫學, 2006, 37(12): 830-831.
[4]GRARUP C, GLEESEN A S, DARGIS R, et al. Infections with betahaemolytic streptococci: detection by a universal PCR for bacterial DNA and DNA sequencing[J]. Scand J Infect Dis, 2008, 40(6/7): 547-550.
[5]LIANG H, CORDOVA S E, KIEFT T L, et al. A highly sensitive immuno-PCR assay for detecting Group A Streptococcus[J]. J Immunol Methods, 2003, 279(1/2): 101-110.
[6]LEE J H, UHL J R, COCKERILL F R, et al. Real-time PCR vs standard culture detection of group A beta-hemolytic streptococci at various anatomic sites in tonsillectomy patients[J]. Arch Otolaryngol Head Neck Surg, 2008, 134(11): 1177-1181.
[7]FUKUSHIMA K Y, YANAGIHARA K, HIRAKATA Y, et al. Rapid identification of penicillin and macrolide resistance genes and simultaneous quantification of Streptococcus pneumoniae in purulent sputum samples by use of a novel real-time multiplex PCR assay[J]. J Clin Microbiol, 2008, 46(7): 2384-2388.
[8]LEUNG A K, NEWMAN R, KUMAR A, et al. Rapid antigen detection testing in diagnosing group A beta-hemolytic streptococcal pharyngitis [J]. Expert Rev Mol Diagn, 2006, 6(5): 761-766.
[9]FRANKEN C, HAASE G, BRANDT C, et al. Horizontal gene transfer and host speci city of beta-haemolytic streptococci: the role of a putative composite transposon containing scpB and lmb[J]. Molecular Microbiology, 2001, 41(4): 925-935.
[10]DMITRIEV A, SUVOROV A, SHEN A, et al. Clinical diagnosis of group B streptococci by scpB gene based PCR[J]. Indian J Med Res, 2004, 119(Suppl): 233-236.
[11]NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28 (12): 63-69.
[12]李志強. LAMP 技術在微生物檢測中的應用[J]. 生命科學儀器, 2009 (7): 7-10.
[13]曾冰冰, 肖凱軍, 石磊, 等. LAMP方法在食品微生物檢測中的應用[J]. 現代食品與藥品雜志, 2007, 17(1): 22-25.
[14]DRAGO L, LOMBARDI A, VECCHI E D, et al. Real-time PCR assay for rapid detection of Bacillus anthracis spores in clinical samples[J]. Clinical Microbiology, 2002, 40(11): 4399.
[15]MAKINO S, CHEUN H. Application of the real-time PCR for the detection of airborne microbial pathogens in reference to the anthrax spores[J]. Microbiological Methods, 2003, 53(12): 141-147.
[16]QIAO Yanmei, GUO Yongchao, ZHANG Xianen, et al. Loop-mediated isothermal amplification for rapid detection of Bacillus anthracis spores [J]. Biotechnol Lett, 2007, 29(12): 1939-1946.
[17]KUROSAKI Y, SAKUMA T, FUKUMA A, et al. A simple and sensitive method for detection of Bacillus anthracis by loop-mediated isothermal amplification[J]. J Appl Microbiol, 2009, 107(6): 1947-1956.
[18]RIGANO L A, MARANO M R, CASTAGNARO A P, et al. Rapid and sensitive detection of Citrus Bacterial Canker by loop-mediated isothermal amplification combined with simple visual evaluation methods[J]. BMC Microbiol, 2010, 10(1): 176-183.
[19]ZHANG Xingjuan, SUN Yuan, LIU Lihong, et al. Validation of a loopmediated isothermal amplification assay for visualised detection of wildtype classical swine fever virus[J]. J Virol Methods, 2010, 167(1): 74-78.
Establishment of Loop-mediated Isothermal Amplification for the Detection of Streptococcus hemolyticus
YIN Huan,LI Qi,CHEN Jiang-yuan,MA Yin-zhong,LI Rui,LIU Zhi-guo*
(College of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Objective: To develop a loop-mediated isothermal amplification (LAMP) method for the rapid detection of Streptococcus hemolyticus. Methods: According to the scpA gene of Streptococcus hemolyticus, 4 specific primers were designed for LAMP amplification. Six different Streptococcus hemolyticus strains were validated by LAMP and identified by enzymatic digestion. The sensitivity of LAMP method was evaluated by serial gradient dilution of Streptococcus hemolyticus solution. Results: LAMP could be used for the rapid and sensitive detection of Streptococcus hemolyticus with a high sensitivity and a detection limit of 16.7 CFU/mL. Moreover, the detection limit was 10 CFU/mL in milk samples. Conclusion: LAMP method is a simple, rapid and feasible method for the detection of Streptococcus hemolyticus.
Streptococcus hemolyticus;loop-mediated isothermal amplification;detection;detection limit
Q93.3
A
1002-6630(2010)22-0311-04
2010-06-27
武漢市科技局對外科技合作與交流計劃項目(201070934341);武漢工業學院研究生創新基金重點項目(09cx002)
尹歡(1987—),女,碩士研究生,主要從事食品微生與食品安全研究。E-mail:huanyin1011@126.com
*通信作者:劉志國(1963—),男,教授,博士,主要從事生物技術與食品安全研究。E-mail:zhiguo_1@126.com

