TACE聯合緩釋化療粒子(5-Fu)治療原發性肝癌的臨床研究
郭青 董方曉 欒翠美 顏玉茂
目前肝癌治療仍以手術治療為首選方案,但中晚期肝癌的治療近年來未有突破,大多數病人就診時已失去手術時機,非手術治療已成為肝癌治療的重要手段。國內外學者一直在探索較好的姑息治療方法,以期提高病人的生存期和生活質量,目前常用治療方法有TACE、射頻、微波、化療等方式,但療效仍不滿意,而且治療費用高。本研究采用緩釋化療粒子植入治療原發性肝癌取得較好的療效。
1.1 一般資料:
2004年12月~2009年11月,192例中晚期肝癌患者,其中男性137例,女性55例,平均年齡48歲(29~68歲),所有病例均經二種影像學或血管造影、穿刺活檢證實。
1.2 治療方法∶
1.2.1 A組:TACE采用seldinger技術經皮股動脈穿刺插管行腹腔動脈、腸系膜上動脈造影,明確腫瘤大小、數目、部位以及供血動脈,超選進入腫瘤動脈,注射混懸碘油(超液化碘油10-20m l+表柔比星40-50m g+羥基喜樹堿10-20m g+5-FU 1000mg+明膠海綿)。一個月后復查CT,增強掃描若有殘留再行2次TACE。TACE排除標準:肝功能明顯異常,經保肝治療后改善不明顯者,腎功能異常,血清肌酐值>正常上限值1.25倍,合并重要器官功能障礙,不能耐受動脈灌注抗癌藥物給藥者。
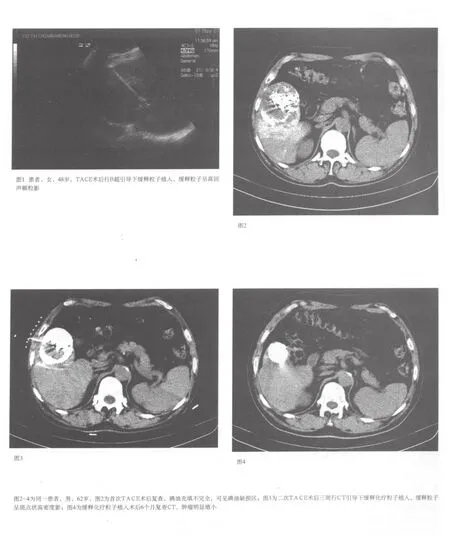
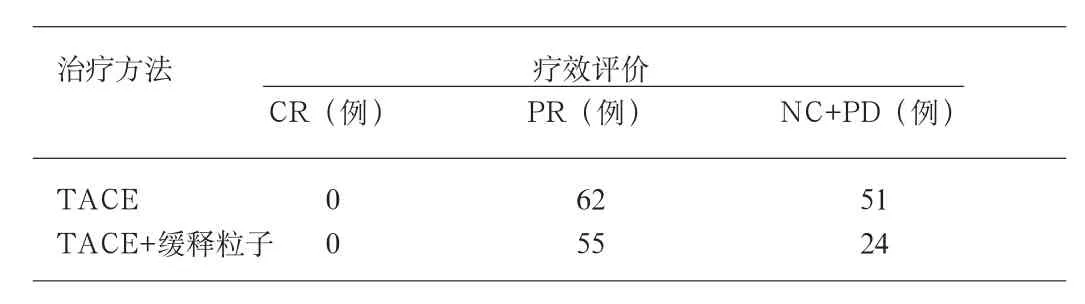
1.2.2 B組:TA CE+緩釋粒子植入(管劑緩釋化療粒子5-FU系安徽蕪湖制藥廠提供),TACE治療二次后的第3周在CT、B超或DSA下,行經皮穿刺粒子植入,以CT引導較為準確(可單針或多針),在皮膚做好標記,以0.5%利多卡因局麻穿刺道,避開肺組織、胃腸道、膽囊、腸管,C T掃描在位,根據碘油缺損區的體積大小,按0.5cm/粒計算需放多少。在確定18G穿刺針刺入病灶后,抽出針芯,將中人氟安金屬管接于穿刺針尾并用手連同穿刺針一同固定,另一手持探針自藥物金屬管另一端伸入將管內藥物推頂入穿刺針,也可先用探針接金屬管后端,再接穿刺植入針尾端,根據個人習慣選擇,總之應盡量避免化療粒子脫落。繼續推頂至藥物粒子達病灶時可感到明顯的阻力,此時固定好穿刺針,稍用力將藥物粒子推頂入靶組織內。如阻力較大時可邊退針邊植入。更換針道做另一處植入,直至藥物在病灶內均勻分布。觀察藥物分布:我們使用的緩釋化療粒子植入體內后,CT掃描呈略高密度,B超顯示高回聲顆粒影,可借此觀察藥物的分布情況,確定是否需要補充植入。
1.3 結果:
1.3.1 全部病例手術均順利完成,無局部感染、大出血等并發癥,根據增強CT結果判斷療效。
表一 A、B組療效評價對比

表二 A、B組1、2、3年生存率對比

表三 A、B組療效對比
x2=3.841,本例x2=4.25>3.841,P<0.05 差異有顯著性。實體瘤療效評價標準:①完全緩解(CR),腫瘤完全消失,影像學檢查不能顯示,栓塞周圍有腫瘤低密度影。②部分緩解(PR)腫瘤影像縮小。③無變化(NC),碘油栓塞灶影像無明顯變化。④進展(PD)碘油栓塞灶外發現新病灶。
討論:TACE治療肝癌的原理主要是基于肝癌主要由肝動脈(占90%以上)供血,而正常肝組織血供僅25%來自肝動脈。TACE能有效地減少腫瘤血供,使腫瘤血管變細、減少,甚至完全消失[1]。碘油乳劑作為腫瘤血管末梢栓塞劑經肝動脈注入后,主要沉積于腫瘤血管、肝竇和附近肝組織內,腫瘤內碘油的清除較其鄰近肝組織慢,能有效地減少腫瘤的血供。碘油能較長時間滯留在腫瘤局部,使腫瘤缺血、缺氧而發生凝固壞死,并且在腫瘤內碘油沉積越多,腫瘤壞死的程度越高,在無碘油沉積區或少碘油沉積區,腫瘤殘留的活性成分較多,易于復發[2-3]。由于肝臟潛在的供血側枝多,以及來自門靜脈的血供及肝內存在的動靜脈分流,使肝癌治療效果不理想,其原因可能為①雙重血供②側枝循環及變異血管供血導致腫瘤血管栓塞不全③藥物濃度滯留時間不夠長[4]。大量研究提示,雖然TACE能夠取得較好的療效,但肝癌3年、5年生存率仍然不高,可見遠期療效并不理想。
在多次TA CE后,可使幾乎全部肉眼可見的腫瘤血管閉塞,但它又有能使殘癌組織中血管內皮生長因子等促腫瘤血管生成因子表達上調[5],在短期內可再建立側枝循環,因此多采用聯合療法進行綜合治療。近年來利用緩釋劑型建立起來的全新給藥技術,瘤內殘瘤腔局部植入應用于臨床,5-Fu緩釋劑取得較好的效果。這種新型藥物釋放系統的優越性在于它包括速釋和緩釋兩部分,植入瘤組織后表面速釋層迅速釋放抗癌藥,于短時間內使藥物作用于整個瘤體,并達到有效抑制腫瘤的濃度。此后通過余下的緩釋部分持續釋放可形成長時間的有效濃度,克服了某些緩釋劑釋放藥物過于遲緩難以達到有效抑瘤濃度的情況,預防癌細胞因長期接觸低濃度藥物而產生多藥耐藥的現象。值得注意的是植入式緩釋劑能達到有效的抑瘤范圍在0.5-5cm,對于肝內多個癌腫或巨大腫瘤需多點植入[6]。
化療粒子植入肝內,體液逐層滲入藥粒微囊,溶解膜內藥物,在膜內形成高濃度,藥物在濃度梯度的作用下向膜外逐漸擴散(滲透-擴散機制)。將化療藥物植入病灶及臨床病灶內,在血運豐富的瘤灶周圍形成一個藥物濃度的區域,從而控制病變向外圍擴展[7]。一般認為對腫瘤的化療效力,在一定程度上取決于局部的藥物濃度和作用時間的乘積,腫瘤部位一次植入產生的效果約為靜滴的20-500倍,有利于細胞內藥物的積聚以增加細胞毒性作用,且作用時間長達15天以上,持續長時間的殺滅腫瘤細胞。
我們采用先行TACE(超液化碘油10-20m l+表柔比星40-50m g+羥基喜樹堿10-20m g+5-FU 1000m g+明膠海綿)治療,要求盡可能地超選所有的腫瘤供血動脈,進行栓塞和充填腫瘤周圍小的血管分支,而后在二次TA CE后三周左右行緩釋粒子植入術(此時再行TACE進行灌注碘油充填效果往往不夠理想,緩釋化療粒子作為補充方式,使瘤內藥物的濃度和存在時間達到足夠)。
兩種方式的結合,解決了TACE藥物存留時間短,封堵血供不完全,瘤內注射常規化療藥物吸收快,藥物存留時間短的問題。提高了腫瘤內的藥物濃度和作用時間,降低了化療藥物的毒副作用,從而提高療效,降低經濟費用。
TACE聯合緩釋化療粒子(5-Fu)植入腫瘤體內及腫瘤周圍的門靜脈系統內,具有操作簡單、風險小的優點,將成為臨床治療中晚期肝癌的新方法之一。我們在臨床工作中初步運用該種方法對中晚期肝癌病人進行治療,取得了較滿意的治療效果。綜合國內其他文獻的報道,此項技術簡便易行,操作性極強,有望改善肝癌的預后,是值得開拓的有效方法。
[1]Choi B I,Kim HC,Han JK,et al.Therapeutic effect of transcatheter oilychemoembolizatiion therpy for em capsulated nodular hepatocellular carcinoma:CT and pathlologic findings [J].Radiology,1992m182(3):709-713.
[2]Staunton M,Dodd JD,Mocorm ick PA,et al,Finding evidencebased answ ers to practical question in radiology:w hich patients with inoperable hapatocellular carcinoma w ill survive longer aftertransarterial chemoembolizatiion Radiology,2005,237:404-413.
[3]Okuda K,Ohtsuki T,Obata H,et al.Natural ,history of hepatocellular carcinoma and prognosis in relation to treatment:study of 850 patients.Cancer,1985,56:918-928.
[4]Okadas.Transcatheter arterial embolization for advanced hepatocellular carcinoma:The controversy continues.Hepatology ,1998,27:1743-1744。
[5]李欣,馮敢生,鄭傳勝,等。肝動脈化療栓塞對腫瘤血管生成影響的試驗研究[J];中華放射學雜志;2002,36(8):689-693.
[6]周劍寅,葉社房綜述,控緩釋制劑治療肝癌的新進展;國外醫學腫瘤學下冊,2005.12:12.
[7]李振家,武樂斌主編,CT導向下惡性腫瘤放射性粒子組織間植入治療學[M];山東大學出版社,2007:225.

