衛生技術評估:澳大利亞的反映
本文分為三部分。第一部分主要是描述性的,列出了在澳大利亞應用衛生技術評估(HTA)的主要機構。首先,討論了醫療用品管理局(Therapeutic Goods Administration,TGA)對HTA的應用。TGA是澳大利亞負責對醫療用品的可用性和上市銷售進行管理的主要機構。隨后介紹了澳大利亞衛生保健系統的構成,為后面介紹HTA在澳大利亞報銷機構中的應用奠定可理解的基礎。在澳大利亞,發展最完善、具有最正規HTA(包括經濟性評價)體系的機構是醫療服務咨詢委員會(Medical Services Advisory Committee,MSAC)和藥品福利咨詢委員會(Pharmaceutical Benefits Advisory Committee,PBAC)。因此將對為這些委員會的補償決策提供信息支持的評估進行詳細描述。
第二部分對澳大利亞目前進行與應用HTA中存在的問題進行討論,并提出了筆者的個人觀點。
第三部分可供參考,該部分討論了在澳大利亞進行與應用HTA中目前存在的問題。,提出了筆者個人認為的澳大利亞HTA的經驗教訓。
一、HTA及其在澳大利亞衛生保健決策中的應用
(一)澳大利亞管理機構對HTA的應用
《1989年醫療用品法》(The Therapeutic Goods Act 1989)于1991年2月15日生效,該法案的目的是為澳大利亞醫療用品的管理提供一個全國性的框架,以保證藥品的質量、安全和有效性,以及醫療器械的質量、安全和性能。《1989年醫療用品法》中的規定和指令陳述了將醫療用品,包括廣告、標簽、產品特性和申請指南進行澳大利亞醫療用品注冊(Australian Register of Therapeutic Goods,ARTG)登記的要求。TGA隸屬于澳大利亞政府的健康與老齡化部(The Australian Government’s Department of Health and Ageing),主要負責對立法條款進行管理。一些與藥品相關的規定,如藥物計劃、醫療用品的安全儲存,均包括在相關的國家或地方性立法中。
TGA通過開展一系列的評估與監管工作,保證了澳大利亞境內現有的醫療用品符合可接受的標準。TGA在針對藥品與針對醫療器械開展的評估與監管中,采用的方法稍有不同。獲得ARTG的產品主要有兩種級別——“已注冊”(“reglstered”)產品與“列入目錄”(“listed”)產品。被TGA歸類于“已注冊”的所有產品均需經過詳細的上市前風險評估并由TGA進行評價。“已列入目錄”的產品無需進行上市前評估,因為TGA在風險評估的基礎上已經認同這些產品是低風險的。
“已注冊”藥品相關風險的識別、分析和評價包括許多步驟。詳見《Value in Health》補充信息第Ⅰ部分中的“HTA:新西蘭和澳大利亞的反映”,(http://www.ispor.org/publications/value/ViHsupplementary/ViH12s2_6 )
(二)澳大利亞衛生保健系統的構成
澳大利亞衛生保健系統由公共與私人衛生服務提供者共同構成,并通過一系列途徑獲得資金支持。圖1描述了不同類型衛生服務的資金來源[1]。
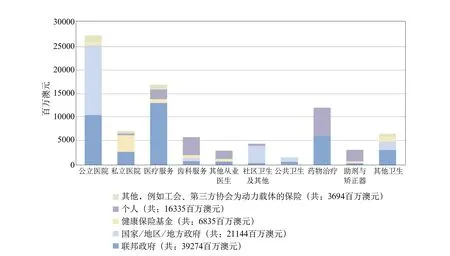
圖1 不同類型衛生服務的資金來源(2006~2007年)(單位:百萬澳元)
個人可通過納稅和一種基于個人收入的附加稅(Medicare稅),以及通過個人籌資(直接或通過購買個人健康保險)向衛生保健系統提供資助。
澳大利亞總衛生支出中大約70%來自政府的資助,聯邦政府負責其中的2/3,州、地區和地方政府負責另外的1/3[2]。聯邦政府的出資主要體現在兩個國家級補貼計劃:Medicare福利計劃(Medicare Benefits Schedule,MBS)和藥品福利計劃(Pharmaceutical Benefit Scheme,PBS)。這兩個計劃分別為整個澳大利亞的醫療服務(包括眼科配光檢查、心理學、病理學和X光照相服務)和處方藥提供資助。州政府連同聯邦政府一起,共同為公立醫院的服務(包括急診和門診服務)以及老年人和殘疾人的入戶護理提供資金支持。這種國家衛生保健資助系統的目標是讓所有澳大利亞人,無論其個人情況如何,均能夠以承擔得起的費用或無償地獲得衛生保健服務,同時通過付貸與融資過程中所涉及到的私人醫療保險實體機構,允許個人在不同的醫療服務間進行選擇[3]。
政府也對下述公共衛生服務提供支持:
(1)免疫服務和其他傳播疾病的控制[包括生物安全(biosecurity)];
(2)公眾健康教育活動(包括促進健康的營養和體育活動);
(3)預防傷害的活動;
(4)減少煙草、酒精和違禁藥物的使用和有害影響;
(5)環境監測和控制;
(6)疾病篩查項目,如乳腺癌和宮頸癌。
由牙醫和其他私人健康專業人員,如理療師、按摩師、自然療法醫師等提供的服務一般由患者直接支付費用(當患者已按規定為這些服務給自己投保時,私人健康保險會提供資助)。
(三)HTA在澳大利亞補償機構中的應用綜述
正如大多數國家的情況一樣,在澳大利亞,現有的衛生預算無法使所有患者均能得到可能享有的衛生保健服務。因此,補償機構有責任對衛生保健資源實行配置。衛生保健決策制定者為其資源配置決策提供明確依據的壓力逐漸變得越來越大。這就產生了使用HTA(包括經濟評價)為決策制定提供信息支持的行動,特別當決策涉及是否應對某一技術給予公共資助時,情況尤為如此。已被證實為有效且與目前實踐中所用措施相比具有成本-效果的干預措施,比那些得不到此類證據的干預措施更可能獲得資助。雖然為資源配置決策提供明確依據的壓力越來越大,但澳大利亞的補償機構仍然在不同程度地使用HTA來幫助如一項技術是否應得到公共資助這樣的決策制定。評估的范圍隨衛生保健服務類型和資金提供方的不同而不同。
HTA(包括經濟評價)應用的最有說服力例子是它在聯邦級項目中的應用。許多篩查項目、醫學干預、藥品和疫苗均可獲得澳大利亞國家級補貼,而HTA的應用在此過程中的作用是十分關鍵的。
MSAC就新的和正在形成的醫療服務與技術的安全性、有效性及成本-效果等相關證據的力度,以及應在何種情況下提供公共資金支付的問題向健康與老齡化部部長提出建議。而PBAC就何種藥物制劑(包括疫苗)應該給予資助的問題也向部長提出建議。相關法規要求PBAC對現用產品的治療效果和成本進行考慮,包括將該產品的效果和成本與替代治療措施的效果和成本進行比較[4]。由MSAC和PBAC考慮的HTA過程的條款已經發展得十分正規。這些評估將為決策者的決策制定提供信息支持,下文將對這些評估的具體要求進行討論。詳細內容參見《Value in Health》補充信息第Ⅱ部分“HTA:澳大利亞的反映”(http://www.ispor.org/publications/value/ViHsupplementary/ViH12s2_6.asp)。
雖然公立醫院中醫療技術有效性的相關決策也可依據HTA所提供的信息進行,但實際上公立醫院對這些評估的正式程序與評估的需求均較少。目前,并沒有計劃在醫院對衛生技術(包括藥物)進行集中評估。大多數醫院設有治療委員會,該委員會考慮將藥物納入醫院處方集的需求,但與MSAC和PBAC所要求的評估級別相比,委員會的評估通常是不太嚴格的。一般與藥物相比,醫院中醫療服務和技術可用性評估過程的透明度較低。這種分權的方法可能會導致衛生保健技術的可用性在同一州甚至在整個國家產生潛在的差異。近幾年來,醫院采納衛生技術的相關決策制定已出現集權化的發展趨勢。例如,維多利亞州人類服務部(Victorian Department of Human Services)已經建立維多利亞臨床實踐與技術政策咨詢委員會(Viclorian Policy Advisory Committee on Clinical Practice and Technology),對新技術和現有技術的申請以及本州公共衛生服務中的臨床實踐進行考量并做出推薦。評估過程的集中化可以減少醫院在決定一種藥物或技術是否具有可用性時進行的重復評估,并可以在整個國家中更公平地利用衛生保健資源。但對于擺脫重復評估的一些資源,應該直接進行更嚴格的評估。
在假體的相關區域,2007版私人健康保險法案(Private Health Insurane Act 2007)要求私人健康保險為一些假體支付保險費,這些可予支付的假體應是這些患者所接受的醫院治療或醫院替代治療的一部分,或是能夠對相關專業服務付費的Medicare福利項目指定的醫院治療或醫院替代治療的一部分[5]。假體包括心臟起搏器和除顫器、心血管支架、髖骨和膝蓋骨置換物及人工晶體;另外還包括人體組織,如人的心臟瓣膜、角膜、骨骼(局部和全部)和肌肉組織。假體目錄(Prostheses List)中包括假體和組織假體,由私人健康保險公司支付保險。關于目錄和假體的詳細信息參見《Value in Health》補充信息第Ⅲ部分“HTA:澳大利亞的反映”(http://www.ispor.org/publications/value/ViHsupplementary/ViH12s2_6.asp)。 假 體 裝 置委員會(Prostheses Devices Committee,PDC)是一個政府指定的委員會,負責就應將哪種假體納入假體目錄以及應該支付的保險向聯邦大臣提出建議。在提出予以納入目錄或決定支付保險的相關建議前,并沒有要求PDC對裝置或假體的成本-效果進行評估。在建立和更改目錄中假體和裝置的現有排列時,聯邦健康與老齡化部關注的焦點在于建立以相關的臨床療效為納入目錄依據的需求,其目的是為未來成本-效果評估的應用奠定基礎[6]。
關于老年人護理中所用到的衛生技術,聯邦政府在其2007~2008年預算[7]中宣布了一項行動計劃,旨在提高“輔助技術”的可用性并推廣使用,“輔助技術”是指那些能夠提高體弱老人的獨立性,并幫助他們盡可能長久、安全地呆在自己家里的裝置(例如遠程監控生命跡象的裝置,幫助人們記住其所用藥物的系統)。該計劃通過建立行業機構來幫助社區護理服務的提供者應用輔助技術,并形成了對于大量社區護理服務的購買力。在此過程中,并未出現對衛生技術進行評估的需求,選擇購買何種輔助技術也極少使用衛生技術評估的相關信息。
在健康促進方面,聯邦政府在其2003年預算[8]中宣布,為保證透明度并為決策制定提供信息支持,在針對疾病預防與健康促進的潛在投資進行評價時應該建立一個正式的優先權設定機制。健康和老齡化部在其2003/2004年度報告中稱,該機制已成功建立;然而關于該機制的進一步詳情尚不可由公開領域獲得。
(四)HTA在PBAC過程中的應用
PBAC是一個提供建議的獨立法定機構,根據1953年國家衛生法(Section 101 of the National Health Act 1953)第101款的規定,于1954年5月12日成立,它可以向衛生部部長建議哪些藥物制劑(包括疫苗)可以納入PBS(藥品福利計劃),或哪些疫苗可以納入國家免疫項目計劃(National Immunization Program Schedule,NIPS),并從計劃中得到補償。
申請將某種藥品(或疫苗)納入PBS(或NIPS)時所需提交的資料一般由掌握了進行產品有效性、安全性及成本-效果評估所需數據的產品制造商提供。但由醫療機構、健康專業人員、個人或其代表提交的資料同樣也可以接收。PBAC已經出版了綜合性指南[9]來指導提交資料的準備工作。 這些指南的最新版本是在2006年12月由PBAC發布的。了解這些指南的用意至關重要。開發這些指南旨在向利益相關者傳達PBAC做出的某種藥品能否得到公共資助的相關決定的思路。指南不應被理解為需要遵循的一系列指定規則,而應被視為影響PBAC建議一個產品進入PBS的可能途徑的反映。同時,指南也促進和反映了臨床和經濟性評價中的最優實踐。在資料提交過程中遵照指南的相關規定可以提高所提交資料間的可比性,有助于PBAC對不確定性的識別。
PBAC指南要求在申請中詳細介紹HTA,并對特殊的細節進行具體描述。PBAC指南的詳細內容參見《Value in Health》補充信息第Ⅱ部分“HTA:澳大利亞的反映”(http://www.ispor.org/publications/value/ViHsupplementary/ViH12s2_6.asp)。PBAC建議列入PBS的藥物分為以下三種類型:“不受限制的(unrestricted)”、“限制性補償的(restricted benefit)”和“需要許可的(authority required)”。而列入后兩種類型的產品則是PBAC建議用于特殊適應證和患者群的藥物,或能夠達到最佳臨床效益和成本-效果的臨床裝置(clinical setting)[10]。為了獲得這些藥物的使用,患者的醫生應確保其患者符合目錄中的特定標準。
患者需要為納入PBS的藥物支付一定的共付費用,而政府支付剩余部分。2009年,澳大利亞存在兩種共付水平,“普通的(general)”(32.90澳元)和“特許的(concessional)”(5.30澳元),后者適用于處于社會保障下或存在其他特許情況的患者。藥房配發的PBS目錄內藥品價格是患者需要支付的最高價格(然而,如果患者選擇具有品牌溢價的藥品時,他們可能要支付更高的價格;當PBS中的同一種藥物具有兩種或兩種以上品牌時,政府將以價格最低的品牌費用為基準對每種品牌予以補償)。當納入PBS的藥品價格低于患者的共付值時,患者需支付全部藥品費用,而政府則不予支付。
(五)醫療服務咨詢委員會(MSAC)對HTA的應用
在1997~1998年的聯邦預算中,政府提出一個辦法,旨在通過確保已納入Medicare福利項目的新的和現有醫療措施獲得有證據支持的安全性、臨床效果和成本-效果,來改善患者的健康產出。該辦法的重要內容之一是建立一個新機構——醫療服務咨詢委員會(MSAC),其職責是為聯邦的健康與老齡化部提供建議,建議內容包括以有力證據支持的新醫療技術和過程(procedure),以及在何種情況下應通過Medicare福利計劃(Medicare Bene ts Schedule,MBS) 對其進行。
MBS列出并提供了由Medicare資助的專業服務的相關信息。將一項技術或服務納入MBS的評估周期大約包括從申請到可能予以資助共五個階段。詳情見《Value in Health》 補充信息第Ⅳ部分“HTA:澳大利亞的反映”, (http://www.ispor.org/publications/value/ViHsupplementary/ViH12s2_6.asp)。MSAC共發布了兩套指南(一套針對醫療服務,另一套針對診斷服務)。指南是供申請者和獨立簽約人使用的。與PBAC指南相同,MSAC指南也要求詳細介紹HTA。
各種HTA(如技術的安全性、臨床效果和成本-效果評價)是由獨立簽約者(評價人員)經與一個“專家顧問組”磋商而進行的。MSAC任命了一個專門的專家顧問組,并由MSAC的成員任主席,幫助進行每項衛生技術的評估。專家組委派專家參與評估過程,同時也負責保證評價人員(簽約人)在臨床上有恰當的評價。MSAC接受的待評估申請達到一定數量時,MSAC可以根據臨床需求、費用、可能的效益,以及其他由MSAC決定的因素如進入的方法或公平性,來考慮評估的優先順序。
MSAC在評估報告的基礎上向聯邦部長提出建議。在必要的情況下,MSAC可以要求評價人員實施進一步的評估或分析,以輔助其作出決策。MSAC也可能依靠其之前的決策形成建議。建議提交至聯邦健康與老齡化部之后,MSAC即完成了其正式角色。聯邦健康與老齡化部負責將MSAC的最終報告與部內的政策建議進行整合,再提交給聯邦部長。迄今為止,所有的MSAC建議都得到了部長的認可[11]。
對于納入Medicare福利計劃(MBS)的項目,政府將支付其計劃價格的85%(如果患者是私立醫院的住院病人,則為計劃價格的75%),剩余部分由患者自行支付。因為在澳大利亞允許醫生收取超過MBS目錄中建議價格的費用,當然任何超出部分均由患者自行承擔。
除了將MBS的項目限制在針對性地用于特殊適應證、患者群或能夠得到最優臨床效益和具有成本-效果的特殊臨床裝置(clinical settings)外,政府還有另一種機制限制醫療服務,即向醫生(和其他實用型健康專業人員)配發Medicare提供者編號,從而授權醫生提供在Medicare計劃內的可得到補償的服務。Medicare提供者編號能夠一對一地對開業醫生(或健康專業人員)以及他們提供服務的場所進行識別。醫療注冊與配發Medicare處方者編號之間不存在自動鏈接。應屆大學畢業生(和海外受訓醫生)在獲得Medicare提供者編號并能夠提供可由Medicare補償的服務之前,需要滿足一定的要求。另外,MSAC還可以建議對僅由一些專科中心提供的醫療服務予以補償。
二、目前HTA進行與應用中存在的問題
在澳大利亞,HTA(包括經濟性評價)主要用于PBAC和MSAC的工作程序中,因此下文的討論主要針對HTA在這兩種環境下的應用。
澳大利亞相關人員意識到,使用一種含有規范HTA(包括經濟性評價)的工作程序為衛生技術補償決策制定提供信息的做法,既具可行性,又能夠得到有效實施。循證和成本-效果方法在衛生保健決策制定中獲得的認可與其支持者的預期相比稍顯落后,但目前已經逐漸得到了衛生部門的認可。然而,使用循證醫學對干預措施的可用性進行指導仍存在一段距離,特別在循證醫學與臨床自主性產生矛盾,或減少了衛生保健提供者的收入時尤為如此[12]。由于成本-效果評價將認可成為決策制定過程的一部分,因此使用并接受將比較的臨床療效作為決策制定基礎的觀點需要建立。即,需要建立一種依靠循證醫學指導醫療實踐的文化。這可以作為HTA工作程序賴以建立的基礎。
澳大利亞的決策制定者對于一個試驗的關注焦點在于相對治療價值(即某一衛生技術干預措施與目前實行的最優措施相比的價值),而非簡單與對照(通常是安慰劑)相比的療效。正如在PBAC和MSAC發布的指南中所討論的,在所關注疾病的治療系統中,建議的干預措施的定位應該是清晰的,而且將目前實行的治療系統改為包括干預措施在內的系統后,其增量效果是委員會首要的關注焦點。
目前,HTA在藥物評價中的應用已逐漸得到良好認可,但迄今HTA在醫療技術(尤其是假體和醫療器械)評價中應用的認可程度仍然較低。部分原因是由于缺乏可用的高質量證據,這是由于在該領域中還沒有和藥物一樣的符合證據的最高水平試驗設計史。另外,新技術在醫療服務領域的應用途徑也不同于藥品,即在沒有高質量證據證明其有效性和安全性的情況下,臨床醫生也能夠采納新技術。
(一)使用HTA進行決策制定的機構與政府之間的關系
正如第一部分所述,澳大利亞具有一個獨特的衛生保險計劃——Medicare,該計劃的理念是對醫療服務的提供應根據其獲益能力進行,而非根據對這些醫療服務的支付能力來進行。正如其他國家一樣,澳大利亞的公共衛生支出也受到預算的限制,而HTA已被證明是一個能夠為政府、政策制定者和臨床醫生提供技術相對價值信息的有用方法。然而,將HTA成功整合到一個衛生保健系統中,需要政策制定者和HTA機構這兩個獨立決策體在進行各自決策時遵守一些同樣的原則。值得一提的是,例如追求“物有所值”與追求“成本控制”是兩種截然不同的目標,雖然二者經常被混為一談。澳大利亞引入HTA的主要目的并非降低成本,而是將其作為一種措施來保證對干預的投資是建立在證據的基礎上,并且這些投資是物有所值的。
這就是說,要承認澳大利亞的系統對經濟壓力的可承受性有不斷增加的趨勢。這反映了在我們的健康保險支付計劃中定義為“可接受的成本-效果”的任何特殊決策規則即一次一付的醫療費(fee-for-service)的關鍵作用的缺失,以及在MBS和PBS的計劃中具體支付上限的缺失。未來,有效但昂貴的藥物和新技術的可用性會不斷增加。意識到具有成本-效果技術的可用性與可支付性之間的壓力后,澳大利亞主要的HTA計劃(由PBAC和MSAC完成)仍然提供了一種使政府能夠用以調整與衛生支出相關的決策機制。為了保證可支付性得到相應考慮,并同時保證系統的可持續性,要求預算影響超過500萬澳元的新藥應獲得財政部(Department of Treasury and Finance)同意,而預算影響超過1000萬澳元的新藥則需在對藥物的可用性提出任何建議之前首先得到內閣(選舉政府中的決策者)的批準,這些要求是對PBAC決策制定角色的補充。如有必要,還可以引入其他限制使用的附加機制,可以發布政策公告或通過安排共付或稅收提高公共出資。
(二)評估與決策制定中的透明度
一些醫藥公司與制造商不愿向TGA、PBAC和MSAC提交其衛生技術的申報資料,因為其中含有商業敏感性信息,不宜公開。因此,澳大利亞允許提交衛生技術注冊或資助的申請人通過這些機構提供一份基于商業秘密(commercial-incon dence)的信息,作為其提交資料的一部分。與美國食品藥品管理局(FDA)和歐洲藥品管理局(European Medicines Evaluation Agency)不同,TGA并不發布其評估的任何細節。
過去,PBAC已經接受基于商業秘密的提交資料,而且并不公開其決策背后的原因。然而,受最近的澳美自由貿易協議的影響,PBAC將會在互聯網上公開發布其決策制定的原因,但其中許多信息(特別是經濟性分析的細節)是不公布的。一般公布的內容僅為臨床信息和經濟性信息的摘要。
另一方面,MSAC在較近期啟動的一項HTA中刪除了認為是商業秘密信息的部分后將其評估報告完全公布。然而,MSAC指南[13]卻指出“健康與老齡化部(DHA)的文件已符合1982年信息自由法(Freedom of Information Act)。這意味著可以要求DHA授予對其信息的使用權。即使一份文件打上了商業秘密的標記,也不能否定該文件在該法案下的使用權。當文件顯示含有商業秘密時,DHA應與文件所有者協商,在做出授予或不授予該文獻使用權的決定時將文件所有者的意見納入考慮。”將MSAC的評估報告完全公布于眾是出于對一些批評[14]的回應,這些批評稱MSAC的決策不明確,經常與評估報告中的建議相矛盾。因此,由MSAC提出的建議及建議的原因已成為可公開獲得的文件,同時還可以得到評估報告的副本。是否屬于做出建議的依據,是判斷決策的制定是否依賴于商業秘密信息的指標之一。
在我們看來,由于公共資金將被用于支付獲得資助的技術,因此有足夠的理由認為所提交的用于支持公共補貼申請的數據應該對公眾公開。我們進一步認為由政府機構進行評估的這些數據也應該為健康專業人員和消費者所用。系統的成功運行依賴于健康專業人員對技術限制使用的遵守,而如果健康專業人員能夠理解限制一項技術可用性決策背后的原因,則其合作可能會更容易實現。
國內外已有許多呼聲,要求增加制訂規章和補償決策的透明度。例如關于臨床試驗國際性注冊的號召,它會使臨床試驗的不利結果無法得到隱瞞[15,16]。為回應公眾對以PBAC和MSAC決策為基礎的更多相關信息的強烈需求,以及澳美自由貿易協議的影響,澳大利亞的HTA透明度正在不斷增加。
(三)影響決策的因素
有些人可能認為決策制定者需要設定一個明確的決策閾[如每獲得一個質量調整生命年(QALY)所需的增量成本]作為可接受的成本-效果。而另一些人認為設定決策閾是有問題的,這會鼓勵系統的“賭博”[干預的價格定為最高價,使增量成本-效果比(ICER)低于閾值],因為這種公式驅動的方法忽略了影響一項增量成本-效果特殊評價是否被接受的其他因素。更全面的考慮包括:1)圍繞增量成本-效果點估計的不確定性程度;2)疾病或病情的嚴重程度以及負擔;3)疾病的流行性;4)替代療法的可及性;5)納入替代療法的凈財政影響(包括干預在指定限制外普遍應用的潛力)。
在澳大利亞,PBAC和MSAC均未設定過任何決策閾作為可接受的成本-效果,并且將來也不會進行這種設定。經濟性評價在澳大利亞決策制定中所扮演的角色仍然是整體中的一部分,而非代表“游戲結束”。Harris等人[17]對澳大利亞新藥的公共保險范圍相關決策中各因素的相對影響進行了一項分析,結果顯示 “沒有證據表明存在生命年或QALYs的一個固定公共閾值,但意愿支付確實與臨床疾病的特征、對效果證據及其關聯的可理解信任以及帶給政府的總成本明確相關。”關于MSAC決策的類似分析還沒有報道;但對其決策制定基礎的類似考慮還是存在的。
正如之前所列舉的,在作出是否“接受”一項增量成本-效果特殊評價的決策時也會考慮除經濟性之外的其他因素。使用處于任何限制之外的一項干預措施(即“漏出物”)的潛力可能是這些考慮因素之一。例如,因某種原因列入PBS的藥物,也可以因該原因用于其他目的,這種情況需要引起注意,當其上市權(在澳大利亞由TGA授予)范圍廣于補貼決策所涉及的范圍時,情況尤為如此。超限制使用(漏出物)的實例包括將產品用于治療患有相同疾病的患者群,但對于該群患者而言,此項干預措施雖可用但其成本-效果未得到證實(例如,目錄指定的一項干預措施限用于患有某一疾病患者中的一個特定亞群,但該干預在其他亞群中的成本-效果證據卻未得到)。為解決這些潛在問題,PBAC和MSAC要求建立一個風險共擔協議(risk-sharing agreement,RSA)。RSA至少可以用來處理以下三種風險:(1)政府的總財政成本,該成本可能會受到患者數量、日劑量和療程三方面不確定性的影響;(2)治療措施的成本-效果,這可能會受到超限制用量的影響;(3)健康產出的總體獲益范圍(雖然RSA中一般較少處理這種風險)。目前,在公共領域中很少出現關于RSA已涉及的風險以及這些協議的產出的信息。當確定由于上述問題而導致對政府預算的財政影響評價難以提前進行時,RSA的使用似乎是越來越多了。
對PBAC的決策產生影響的另一個因素是用于特殊情況的“救援規則”(rule of rescue),該規則會對納入補償目錄產生積極的影響。適用“救援規則”的情況必須同時滿足以下三個條件:(1)治療的疾病符合“救援規則”所規定的限制條件,且在澳大利亞沒有替代療法可用于該病的治療。這是一條絕對的要求。(2)適用于“救援規則”的治療疾病必須限定為嚴重的、進行性的,并可能引起過早死亡的。疾病越嚴重,或可能死亡的年齡越小,或越接近死亡,對考慮使用救援規則的的影響就越大。(3)只有很少數患者符合申請的限制條件中所定義的疾病狀況。同樣,患者數量越少,救援規則的影響可能越大。由于PBAC的PBS是一種基于社區的計劃,因此將不會對個人的情況提供。
正如對“其他相關信息”類別的所有考慮一樣,救援規則是對基于證據的比較成本-效果方面的考慮進行補充而非替代。只有當PBAC根據一項申請中比較成本-效果評估(和其他相關因素)的相關信息而傾向于拒絕該申請時,才需要決定此時是否適用救援規則。
(四)對不確定性的處理
一般在仔細考慮對一項價格高于對照者的干預措施提供補償的建議之前(即對支持具成本-效果的分析結果仔細考慮之前),PBAC和MSAC都需要得到該干預措施在統計學上顯著優于對照者的證據。一些人認為,不論是否在統計學上有顯著性差異,決策都只應該基于平均凈效益(mean net benefits),而基于推論規則的決策會強加成本,這些成本能夠根據資源或放棄的健康效益來測量[18]。我們認為,由于基于平均凈效益選擇的方案沒有對未給患者帶來傷害這一真實的臨床/政策關注點賦予足夠的權重,因此運用首先測量干預的臨床效益,然后考慮干預的經濟性優勢的這一連續過程更為可取。
PBAC和MSAC的指南中均要求進行敏感性分析以考察輸入的改變對經濟性分析的影響。另外,指南要求進行階梯式經濟性評價,這將幫助委員會全方位識別對增量成本-效果比有最大影響的模型。階梯式評價從以下幾個方面對增量效果進行考察:(1)使試驗結果適用于利益人群的任何改變;(2)對模型的時間范圍進行的任何外推;(3)試驗所得的產出到患者相關產出之間的任何轉換。然后,委員會還可能將關注焦點集中在模型中利益相關變量的假設(例如評估的穩健程度,評估是否最恰當,等等)。這種途徑使模型中的假設更為清晰,并且允許在可能與疾病和待評估的干預最相關的假設,以及可能存在最大不確定性之處設定一個優先次序。
HTA的一些指南要求進行概率敏感性分析,尤其是英國的指南。與英國的指南不同,澳大利亞的HTA指南不要求對概率敏感性分析結果進行過度解釋,尤其當分析所用數據并非直接來自同一個隨機臨床試驗所收集的個體患者數據時。非統計學不確定性的重要來源通常是由個體患者數據組成的各種不連續的信息片段。統計學(概率)的不確定性含有隨機誤差,并能夠通過增加樣本量得到降低。許多其他來源的不確定性也會含有系統性誤差,該誤差難以識別并且不能通過增加樣本量的途徑予以降低。例如,它們出現在信息的篩選和測量中,模型構建的詳細說明中,以及看似合理的對模型的潛在假設和明確假設中,特別在對來源不同的信息進行整合時更是如此。由于缺少模型中一些變量之間的相關性信息,概率敏感性分析也許不會對識別真正的不確定性有幫助。雖然概率模型通常允許規定相關性,但這一信息需要具有一定程度的準確性。
PBAC與MSAC的指南均偏好根據生命的全面質量和長度評估價值產出,如獲得的QALYs,這有利于進行各申請間的比較。測量效用的常用方法是在隨機雙盲臨床試驗的受試者中反復應用有效、可靠、敏感性好的多維效用量表(multiattribute utility instrument),同時應用合適的評分算法。然而,許多試驗的產出(outcome)測量并未包含在這種常規的量表中,所以有時需要對非試驗觀察所得的健康狀況賦予效用權重。因此,補償委員會需要在對提交的申請進行比較的偏好與對最小不確定性的偏好之間進行權衡。出于這種原因的考慮,成本-效用分析并非適用于一切情況;特別在將健康產出轉換為獲得QALYs的成本-效用分析時,不僅需要考慮可比性還需要提高不確定性的不可接受程度。
(五)經濟信息的可移植性
正如Drummond和Pang[19]所指,在不同環境下進行的經濟性評價結果,其可移植性可能會受到以下幾個因素的限制:疾病患者人口學特征和臨床特征的不同;疾病流行病學的不同;衛生保健資源可及性的不同;臨床實踐中的變化;衛生保健資源成本的不同;對人群產出進行賦值時所用方法的不同。在澳大利亞,對需要資助的衛生保健技術所提交申請資料中要求包括反映臨床實踐和成本的經濟性分析。作為一個小國(以人口計),澳大利亞經常依賴于其他國家所進行的但適合于澳大利亞背景的經濟性評價。例如,在衛生保健資源的單位成本方面存在差別,但試驗背景卻與澳大利亞背景相似[例如試驗結果適用于澳大利亞人群,資源利用與澳大利亞環境下的資源利用相似,評價中所設的對照(comparator)反映了澳大利亞標準的實踐],如果成本數據是以透明的方式報告的(例如利用的衛生保健資源的單位數據具有明確說明),則可以將經濟性評價進行調整以反映澳大利亞的單位成本。
更為常見的是,在HTA中,決策制定者不希望做重復的工作。關于補償決策信息的具體細節將可以得到,從而使其他國家的決策制定者能夠根據當地的情況重現一項HTA。應當鼓勵較大國家的補償機構意識到較小的利益相關者和國家的這種需求。
(六)產生和使用真實世界的數據
按常規,醫療用品管理局(TGA)使用真實世界中的數據監督醫療用品的安全性(如醫療器械故障和藥品相關的不良結果的報告)。迄今為止,PBAC和MSAC通常不對涉及提供一項干預措施的安全性、有效性或成本-效果進一步相關證據的信息(例如建議僅對納入一項臨床試驗中的患者提供補償)進行委托。與PBAC不同的是,正如在MSAC過程中所描述的那樣,MSAC可以建議對尚缺乏確切證據的干預措施提供臨時性資助,但要求該干預措施必須比已納入公共資助的對照措施更安全、更有效且更具成本-效果。這種臨時性資助能夠為數據收集以及對干預的進一步評價爭取時間。對藥物和醫療干預而言,允許在進一步的證據收集過程中對干預提供有條件資助的機制可能是非常有價值的。在之后幾年中,關于證據開發的有條件資助可能是文獻中廣泛討論的話題。
(七)評估時限
不同的評估方法將會影響政府資助決策的時效性。如果提交至PBAC的申請資料在指定截止日期即通常指的下次PBAC會議前17周之前送達,則該藥物將會在下一次PBAC會議中被考慮。會后,秘書處將獲得的包括建議該藥納入PBS目錄的資料匯總。隨后即可通知申請人。MSAC平均需要13個月時間來完成HTA[13]。
對于PBAC和MSAC兩者評估的時間框架有時會受到對比性批評。盡管如此,由于兩者的評估過程并沒有太大區別,因此這種比較并非完全有據可查。提交給PBAC的申請要求包含一個完整的評估,并需要由獨立的評價人和輔助PBAC工作的不同小組委員會對評估進行詳細核查。申請者在此過程中承擔舉證責任。這與MSAC程序形成對比,在MSAC程序中可接受申請,但完整的獨立HTA是委托別處進行的(與英國NICE程序更相似)。MSAC的獨立評估是其制定決策的主要基礎。因此,進行HTA的評價小組負有舉證責任。MSAC的評估過程也可能由其自身無法控制的許多原因的影響而延遲。詳細信息參見《Value in Health》 補充信息第Ⅴ部分“HTA:澳大利亞的反映”(http://www.ispor.org/publications/value/ViHsupplementary/ViH12s2_6.asp)。
(八)不斷創新
PBAC的指南中包含一份可定期回顧與改進的實時更新文件。該修訂過程受到經濟性小組委員會(Economic Sub-Committee,ESC)的管理,ESC就修訂問題與包括準備向PBAC提出申請者在內的其他利益相關者進行磋商。ESC的作用之一是就衛生技術方面的經濟性評價需求和說明為PBAC提供建議。雖然ESC成員在選擇上沒有明確的標準,但主要是學術界較為活躍者和業界的技術專家。PBAC在成立之初即開始對其程序的各個方面進行審查。例如,對PBAC以往會議過程的回顧[20]已于2004年發表。預計該報告中的建議實施后會使 PBAC提出建議與實際納入目錄之間的時間間隔降低至不超過4個月[21]。
目前,澳大利亞MSAC的HTA程序已經有了新的發展,有兩個回顧性工作評述已經完成。2004年MSAC對其工作程序和方法進行了一次回顧,最終報告于2005年5月發表。最終報告還包括利益相關團體和MSAC對本次回顧的反應,以及得到MSAC支持的活動。該回顧引起的反應之一是發布了關于診斷服務的新指南(2005年8月),并且更新了醫療技術(2005年12月)。澳大利亞聯邦政府對其法規和微觀經濟政策進行審查的重要機構——生產力委員會(Productivity Commission),也提出一份關于醫療技術發展影響的重要報告[22]。而該報告中的許多建議要求政府的各個部門和機構要采取行動而不是由這些機構去審查。
(九)獨立性、衛生政策與政治
PBAC及其小組委員會的成員是該領域中獨立的專家。在加入委員會和參加每次會議之前,均要求成員普遍進行利益沖突聲明[23]。由于PBAC被授予了法定權力,因此受到的政治干擾影響較小。然而,有實例可以證明這種影響還是存在。這里舉兩個例子。第一個涉及2000年PBAC的解散。有新聞記者報道,在2000年約翰·霍華德首相與其選區內制藥公司CEO的一次會議上,有一份內容機密的文件。新聞報道引用了該文件的一部分,即:“行業界十分關心PBAC的成員資格,尤其是一些成員與員工對行業的公開敵對態度。”[24]該文件及相關評論被四處報道,稱制藥業主張通過立法撤銷PBAC的成員資格,可實際上直到2001年該主張才正式被立法。2000年12月31日,聯邦參議院突然通過一項立法,解散了PBAC及其小組委員會[25]。
另一個例子涉及轉移性乳腺癌治療藥物Herceptin。據報道,Herceptin的制造商已三次向PBAC申請將該藥納入PBS目錄,但均未成功。而在沒有PBAC建議的情況下,聯邦政府不能把一種藥物列入PBS目錄[詳細信息請見《Value in Health》 補充信息第Ⅱ部分“HTA:澳大利亞的反映 ”(http://www.ispor.org/publications/value/ViHsupplementary/ViH12s2_6.asp)]。2001年12月1日,在部長的介入下,政府執行了一個新的完全獨立于PBS程序之外的“特殊”程序,為適宜使用Herceptin的患者的藥品費用提供了資金支持[26]。有推測認為,是強烈的游說使得政府在正常的PBS機制之外為Herceptin的資助制定了一項特殊的程序[27]。
MSAC的成員由健康與老齡化部指定。與PBAC一樣,MSAC的成員每次會議也需要就存在的任何利益沖突做出聲明。當存在利益沖突時,這些成員將在委員會涉及沖突的相關決策中放棄表決權。對顧問小組成員的任何相關利益沖突(包括評估報告中涉及的)進行記錄這一做法,現已達成共識。然而對顧問小組來說,利益沖突并不是一個簡單的問題,而且并不清楚在目前的水平下是如何對利益沖突進行管理的。任命臨床醫生進入顧問小組是因為考慮到他們在各自領域中具有專長,并考慮到他們可以較好地按規定執行評估的醫療程序。但是對臨床醫生來說通常是存在利益沖突的,包括衛生技術中的金錢利益。因此,進入顧問小組的臨床醫生未必會發揮對臨床證據進行公正評價的作用,而是對評估程序/技術持擁護態度。目前已出現關于在MSAC決策制定中實施政府干預以及政府應對循證醫學承擔義務的主張。Ware等[28]稱,正電子放射斷層照相術可能會成為聯邦政府的主要支出,而將其納入Medicare計劃內而進行的評估并沒有按照“正常的”MSAC程序進行(這是在繼政府將磁共振成像納入醫保帶來成本井噴式增長和丑聞后不久發生的事)。
(十)平行貿易
“平行貿易”或“平行進口”是指同一公司生產的某產品在多個國家均有銷售,而第三方選擇從這些國家中價格較低的國家進口該產品的行為。澳大利亞政府不允許藥品或醫療產品的平行進口。對限制平行進口規定的批評主要基于著作權法,這些批評包括規定可能會造成國家之間的價格歧視,阻礙并扭曲了競爭,并在國際貿易中強加許多苛刻的限制條件。
據報道,澳大利亞的藥品價格低于世界標準,其價格比美國藥品低60%左右[29]。由于澳大利亞的市場規模較小(表現在僅占全球市場的1%左右),預期其價格政策的影響也較小。但美國和歐洲等其他較大市場的制藥業對價格政策的關注越來越多,也逐漸意識到全球價格的不一致(即使在第一世界發達國家之間也是如此),并開始在一些情況下參考澳大利亞和新西蘭的價格[30]。一些國家在法律上認可平行進口的相關決策也加大了這種關注。在這種意義上,澳大利亞可視為已實質上促成了對制藥業采取無依據性降價的風險(原因是全球的定價考量,對平行進口的關注以及補償目錄中藥品的海外出口),澳大利亞已經受到威脅[31],制藥業可能會讓澳大利亞變成一個以投資受限為特點的國家(如新藥在這里不可能上市)。但這種威脅的可信性目前尚不清楚。
(十一)患者與提供者的選擇
澳大利亞對藥品和醫療技術的管制,被認為使患者和作為患者使用藥品和醫療技術代表的醫生在獲得對這些產品的安全性和質量評估的相關信息時受到了限制。管理機制賦予患者和醫療服務提供者一定程度的信任,以使他們能夠參與到健康市場中來。正如本文中對澳大利亞衛生系統整體結構的描述,國家衛生保健資助系統的目標是使所有澳大利亞人,無論其個人情況如何,均能夠以承擔得起的費用或無償地獲得衛生保健服務,同時通過付貸與融資過程所涉及到的私人醫療保險實體機構,允許個人在不同的醫療服務間進行選擇[32]。
每位澳大利亞公民都可以選擇自己的全科醫生,并通過全科醫生得到專業的治療。在決定使用何種衛生保健干預對患者的疾病進行治療時,社區的患者和醫生擁有足夠的靈活度。然而,政府確實在許多衛生保健干預措施的補償方面增加了一些限制。當患者不滿足這些限制條件時,則要轉而選擇另一種可予補償的替代干預,或選擇自行支付干預措施的費用。
然而,在公立醫院治療的公費病人(public patients)則不能自已選擇醫生或專科醫生。患者對公立醫院所提供干預措施的選擇受到醫院是否可以提供該措施,以及患者是否滿足醫院對該措施的可及性增加的限制條件。擁有個人健康保險的患者可以自己選擇醫生。私立醫療服務機構的醫生能夠提供MBS補償目錄之外的醫療服務,其全部費用由患者自己負擔。
將醫療服務納入MBS增加了有支付能力的患者數量。與公費病人相比,公立醫院及私立醫院中的自費病人可以較早地嘗試新技術的使用[33]。
(十二)對預算、補償和使用權的影響
2003~2004年,澳大利亞總衛生支出1993~1994年由占GDP的8.3%上升至占GDP的9.7%。總衛生支出增長中的絕大部分由聯邦政府衛生支出的增長構成,該數值占GDP的百分比已從3.7%升至4.4%。聯邦政府衛生支出的增長率是私營部門增長率(從占GDP 2.8%至占GDP 3.1%)以及州和地方政府增長率(從占GDP1.8%至占GDP 2.2%)的二倍左右[34]。圖2描述了衛生支出(不同的資金來源)隨時間的變化[35]。
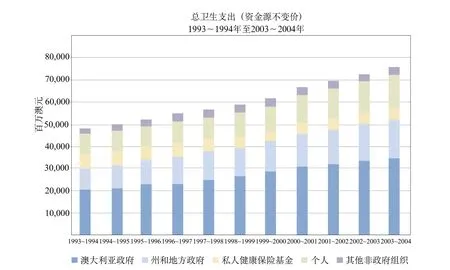
圖2 澳大利亞衛生支出(按資金來源)隨時間的變化
健康干預的政府預算是作為所有常規健康預算的一部分來進行管理的。在澳大利亞,由于HTA是澳大利亞衛生服務財政支持的一部分,并已成為大多數新干預得以采用的基礎,因此它具有直接的政策相關性,這與加拿大等國家是不同的,在這些國家中HTA并不直接用來為決策制定提供信息支持[36]。Medicare衛生保健的方式受到許多規章制訂因素的控制。直接預算的上限限制了公立醫院的支出和大多數小型衛生保健和老年人護理項目。但醫療服務(MBS)和藥品(PBS)是沒有上限的,而且都以一次一付醫療費(fee-forservice)安排為特征。MBS/PBS系統的支付能力和可持續性已經成為澳大利亞兩個政治派別在政府政策上的持續爭議點。通過限制醫學院的數量和醫生移民來減少醫生的提供這一方法已經被用來控制Medicare的開支,但這并不是解決問題的有效方法,還可能帶來醫生人數過少的尷尬局面。另一種政策途徑是通過增加患者共付比例來抑制對醫療服務的需求并降低政府的開支,但這可能會帶來我們不希望看到的公平性問題。當PBS的支出沒有明確的上限時,支出的增長受到謹慎的監督,而項目成本超過1000萬澳元有證據支持的建議則必須得到內閣的批準。
盡管存在關于可支付能力的擔憂,澳大利亞在衛生保健成本的控制方面仍然算比較成功的,并且具有一個適用范圍廣闊、發展良好且易于接受的衛生保健系統,其衛生保健工作人員也十分訓練有素。與其他國家相比,澳大利亞已獲得了較好的健康產出。根據衛生保健方面投資所獲得的健康產出來看,除土著居民等特殊人群外,澳大利亞具有高水平的人口健康、長壽預期和低嬰兒死亡率(估計每1000個新生兒中只有4.57例死亡)[37]。這種成就的主要原因是Medicare項目和PBS項目以及政府在衛生保健資金支持和配置中保持了高水平投入。澳大利亞已經意識到了這一點,并繼續對這些項目提供高水平支持。
三、供其他國家參考的經驗教訓
澳大利亞為響應包括公共和私人衛生保健提供者在內的衛生保健系統的需求而建立了HTA。澳大利亞的系統是分離的(藥品與醫療服務,聯邦與州,公共與私人體系),因此在HTA過程中可能會出現重復評估[38]。一些人認為由于藥品依賴于臨床證據的歷史較長,并且評價時所用的方法比醫療服務更為直接,因此藥品與醫療服務的評估需求之間存在差別也是合理的。另外,認識到不同的資金提供者,州與聯邦政府、私人機構與公共機構的職責不同是很重要的,而這些職責只有通過對所付出的努力進行評估才能得到最有效的履行[39]。然而對于澳大利亞系統來說,提高效率并消除不必要的重復是一項有待完成的任務,特別在擁有實施HTA所需技能的人員數量有限時,這種重復會導致更多的關注集中于把提供服務的成本轉移給其他支付者,而不是以最有效的途徑去提供服務。
澳大利亞系統的主要缺點可以概括為以下幾個方面:(1)筒倉預算(silo budgeting)的利用;(2)關注點在臨床決策上,而非公共健康上;(3)缺乏減資(投資縮減)意識;(4)資助/激勵研究的能力。
澳大利亞公眾的健康受到政府政策的大范圍影響,如衛生保健、稅收、雇傭、教育、住房、交通、地區發展和社會保障等。因此,各種各樣政府保險業務相結合的途徑可能會更有效地利用資源。然而與其他國家一樣,在澳大利亞對潛在影響健康狀況(如住房、教育、環境和衛生保健等)的服務,資金支持卻是各自獨立的,這種情況不僅出現在不同領域之間,即使在同一領域也是如此。例如,澳大利亞對衛生技術的資金支持就分為幾個不同的項目(PBS、MBS、醫院等),并且有可能對“筒倉(silo)”決策制定產生影響。在MSAC和PBAC進行財政分析時,僅有限地考慮了將用于支付所建議衛生技術的資金的機會成本。例如,假設某新藥可用于治療阿爾茨海默癥,財政分析會確認PBS預算中所增加的支出;但該資金的其他潛在應用(如有助于阿爾茨海默癥患者的護理)則很少得到考慮。
政府面臨的最大挑戰之一是它不僅需要在不同類型的保險業務之間,而且還需要在不同的醫療衛生服務之間進行決策制定的協調。澳大利亞的方法將會為不同機構間對干預措施的評價帶來挑戰,這是由于很難確定哪個機構應該負主要責任。例如,使用藥物維替泊芬進行的光動力療法(PDT),其中PDT部分納入MBS目錄,而維替泊芬則納入了PBS目錄。
同時,“筒倉預算(silo budgeting)”精神已將澳大利亞HTA的關注焦點集中于臨床保健決策,而不是對更廣泛用于人口健康問題以及用于以公共健康為目標的預防性干預措施的評價。干預的篩選和研究人員通過競爭性研究撥款資助的大量研究的啟動是個例外。照此來看,是“筒倉預算”精神之外的其他原因導致了公共健康干預中HTA重要性的缺失,在HTA領域,建立嚴格的證據基礎面臨著許多挑戰。盡管已經提出了一些很高級的模型用于解決公共衛生干預建模的復雜性,但缺失設計良好且可信的療效結果在很大程度上限制了該領域的發展。
澳大利亞HTA過程的另一個缺點也是其他國家的HTA所共有的,即“減資”問題。澳大利亞的HTA過程大體上是用戶引導式的,即為響應來自行業或干預使用者的申請(雖然有報道稱MSAC大約30%的工作與聯邦衛生與老齡化部的需求有關)而進行。目前,并沒有一個清晰的過程能夠對已得到補償的老技術進行評估,一旦發現該技術不具成本-效果便將其撤出補償目錄。作為決策制定基礎的證據應用應將更多關于老技術的常規評價需求納入其中,作為HTA體系的一部分。其例外情況是,當一個“藥物”或“醫療服務”已被證明不安全時,應立刻將其從所在的補償目錄撤出。
雖然澳大利亞已經引入了全面審核制度,從而使聯邦和州衛生部門能對所有可能影響未來衛生保健系統的新興醫療技術進行確認,但對那些HTA機構認為其證據的力度尚不足以支持決策制定的領域,目前HTA機構并沒有能力鼓勵進行任何的直接研究。這與英國的NICE形成了鮮明的對比,NICE已逐漸有能力設定需要進行更多研究的領域,并針對研究問題進行更為穩健和科學的評估,或在預防性干預等新興領域中找到相關數據。在澳大利亞,未來的資金支持有希望促進HTA機構與公眾的合作,鼓勵HTA將自己的研究提上議事日程。
四、結論
在下述要達到的目標之間必然會存在矛盾:(1)嚴格以證據為基礎的評估;(2)管理的可行性;(3)應有的程序。在澳大利亞,這些矛盾存在于下列幾種情況。
(一)需提交給委員會的評估資料水平與補償過程的易控制性
隨著時間的推移,PBAC和MSAC提交資料中所要求包含的信息已隨著指南的發展而有所增加。由于信息需求量和分析復雜程度的增加,評價過程變得更難以管理,其成本也越來越高(尤其是時間成本)。例如在最近幾年,一次PBAC會議的平均時長已從2天增加到了3天。
(二)提供給利益相關者的應有程序和補償程序的時效性。
決策制定過程中多種信息的輸入給利益相關者提供的機會越多,作出決策所需要的時間就越長。PBAC會議召開的次數已經由一年4次減少為2004年的一年3次,從而能夠為申請人提供過程中更多的反饋信息。
目前無法判斷在澳大利亞的經驗中,分析的嚴格性、管理的可行性和應有的程序之間是否已經實現了恰當平衡。尋找這種平衡是一項不斷發展的事業,并需要得到所有利益相關者的良好意愿與合作。
ISPOR為此項研究提供了慷慨資助。Liliana Bulfone,Sandra Younie和Rob Carter沒有需要聲明的利益沖突。
[1]Australian Institute of Health and Welfare 2008.Health expenditure Australia 2006 2007.Health and Welfare Expenditure Series no.35.Cat.no.HWE 42.Canberra: AIHW,2008.Data source: Table a.3 (p.120)[O/L].[2008-01-02].http://www.aihw.gov.au/publications/hwe/hea06-07/hea06-07.pdf
[2]Australian Institute of Health and Welfare.Australia’s health 2006.AIHW cat.no.AUS 73.Canberra:AIHW,2006[O/L].[2007-08-06].http://www.aihw.gov.au/publications/index.cfm/title/10321
[3]Medicare Australia Information Sheet.Department of Health & Ageing (DOHA) [O/L].[2007-08-06].http://www.medicareaustralia.gov.au/about/whatwedo/medicare.jsp
[4]The National Health Act 1953 as amended.Commonwealth of Australia[O/L].[2007-08-07].http://www.austlii.edu.au/au/legis/cth/consol_act/nha1953147/s101.html
[5]Health Insurance: Prostheses List[O/L].[2007-09-03].http://www.health.gov.au/internet/main/publishing.nsf/Content/healthprivatehealth-prostheseslist.htm
[6]Productivity Commission 2005,Impacts of Advances in Medical Technology in Australia,p.257.Submission of DoHA to Productivity Report.Research Report,Melbourne[O/L].[2007-09-03].http://www.pc.gov.au/projects/study/medicaltechnology/docs/finalreport
[7]Department of Health & Ageing—Media Release [O/L].[2007-08-27].http://www.health.gov.au/internet/budget/publishing.nsf/Content/BC823217D493393CCA2572D400376387/$File/afact11.pdf
[8]Budget 2003-2004-Health Budget: Health Fact Sheet 3—A focus on Prevention.Department of Health &Ageing[O/L].[2007-08-27].http://www.health.gov.au/internet/main/publishing.nsf/Content/ health-budget2003-fact-hfact3.htm/$FILE/hfact3.pdf
[9]PBAC Publications: Guidelines for preparing submission to the PBAC.Department of Health and Ageing[O/L].[2007-08-27].http://www.health.gov.au/internet/main/publishing.nsf/content/pbac_guidelines-index
[10]Birkett DJ,Mitchell AS,McManus P.A costeffectiveness approach to drug subsidy and pricing in Australia.Health Aff,2001,20:104-114
[11][O/L].[2007-08-06].http://www.msac.gov.au/internet/msac/publishing.nsf/Content/evaluation-cycle-1
[12]Harris A,Bulfone L.Getting value for money: the Australian experience.In: Jost TS,ed.,Health Care Coverage Determinations: An International Comparative Study.Maidenhead: Open University Press,2005
[13]MSAC Application Process: Guidelines[O/L].[2007-08-28].http://www.msac.gov.au/internet/msac/publishing.nsf/Content/guidelines-1
[14]Report of the review of the Medical Services Advisory Committee: May 2005[O/L].[2007-09-02].http://www.msac.gov.au/internet/msac/publishing.nsf/Content/review-1
[15]DeAngelis C,Drazen JM,Frizelle FA,Haug C,et al.Clinical trial registration [editorial].A statement from the International Committee of Medical Journal Editors.Med J Aust,2004,181:293-294
[16]DeAngelis C,Drazen JM,Frizelle FA,Haug C,et al.Is this clinical trial fully registered? [editorial].A statement from the International Committee of Medical Journal Editors.Med J Aust,2005,182:609-610
[17]Harris AH,Hill SR,Chin G,et al.The role of value for money in public insurance coverage decisions for drugs in Australia: a retrospective analysis 1994 2004.Med Decis Making,2008,28:713-722
[18]Claxton K.The irrelevance of inference: a decisionmaking approach to the stochastic evaluation of health care technologies.J Health Econ 18:341-364
[19]Drummond M,Pang F.Transferability of economic evaluation results.In: Drummond M,McGuire A,eds.Economic Evaluation in Health Care.Oxford: Oxford University Press,2001
[20]Working Together to Improve the Pharmaceutical Benefits Scheme: Review of Post PBAC Processes Report.2004 Department of Health and Ageing[O/L].[2007-09-02].http://www.health.gov.au/internet/main/publishing.nsf/Content/B3CE8CB96EB0E3A6CA2573FC001C4319/$File/pbacprocess.pdf
[21]Media Release: Minister of Health and Ageing[O/L].[2007-09-02].http://www.health.gov.au/internet/ministers/publishing.nsf/Content/health-mediarel-yr2004-taabb270704.htm?OpenDocument&yr=2004&mth=7
[22]Productivity Commission 2005.Impacts of Advances in Medical Technology in Australia[R].Melbourne
[23]Official Committee Hansard.Senate: Community Affairs Legislation Committee.Consideration of Additional Estimates.Monday,19 February 2001.Canberra[O/L].[2007-09-02].http://www.aph.gov.au/HANSARD/senate/commttee/s4564.pdf
[24]Paying the Price: How the pharmaceutical industry broke the scheme which delivers Australians cheap medicines? Australian Broadcasting Corporation.Four Corners.Reporter Liz Jackson[O/L].[2007-09-02].http://www.abc.net.au/4corners/stories/s248583.htm
[25]Henry DA,Birkett DJ.Changes to the Pharmaceutical Benefits Advisory Committee: Any proposed change in the Committee’s role should be communicated widely.MJA,2001,174:209 210[O/L].[2007-09-02].http://www.mja.com.au/public/issues/174_05_050301/henry/henry.html
[26]Brown L,Walker A,Waters AM,Harding A,Thurecht L.Funding of High Cost Biotechnology and Other Innovative Targeted Therapies under the Pharmaceutical Benefits Scheme.National Centre for Social and Economic Modelling.NATSEM.University of Canberra.Position Paper.27 February 2002[O/L].[2007-09-02].http://www.pc.gov.au/projects/study/medicaltechnology/docs/submissions
[27]Kaye KI,Lu CY,O’Day R.Can we deny patients expensive drugs? Aust Prescr,2006,29:146 148[O/L].[2007-09-03].http://www.australianprescriber.com/magazine/29/6/146/8
[28]Ware R,Francis H,Read K.The Australian government’s review of positron emission tomography:evidence-based policy making in action.Med J Aust,2004,180:627 632; and responses: Davies P.The Australian government’s review of positron emission tomography: an open door.Med J Aust,2004,180:633;Ware R,Francis J,Read K.Med J Aust 181:516-517
[29]Productivity Commission 2003.Evaluation of the pharmaceutical industry investment program,Research Report,AusInfo,Canberra.Page 3.10[O/L].http://www.pc.gov.au/projects/study/piip/docs/finalreport.
[30]Reference Pricing Subcommittee Report (Fifth Draft).West Virginia Pharmaceutical Cost Management Council(Rx Council) [O/L].[2007-08-06].http://www.state.wv.us/got/pharmacycouncil/ReferencePricingReport_Draft5.pdf
[31]The Allen Consulting Group.Drivers of pharmaceutical industry investment.2006[O/L].[2009-01-28].http://www.medicinesaustralia.com.au/pages/images/Drivers%20of%20Pharmaceutical%20Industry%20Investment%20FINAL%20060915.pdf
[32]The Australian Health System.Department of Health and Ageing[O/L].[2007-08-06].http://www.medicareaustralia.gov.au/about/whatwedo/health-system/index.jsp
[33]Productivity Commission 2005.Impacts of Advances in Medical Technology in Australia,Research Report,Melbourne[O/L].[2007-09-03].http://www.pc.gov.au/projects/study/medicaltechnology/docs/finalreport
[34]Health and Ageing Factbook 2006.Department of Health and Ageing.Canberra.Chapter 2[O/L].[2007-09-04].http://www.health.gov.au/internet/main/publishing.nsf/Content/Factbook2006-1
[35]Australian Institute of Health and Welfare (AIHW).Health expenditure Australia 2003 2004.AIHW Cat.No.HWE 32(Health and Welfare Expenditure Series No.25).Canberra:AIHW,2005[O/L].[2007-09-04].http://www.aihw.gov.au/publications/index.cfm/title/10204
[36]Hailey DM.Health technology assessment in Canada: diversity and evolution.Med J Aust,2007,187:286-288
[37]Central Intelligence Agency.The World Factbook.Australia[O/L].[2007-09-03].https://www.cia.gov/library/publications/the-world-factbook/geos/as.html
[38]Productivity Commission.Impacts of advances in medical technology in Australia,research report.Melbourne.p.257 submission of DoHA to Productivity Report.2005[O/L].[2007-09-03].http://www.pc.gov.au/study/medicaltechnology/finalreport/index.html
[39]Jackson TJ.Health technology assessment in Australia: challenges ahead.Med J Aust,2007,187:262 264


