原子熒光光度法中濕法消解、微波消解、干灰化前處理法測定水產品中總砷含量的比較
宋洪強,郝云彬,吳益春,羅海軍,祝世軍
(舟山市漁業檢驗檢測中心,浙江舟山 316000)
砷及其化合物已被國際癌癥機構確認為致癌物,自然界的砷以不同化學形式存在,包括無機砷(三價砷和五價砷)以及有機砷 ,毒性順序為 AsH3>As3+>As5+﹥R—As—X[1]。
砷是食品中的有害元素,是重要的食品、衛生檢測項目,各個國家對食品中砷都有嚴格的限量要求[2],加強水產品中總砷的檢測,是保證初級水產品安全的重要保障。然而,在利用原子熒光法檢測總砷的實際工作中,濕法消解、微波消解和干灰化法三種不同前處理方法使同一產品的檢測結果常常不一致,有時候會相差甚遠[3]。究竟哪一種方法適合,不同水產品應選擇哪一方法更適宜呢?本文應用氫化物原子熒光法中三種不同的消解方法測定貽貝粉、海帶粉標準物質中總砷含量,對三種消解方法所測得的結果進行了初步探討。
1 材料與方法
1.1 儀器和試劑
AFS-930原子熒光光度計(北京吉天儀器有限公司)、專用砷編碼空心陰極燈、WX-4000微波快速消解儀、DKQ-3B智能控溫電加熱器(上海屹堯分析儀器有限司)、DB-3電熱板(嘉興市新勝東城儀器廠)、2.5-10馬弗爐(沈陽市節能電爐廠)、玻璃儀器(所用玻璃儀器均在40%硝酸溶液中浸泡24 h以上)。
使用試劑除特殊規定外均為分析純,實驗用水為超純水。
硝酸、鹽酸、硫酸、高氯酸均為優級純(GR)。載流液(5%HCl):量取50 mL鹽酸,慢慢倒入1 000 mL超純水中,混勻。硼氫化鉀溶液(10 g/L):準確稱取2.50 g氫氧化鈉,溶于超純水中,徹底溶解,再稱取5.00 g硼氫化鉀溶于氫氧化鈉溶液中,定容至500 mL。硫脲溶液(50 g/L):準確稱取5.00 g硫脲,溶于100 mL超純水中,溶解混勻(現用現配)。
1.2 儀器參數
光電倍增管負高壓270 V;原子化器高度8 mm;燈電流60 mA;載氣流量400 mL/min;屏蔽氣流量800 mL/min;讀數時間 7 s;延時時間 1.5 s。
2 樣品前處理及標準曲線繪制
2.1 濕法消解前處理
準確稱取固體試樣0.50 g,置入50~100 mL錐形瓶中,同時做4份試劑空白。加硝酸30 mL,硫酸1.25 mL,搖勻后放置過夜,然后置于電熱板上加熱消解。加入1mL高氯酸,繼續加熱至消解完全,再持續蒸發至白煙散盡,冷卻,加入50 g/L硫脲2.5 mL,定容至25 mL比色管中,樣品稀釋20倍待測。加熱消解溫度梯度為150℃1 h,200℃1 h,300℃消解至未有未分解物質或色澤幾乎無色透明,消解趕酸至白煙散盡[4]。
2.2 微波消解前處理
A:準確稱取固體試樣0.50 g左右,置于消解罐中,同時做4份試劑空白,加入7 mL硝酸和2 mL過氧化氫搖勻,放置4 h。然后參照表1條件消解,消解完畢,150℃趕酸、冷卻,轉移至25 mL比色管中,加入2.5 mL鹽酸、5 mL 50 g/L硫脲溶液,用純水定容,稀釋20倍待測。
B:消解同A,消解完畢冷卻后,加入1.25 mL硫酸和1 mL高氯酸分別于150℃、200℃、300℃趕酸處理,冷卻,轉移至25 mL比色管中,加入2.5 mL鹽酸,5 mL 50 g/L硫脲溶液,用純水定容稀釋20倍待測[8]。
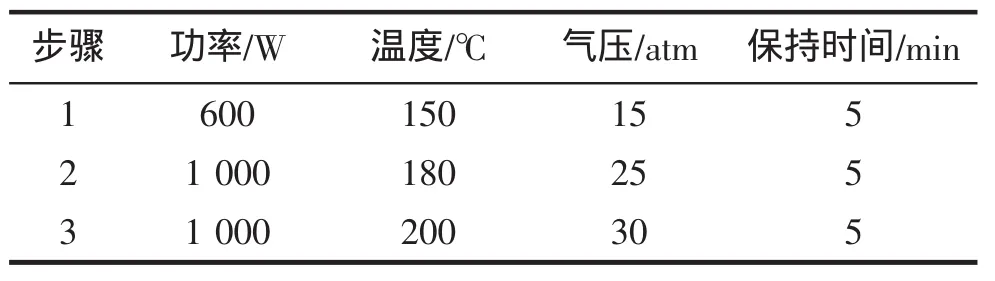
表1 微波消解程序Tab.1 Microwave digestion process
2.3 干灰化前處理
準確稱取固體試樣0.50 g,同時做4份試劑空白,加入150 g/L硝酸鎂10 mL混勻,低熱蒸干,將氧化鎂0.5 g仔細覆蓋在干渣上,于電爐上碳化至無煙,移入500℃高溫爐灰化4 h,取出冷卻,加入(1+1)(V/V)鹽酸 10 mL,移入 25 mL比色管中,加入 2.5 mL 50 g/L硫脲溶液,用(1+9)(V/V)硫酸分次刷洗坩堝合并,定容25 mL稀釋20倍待測[4]。
2.4 標準曲線繪制
砷標準儲備溶液(100 mg/L),由國家環境保護總局標準樣品研究所提供。將儲備液逐級稀釋到10 μg/L,采用儀器自動稀釋功能,測量 2.000、4.000、6.000、8.000、10.000 μg/L 五點的熒光值,繪制標準曲線。
3 結果與討論
3.1 三種消解方法的原理及應用
濕法消解是通過氧化性酸和氧化劑,在加溫加熱條件下對有機質進行氧化、水解,達到無機化的目的。微波消解技術,現在已被廣泛地應用到各行業的檢測分析方法中,它通過加壓加熱來達到破壞有機質的目的,有著快速、安全、有效及使用試劑少、污染小的優點[5]。干灰化法是在供給能量的前提下,利用高溫下空氣中氧將有機物升溫氧化(450~800℃)和碳化,有機物燃盡除去,揮發掉易揮發性組分,待測物保留在干灰中[6]。
3.2 水產品中總砷的消解條件
動物性海產品中均含有很大比例的砷甜菜堿和砷膽堿,植物性海藻中砷糖很豐富,但不存在砷甜菜堿。砷甜菜堿和砷膽堿在硝酸中加熱會轉化為三甲基胂氧化物,接著轉化為二甲基胂酸(DMA)。植物性海藻中的砷糖在酸堿條件下會發生糖水解形成基礎糖元[7]。
在硝酸氧化體系中,單甲基胂酸(MMA)在小于140℃條件下和二甲基胂酸(DMA)在小于200℃條件下穩定,二甲基胂酸(DMA)在300℃時放置90 min后才可完全轉化為五價砷離子;砷糖在100℃加熱10 min未發生顯著改變,在60℃水浴中用6 mol/L鹽酸提取18 h,砷糖部分或全部轉化為DMA[9-11]。常用的消解方法濕法消解和微波消解的溫度均不能使MMA和DMA完全轉化為砷,但是達到300℃的消解條件,方法均可使用。
3.3 實驗結果
3.3.1 濕法消解(按 2.1 處理)
由表2可知,貽貝粉和海帶粉均符合標準。由此可見,濕法消解處理中加熱達到300℃的條件,可破壞砷甜菜堿和砷膽堿,進行徹底的無機化消解,可以得到所要結果。此方法常用酸有硝酸、高氯酸、硫酸以及鹽酸,在實際應用中常以混合酸形式在消化以提高消化效率。常壓下,硝酸的沸點為86℃,高氯酸的沸點為200℃左右,硫酸沸點為338℃,鹽酸沸點為108℃。國標中總砷的濕消化是以硝酸-硫酸體系、硝酸-硫酸-高氯酸體系來消化樣品,該方法對大部分砷存在形式比較簡單的樣品尚能滿足前處理要求,在樣品中砷存在形態復雜的時候結果基本偏低,分析原因除了揮發損失外,最主要的還是溫度過低,有些穩定的砷存在形態不能被完全無機化造成在儀器上無響應或者響應偏低。該方法耗費時間長,耗費試劑多,并需要專人看護以觀察試劑的量值和避免碳化。
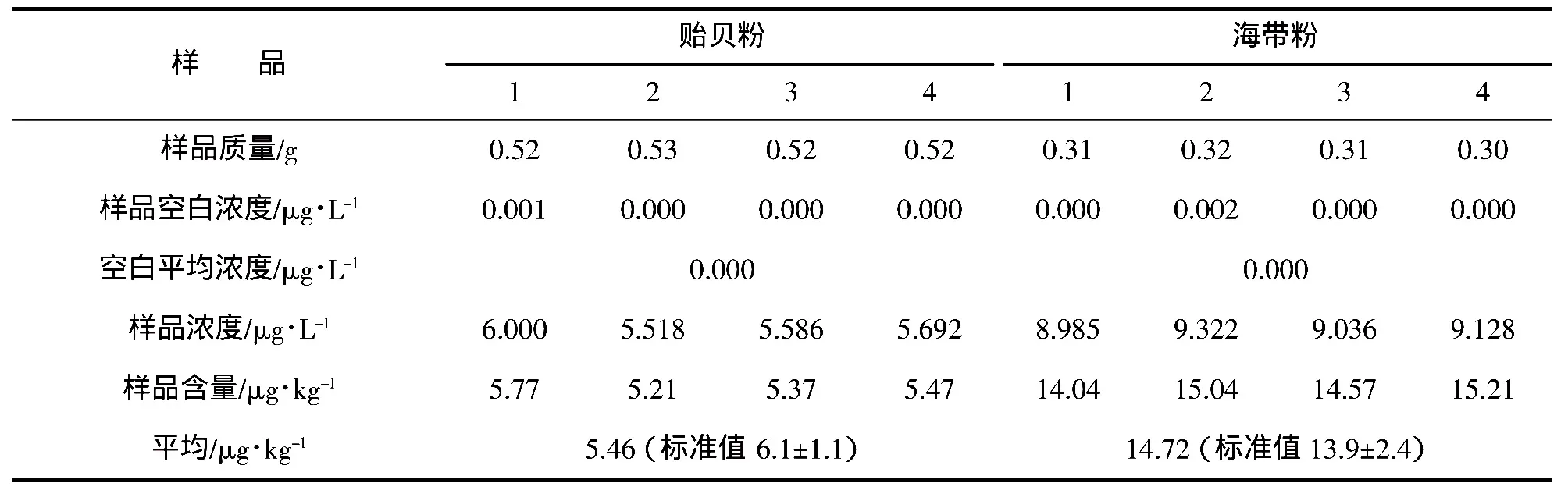
表2 濕法消解結果Tab.2 The results of wet digestion
3.3.2 微波消解(A)(按 2.2A 處理)
由表3可知,貽貝粉和海帶粉均未符合標準,可知簡單的微波消解無法徹底消解掉樣品中所含的砷,即由于消解儀器對酸的使用的限制(眾多的消解儀器不允許使用硫酸和高氯酸),即使加壓加熱,仍無法破壞掉砷的組織形態,而且微波消解儀器的加熱溫度限制在200℃無法達到要求。在微波消解的應用中發現對于不同類別的樣品,所得結果滿意度也不盡人意。微波消解系統對含有復雜形態的砷的水生生物樣品消解不完全,部分物理化學性質穩定的砷化物不能被消解成無機砷形態,從而引起總砷的測定偏低。
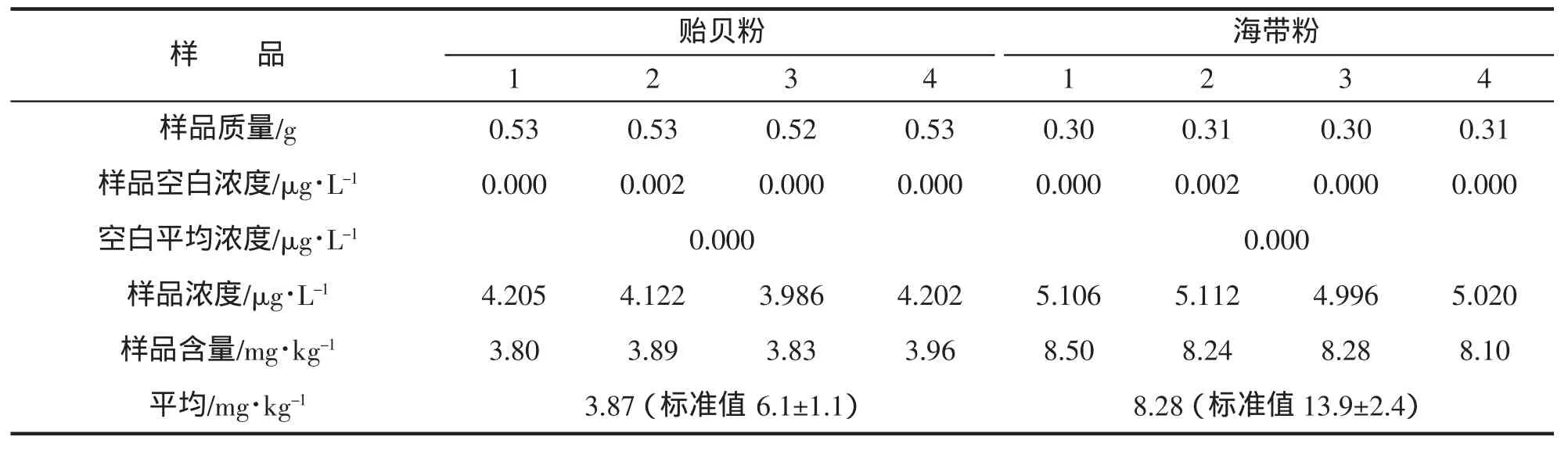
表3 微波消解(A)結果Tab.3 The results of microwave digestion(A)
3.3.3 微波消解(B)(按 2.2B 處理)
由表4可知,貽貝粉和海帶粉所測結果符合標準,與(A)相比,(B)彌補了微波消解的缺陷,即微波消解+濕法消解的應用,彌補了微波消解對酸和溫度的限制,好處就是縮短了濕法消解前處理的時間以及前期對酸的用量。此方法擺脫了酸和溫度的限制,使水產品得到徹底消解,減少了污染,對批量不大的樣品是個很好的選擇。
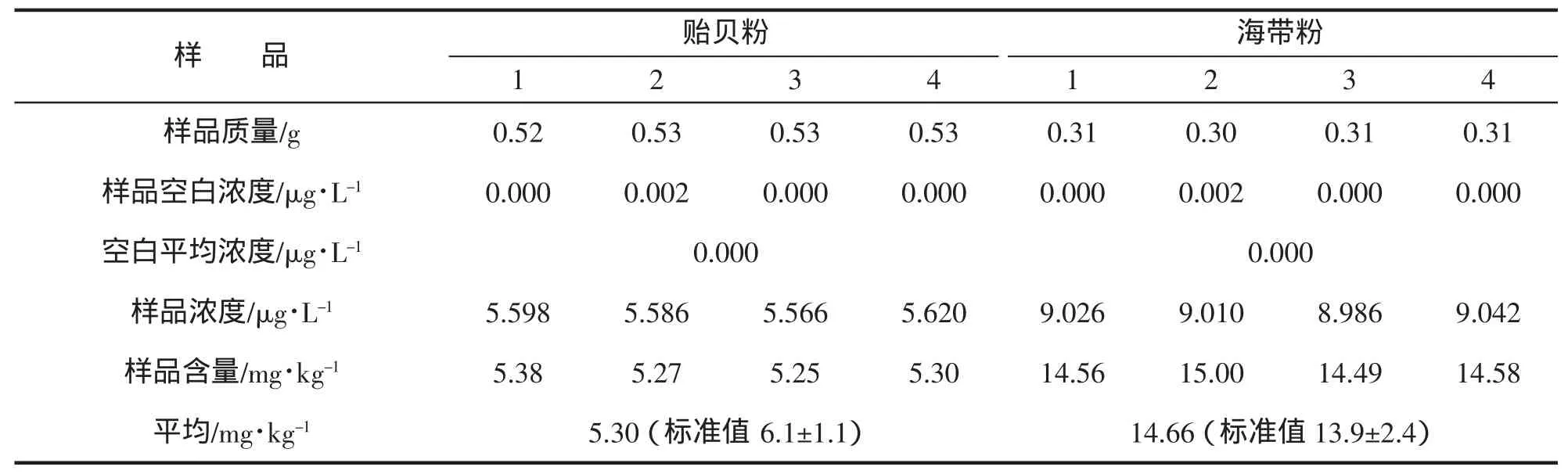
表4 微波消解(B)結果Tab.4 The results of microwave digestion(B)
3.3.4 干灰化(按 2.3 前處理)
由表5可知,貽貝粉所測結果符合標準,海帶粉所測結果偏低。分析原因為海帶粉是一種易燃的輕質粉末,在碳化過程中非常容易造成燃燒速度過快而導致樣品飛濺,而且容易造成砷吸收劑輕質氧化鎂覆蓋層的破壞,在此情況下于500℃馬弗爐灰化時會導致砷的嚴重損失。
干灰化法是一種日常樣品元素分析中常用的前處理方法,尤其對揮發性溫度比較高的元素。相對于濕法消解和微波消解,干灰化法簡便,對濕法消解和微波消解由于消解溫度低而不能消解的砷存在形態可以有效地進行無機化處理。該方法操作簡便快捷,用酸種類少、用量少,時間短,不過對實驗的空白要求高,低熱蒸干、碳化對溫度要求相對高,空白做出往往較高。因此對實驗中的操作步驟要謹慎、注意。
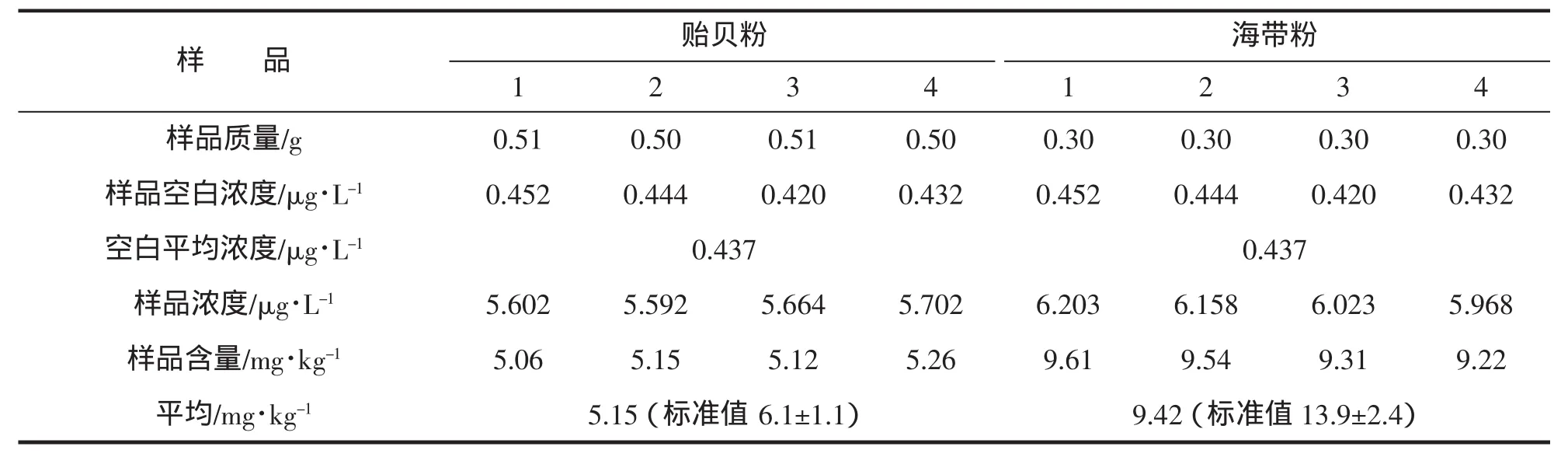
表5 干灰化結果Tab.5 The results of dry ash
3.4 三種消解方法的試劑消耗及時間消耗
由表6可知,三種消解方法中濕法消解消耗酸試劑最多,消耗時間最長,干灰化次之,微波消解用酸量最少,時間最短。
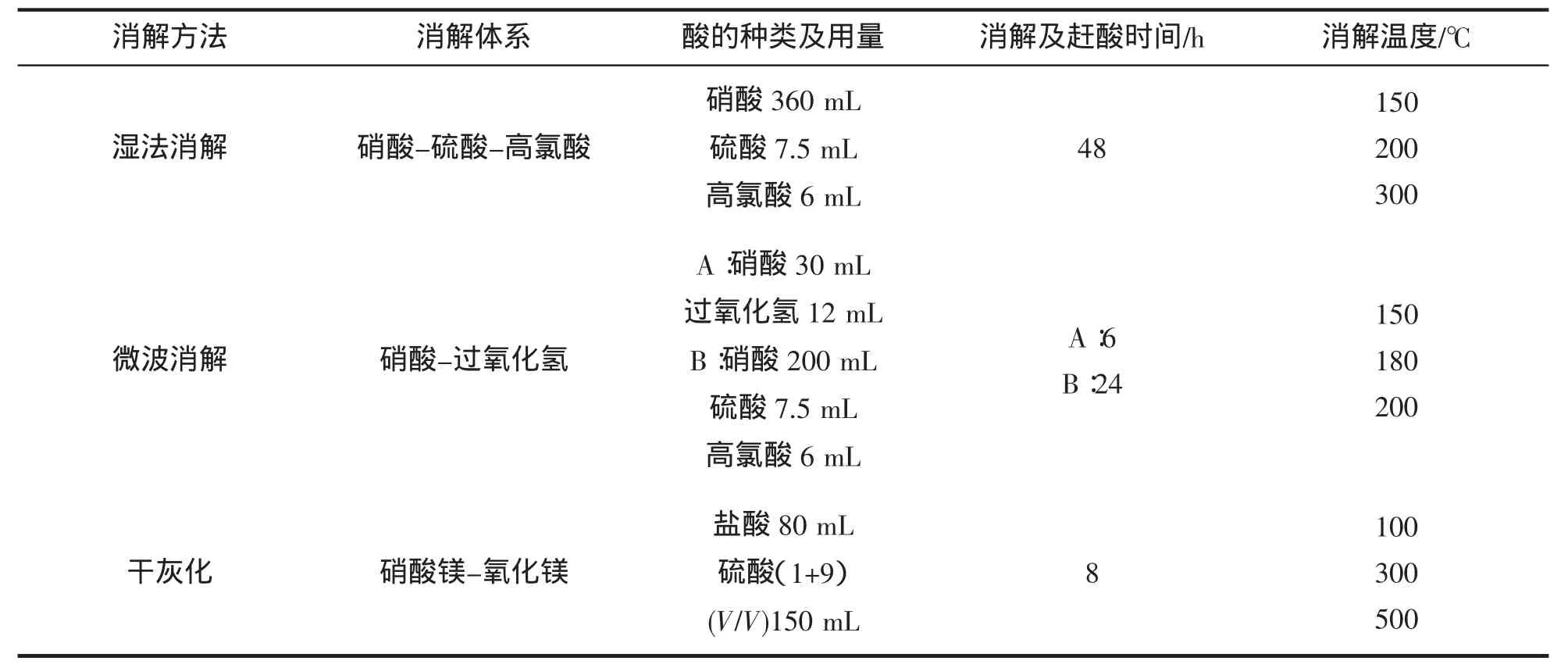
表6 試劑消耗及時間消耗Tab.6 Reagent and time consumption
4 小結
由以上結果數據可知,對水產品的前處理,酸和溫度是消解徹底與否的關鍵因素。
三種消解方法,濕法消解耗費時間最長,用酸種類多,用量大,但數據穩定,對實驗操作要求較低,依據溶液的顏色可判斷消解的程度且同時可處理大批量樣品,是目前實驗室使用最多的消解方法。微波消解(A),操作最簡單,所用溶液最少,但是由于微波消解儀自身原因,使其對酸和溫度的控制達不到徹底消解的條件,所測結果偏低,均不符合要求。微波消解(B),實際上是微波消解(A)和濕法消解的共同處理,相比濕法消解時間少,溶液用量少,結果符合要求。對于干灰化,溫度過高會造成元素的損失,過低會導致無法徹底消解,而且受馬弗爐空間要求的影響,一批測量的樣品,數量相對較少,對空白要求高,現在大多實驗室未采用此方法測量水產品。
因此,從對儀器的要求,對實驗樣品數量的要求,濕法消解是最易達到的條件,對大批量樣品使用適宜。較少量樣品且揮發溫度高或油脂含量高的樣品可采用干灰化處理,而微波消解可處理砷的存在形態結構相對簡單的樣品。
[1]陳 國,凌建剛,許秀琴,等.原子熒光法測定水產品中的無機砷[J].寧波農業科技,2006(4):5-8.
[2]張 靜,彭新然,何弘水.微波消解原子熒光法測定食品中的砷[J].中國衛生檢驗雜志,2006,16(9):1 066.
[3]李 宏,陳 莉,楊漢卿.不同前處理方法對飼料中總砷測定的影響[J].飼料廣角,2004(18):23-24.
[4]強衛國,楊惠芬,毛 紅,等.GB/T 5009.11-2003 食品中總砷及無機砷的測定[S].北京:中國標準出版社,2004.
[5]郭 健,范稚莉,趙乃曼.氫化物原子熒光光度法測定水產品中的總砷[J].中國衛生檢驗雜志,2005,15(1):69.
[6]劉明鐘,閆 軍,陳志新,等.原子熒光應用手冊[Z].北京吉天儀器有限公司,2007.
[7]孫建璋,孫慶海.海帶(Laminaria japonica Aresch)含砷問題的探討[J].現代漁業信息,2004,19(12):25-27.
[8]賀廣凱,馬永安,馬新東,等.微波消解-原子熒光法測定海洋生物中As[J].海洋環境科學,2007,26(4):194-196.
[9]王雪芹.氫化物發生—原子熒光法快速測定食品中痕量砷[D].杭州:浙江大學,2008.
[10]郭瑩瑩.海藻中砷化物檢測技術研究及食用安全性評價[D].青島:中國海洋大學,2008.
[11]蔣瑾華,溫巧玲,胡 思.動物源性食品中痕量無機砷的測定[J].光譜實驗室,2006,23(4):751-754.

