花 血清免疫酶活力對水溫耐受性的研究
方美娟,劉 凱,李智強
(1.浙江海洋學院蕭山科技學院,浙江杭州 311258;2.杭州市農業科學研究院,浙江杭州 310024)
魚類是水生變溫脊椎動物,其生理代謝和生化反應在一定程度上受環境因素影響較大,水溫是影響其生理代謝及其生化反應的重要影響因子。當水溫發生變化時,血液組織中各種酶催化反映的條件就發生變化,導致酶活力發生改變。
花 Hemibarbus maculatus Bleeker屬鯉形目、鯉科、鮈亞科、 屬,俗稱季郎魚、溪竹等,是我國江河中重要的中小型經濟魚類。該魚具有食性雜、分布廣、群體產量高,體形優雅、肉質細嫩鮮美、市場俏銷等特點。目前,對于探討水溫變化對花 生存及血清酶指標影響的研究,仍未見有報道。因此本文主要探討了花 的生存溫度和適宜溫度及水溫變化對其血清免疫酶活力的影響,以期為花 的苗種繁育與養殖提供參考依據。
1 材料與方法
1.1 實驗材料
實驗用花 體重為100~200 g/尾,暫養在水族箱中,投喂顆粒飼料,每日清污、換水,pH為8.0~9.0。待穩定后隨機抽取健康無損傷、活性較強的個體分組實驗,實驗過程中遮光控制光強。
1.2 溫度耐受性實驗
在水族箱中暫養,用控溫電熱棒和冰袋控溫,設3個平行組,每組放入試驗魚10尾,將花 從自然水溫 20 ℃開始每 6 h 升高或下降 4 ℃,直到設置水溫止,實驗水溫梯度設置為 4、8、12、16、20、24、28、32、36℃。整個實驗過程中,保持水體不斷充氣,養殖過程中不投餌。以花 身體不動但輕輕敲打后能游動稱休克;長時間敲打身體不動則認為花 死亡。
1.3 水溫脅迫對血清免疫酶活力影響的實驗
1.3.1 血清的制備
從水中撈起花 ,迅速用濾紙吸干其體表水分后,直接從魚的心臟采血,在室溫下放置2~4 h,待血凝固收縮后,再放入4℃的冰箱中,靜置過夜,使血塊進一步收縮和析出血清。之后在5 000 r/min,4℃下離心5 min,收集上清液即為血清,-20℃保存備用。
1.3.2 酶活力測定
應用試劑盒測定方法進行測定,測定酶類為抗氧化酶(超氧化物歧化酶SOD和過氧化氫酶CAT),水解酶(酸性磷酸酶ACP和堿性磷酸酶AKP),所有試劑盒均購自南京建成生物工程有限公司。
1.4 數據處理
采用Microsoft Excel 2003和 SPSS 13.0 for Windows軟件進行方差分析、多重比較及回歸分析,數據以平均值±標準偏差表示,P<0.05為差異顯著。
2 結果
2.1 花 的溫度耐受性
水溫耐受性實驗結果表明(表1),花 的生存水溫較廣,為4~32℃,適宜水溫為8~24℃。

表1 花 對溫度變化的耐受性Tab.1 The temperature tolerance of Hemibarbus maculatus Bleeker
2.2 水溫脅迫對血清酶活力的影響
2.2.1 水溫脅迫對抗氧化酶(SOD和CAT)活力的影響
實驗結果表明(圖1),在溫度脅迫下,血清SOD活性隨著溫度的不斷升高而發生顯著變化。24℃以前,SOD活性隨水溫顯著升高,在24℃時達到最高,且顯著高于4℃、8℃、12℃各實驗組,(P<0.05);24℃以后,雖然SOD活性無顯著地緩慢增加,但有逐漸下降趨勢;采用二次回歸曲線擬合,其變化趨勢如圖2所示,呈現為拋物線規律,其擬合二元方程為SOD=36.802+12.345T-0.208T(2T表示溫度,P<0.001)。
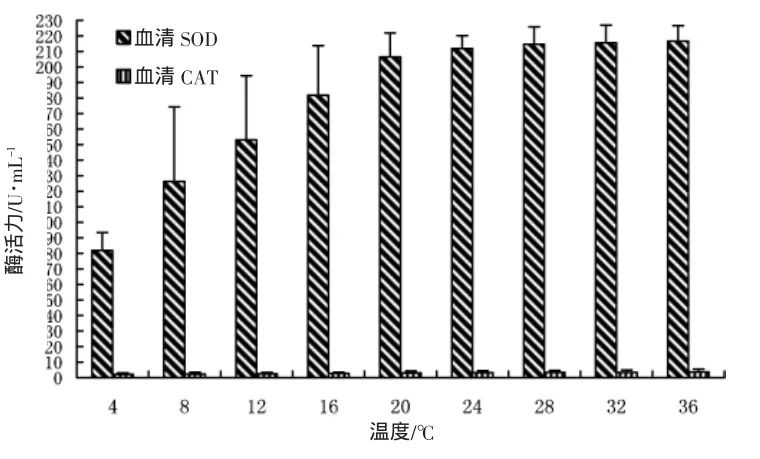
圖1 水溫脅迫對血清抗氧化酶活力的影響Fig.1 The effect of temperature on the activity of antioxidant enzymes
花 血清CAT活性隨水溫升高呈現出上升的趨勢,但CAT活性在個體之間存在較大的變異,最大個體CAT活性出現在36℃,最小個體CAT活性出現在4℃,但方差分析表明,水溫對血清CAT活性無顯著性差異(P>0.05)。
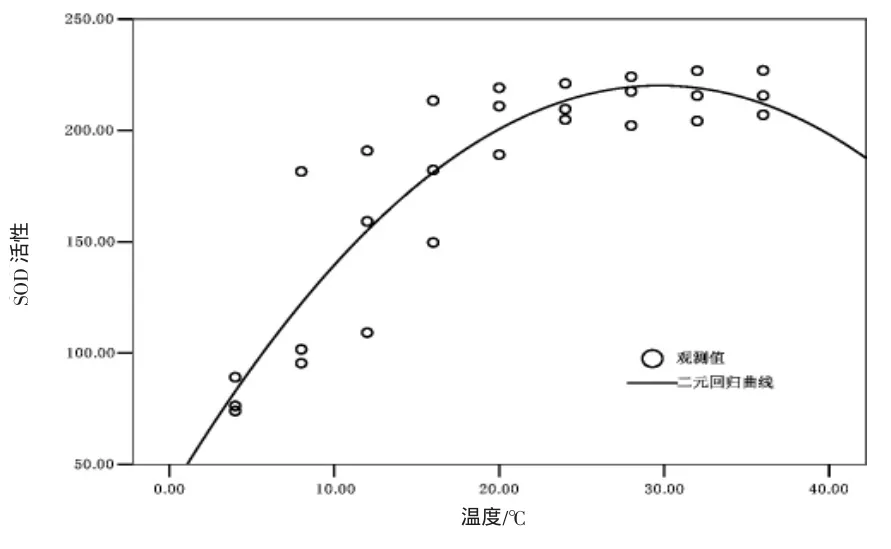
圖2 血清SOD活性與水溫的二元擬合回歸曲線Fig.2 Regression curve of serum SOD activity and temperature
2.2.2 水溫脅迫對水解酶ACP、AKP活力的影響
實驗結果表明(圖3),在溫度脅迫下,血清AKP活性隨著溫度的不斷升高呈現出先升后降的變化,其中以4℃條件下花 血清AKP活性最低,與8℃組魚血清AKP活性無顯著性差異(P>0.05),但與其他各組差異顯著(P>0.05);而以24℃條件下花 血清AKP活性最高,與4℃、8℃、12℃、32 ℃各組魚血清 AKP 活性差異顯著性,(P>0.05),但與其他各組無顯著性差異,(P>0.05);采用二次回歸曲線擬合,其變化趨勢如圖4,呈現為拋物線規律,其擬合二元方程為AKP=28.817+3.999 T-0.083 T(2P<0.001)。
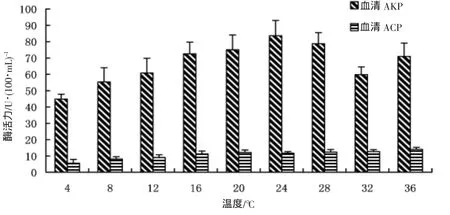
圖3 水溫脅迫對血清水解酶活力的影響Fig.3 The effect of temperature on the activity of the serum hydrolytic enzymes
花 血清ACP活性隨水溫升高呈現出明顯的上升趨勢,隨著水溫的升高,ACP活性顯著上升,其中以4℃條件下花 血清ACP活性最低,與8℃組魚血清ACP活性無顯著性差異(P>0.05),但與其他各組差異顯著(P>0.05);而以36℃條件下花 血清ACP活性最高,與20℃、24℃、28℃、32℃各組魚血清 AKP活性無顯著性差異(P>0.05),但與其他各組差異顯著(P>0.05);根據回歸統計ACP活性與水溫間有顯著的直線回歸關系,其回歸曲線圖如圖5所示,回歸方程為 ACP=6.190+0.229 T(P<0.001)。
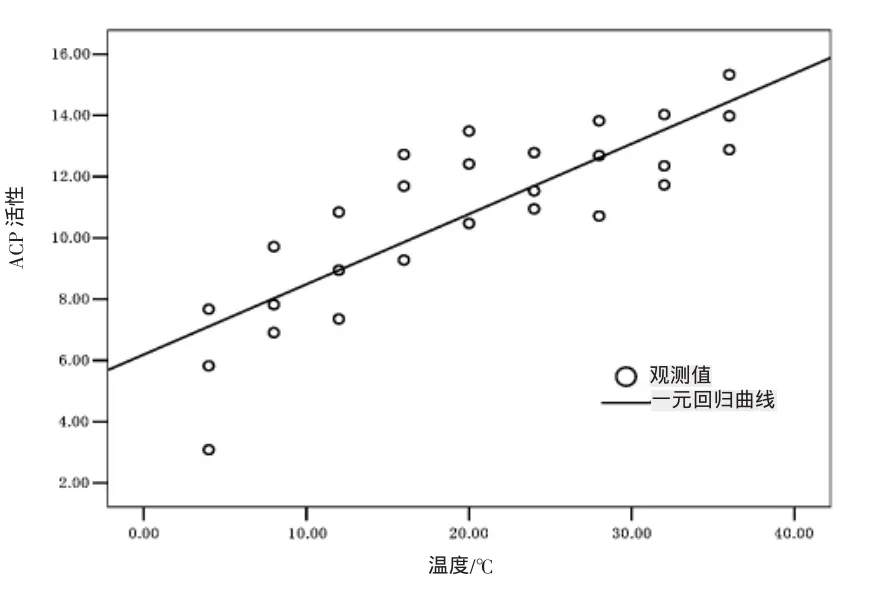
圖5 血清ACP活性與水溫的一元擬合回歸曲線Fig.5 Regression curve of serum ACP activity and temperature
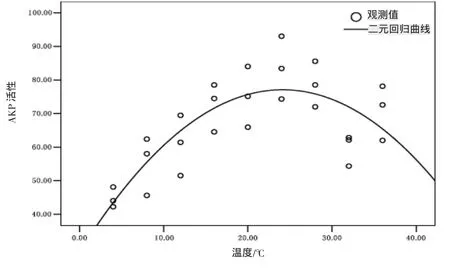
圖4 血清AKP活性與水溫的二元擬合回歸曲線Fig.4 Regression curve of serum AKP activity and temperature
3 討論
有關研究發現,華鯪Sinilabeo rendahli幼魚的生存溫度為5~38℃,適宜溫度為13~29 ℃[1],嘉庚蛸 Octopus tankaheei的生存溫度為 0.5~35 ℃,適宜溫度為 12~31 ℃[2],莫桑比克鰻鱺Anguillamor morata的生存溫度為0~40℃,適宜溫度為12~35℃[3],齊口裂腹魚幼魚Schizothorax(schizothorax)prenanti的生存溫度為 0.8~33.5 ℃,適宜溫度為 5~27℃[4],花 溫度的生存溫度為4~32℃,適宜溫度為8~24℃,與其它水生動物相比,花 的生存溫度和適宜溫度也是比較廣的,對溫度的耐受性稍微低于莫桑比克鰻鱺[5]等。
超氧化物歧化酶(SOD)和過氧化氫酶(CAT)是機體抗氧化系統中最主要的兩種抗氧化酶,在抗氧化過程中具有協同作用,當呼吸爆發產生大量的超氧陰離子(O2-)和H2O2等自由基后,O2-由SOD清除,CAT則起協同清除H2O2的作用[6]。實驗結果表明(圖1、2),水溫脅迫對抗氧化酶活力的影響是顯著的,在不同溫度脅迫下,花 血清SOD活力的變化在24℃以前SOD活性增強尤為顯著(P<0.05)。SOD被認為是機體對抗自然水溫暴露的保護劑[11],隨著水溫升高,SOD活性不斷增強,說明SOD在高溫條件下對機體內由于溫度升高而產生的氧化應激,消除過多的自由基從而維持機體代謝平衡。CAT活力在各溫度組間未表現出顯著差異,溫度的變化對CAT活性影響不明顯,推測可能由于溫度升高所造成的氧化應激多數以O2-等自由基離子為主,而H2O2相對較少。
AKP和ACP是體內最重要的兩種水解酶,廣泛存在于動物血液和各種器官內,是評價動物生理代謝水平的一項重要指標[7,8]。花 是常年生活在水中的變溫脊椎動物,水溫的變化可顯著影響其生理代謝水平。花 的適宜溫度為8~24℃,當水溫超過36℃時會造成一些個體的熱死亡,實驗設計中的幾組高溫實驗組必然對花 造成了一種熱應激,從而使其代謝水平下降,表現為水解酶AKP和ACP活性的降低。本實驗表明,水溫脅迫對花 水解酶活力的影響是顯著的,高溫和低溫都會使水解酶活力顯著降低,這可能是由于在水溫脅迫下,細胞生理代謝效率降低,從而導致在細胞中的ACP和AKP酶活力下降。
溫度是池塘養殖花 最重要的環境因子之一,它直接影響花 的代謝和免疫等生化指標,突然的環境變化包括臺風和池塘通風條件等,都會導致水溫的迅速變化。因此在花 養殖過程中應特別注意這些因素的影響,盡量保持養殖水溫在適宜范圍內。
[1]吳 青,羅 海,雷明平,等.華鯪幼魚幾種養殖相關生物學參數的測定[J].水利漁業,2005,25(5):45-47.
[2]焦海峰,尤仲杰,竺俊全,等.嘉庚蛸對溫度、鹽度的耐受性試驗[J].水產科學,2004,23(9):7-10.
[3]何 英,袁重桂,阮成旭,等.莫桑比克鰻鱺對溫度、鹽度和pH的耐受性試驗[J].水產科學,2009,28(4):222-224.
[4]吳 青,蔡禮明,陸建平,等.齊口裂腹魚幼魚對水溫和溶解氧的耐受力研究[J].四川畜牧獸醫學院學報,2001,15(3):20-22.
[5]WINSTON G W,DI GIULIO R T.Prooxidant and antioxidant mechanism in aquatic organism[J].Aquat Toxicol,1991,19:137-161.
[6]FILHO D W,GIULIVI C,BOVERIS A.Antioxidant defences in marin fish-L Teleosts[J].Comp Biochem Physiol,1993,106C:409-413.
[7]MUTA T,IWANAGA S.The role of hemolymph coagulation in innate immunity[J].Curr Opin Immunol,1996,8(1):7-41.
[8]YUKIO Y,EIZO N.Comparative studies on particulate acid phosphatases in sea urchin eggs[J].Comp Bio-chem Biophys,1982,71B:563-567.

