牛磺酸對Hhcy動脈粥樣硬化家兔血脂、NO和TXB2的影響
張冬 李永格 孟運蓮
動脈粥樣硬化(atheroscleros AS)是多因素參與,以內皮損傷或功能障礙、單核細胞與內皮黏附并侵入內膜轉化為巨噬細胞,中膜SMC遷移至內膜并大量增殖,脂質沉積,泡沫細胞形成,細胞外基質聚集為主要特征的病變。發病病因很多,近年來大量研究表明,HHcy是造成AS的獨立的危險因素,在心、腦血管疾病及外周血管硬化等疾病發病機制中起重要作用[1,2]。目前,對 AS的防治,雖然有許多方法,但多數還不夠理想。采用牛磺酸治療AS已取得了肯定的臨床療效,但作用機制不清。本研究采用Hhcy致AS模型家兔,觀察牛磺酸對其血脂,血清TXB2、NO的影響,探討其可能的作用機制。
1 材料與方法
1.1 藥品與試劑 L-蛋氨酸購自張家港市華昌藥業有限公司,牛磺酸購自上海伯奧生物科技公司。Hcy試劑盒由北京九強生物技術有限公司提供,TC、TG試劑盒購自南京建成公司,NO、TXB2購自上海天呈科技有限公司。
1.2 主要儀器 TOSHIBA生產TBA-120FR生化分析儀,Bio-rad680酶標儀。
1.3 動物模型的建立與分組 篩選健康雄性家兔30只(由南陽醫學高等專科學校動物中心提供),月齡3~5個月,體重在1.5~2.0 kg,以標準飼料適應性喂養一周后,隨機分為3組,每組10只。對照組(NC,喂標準飼料)、蛋氨酸組(Met,喂蛋氨酸飼料:即標飼+2%蛋氨酸制成)、牛磺酸組(Tau,蛋氨酸飼料+牛磺酸0.3 g/(kg·d)灌服),對照組和蛋氨酸組給予等量生理鹽水灌胃。各組動物飼料按100 g/d·只計算,分籠飼養,自由飲水,隔周稱重,調整給藥量,連續喂飼8周。
1.4 生化指標檢測 自兔耳緣靜脈采血2 ml,離心10 min,用循環酶法檢測血漿Hcy含量,比色法測定TG、TC含量,NO硝酸還原酶法測定,TXB2酶免法測定。
2 結果
2.1 各組家兔Hcy的含量 8周后測定各組血清Hcy含量,超過20umol/l[3]確定為Hhcy。具體結果為空白組(19.09±1.20)umol/L,模型組為(65.23 ±1.12)umol/L,牛磺酸治療組為(58.27±2.25)umol/L,模型制作成功。模型組與牛磺酸治療組配對比較P>0.05,沒有明顯差異,表明牛磺酸對血清Hcy沒有明顯影響。
2.2 各組家兔血脂、NO的含量變化 見表1。
2.3 各組家兔TXB2含量 正常組TXB2含量為(134.50±29.17)ng/L,模型組為(345.33±35.27)ng/L,牛磺酸組為(162.37±32.90)ng/L。模型組與正常組比較,P<0.01有明顯差異,說明模型組TXB2含量明顯升高;牛磺酸治療組與模型組比較,P<0.01也有明顯差異,說明牛磺酸有明顯降低TXB2的作用。
表1 各組家兔血脂、NO的含量變化(±s)
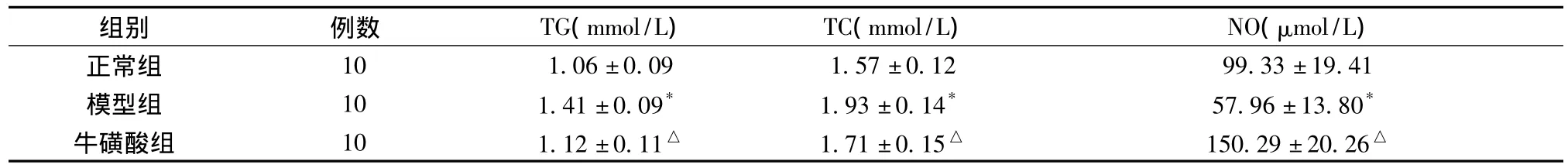
表1 各組家兔血脂、NO的含量變化(±s)
與正常組比較*P<0.05,**P<0.01;與模型組比較△P<0.05,△△P<0.01
組別 例數 TG(mmol/L) TC(mmol/L) NO(μmol/L)10 1.06±0.09 1.57±0.12 99.33±19.41模型組 10 1.41±0.09* 1.93±0.14* 57.96±13.80*牛磺酸組 10 1.12±0.11△ 1.71±0.15△ 150.29±20.26正常組△
3 討論
牛磺酸是(Taurine,a-氯基乙磺酸))是細胞內含量最豐富的自由氯基酸,不參與蛋白質的合成,長期被看作是含硫氨基酸代謝的無功能產物。近年研究發現[4],牛磺酸具有維持滲透壓、穩定細胞膜、調節細胞鈣穩定、清除自由基、抑制脂質過氧化等生物學效應。HHcy還可導致大鼠血管內皮細胞結構受損,彈力纖維層排列紊亂、血漿ET含量增加,外源性增補牛磺酸完全抑制了Hcy誘導的上述血管病變[5]。
本研究Tau組家兔血清TXB2含量顯著低于Met組,NO含量明顯升高,而Hcy含量顯著高于NC組但與Met組比較無顯著差異。結果顯示,牛磺酸不僅抑制Hcy誘導的呼吸鏈電子漏出及氧自由基生成[6]和脂質過氧化,拮抗Hcy引起的氧化應激損傷;還可上調NO含量,降低TXB2水平,從而起到舒張血管,保護內皮細胞[7]。牛磺酸作為Hcy的生物拮抗劑,可不通過降低血漿Hcy水平而直接拮抗Hcy引起的血管病變和氧化應激損傷,從而發揮抗AS形成的作用。
綜上所述,高蛋氨酸飲食可誘發家兔Hhcy,Hcy升高可通過損傷血管內皮、促進血管平滑肌增殖等機制,導致AS的發生。牛磺酸通過抑制Hcy誘導的氧化應激和細胞增值,發揮抗AS形成的作用。更重要的是牛磺酸由蛋氨酸代謝產生,是Hcy的生物拮抗劑,利用這一內源性拮抗Hcy血管損傷保護劑,可能是防治Hhcy所致心、腦血管疾病的新策略。
[1]Anderson JL,Muhlestein JB,Home BD,et al.Plasma homocysteine predicts mortality independently of traditional risk factors and C-reactive protein in patients with angio-graphically defined coronary artery disease.Circulation,2000,102:1227-1232.
[2]Gareia-Pinilla JM,Espinosa-Caliani S,Jim6nez-Navarro M ,et al.Influence of 677 C-T polymorphism of methylenetetrahydrofolate reductase on medium-term prognosis after acute coronary syndromes.Tex Heart Inst J,2007,34(2):142-147.
[3]Malinow MR,Bostom AG,Krauss RM.Homocyst(e)ine Diet and cardiova-sculardiseases.A statement for health care profession from the Nutrition Committee,American Heart Association.Circution,1999,99:178-182.
[4]石彥榮,唐朝樞.牛磺酸的跨膜細胞轉運.國外醫學﹒生理.病理科學與臨床分冊,2001,61:453-456.
[5]Chang L,Xu J,Yu F,et al Tauring protected myocardial m itiochondria in jury induced by hyperhom ocysteinem ia in rats.Amino A cids,2004,27:37-48.
[6]常林,趙晶,徐建興,等.牛磺酸抗同型半胱氨酸誘導的線粒體呼吸鏈自由基生成和同型半胱氨酸抑制線粒體牛磺酸轉運體.中國病理生理雜志,2004,20:1126-1133.
[7]杜景民,卞金陵.牛磺酸對動脈硬化大鼠NO,AngⅡ含量和ACE活性的影響.中國老年學雜志,2006,26(2):235-237.

