催產素預處理對胎鼠海馬腦片缺氧無糖損傷后OTR、GABAARβ1表達的影響
陸廷鳳,于紅
(1.東南大學醫學院,江蘇南京 210009;2.東南大學附屬中大醫院 婦產科,江蘇南京 210009)
新生兒缺氧缺血性腦病(hypoxic-ischemic encephalopathy,HIE)是圍產期缺氧、窒息導致腦的缺氧缺血性損害,臨床出現一系列中樞神經系統異常表現的疾病,是引起新生兒死亡的主要原因之一,也是引起嬰幼兒神經系統后遺癥狀的重要原因。各家報道HIE的死亡率和致殘率仍為10%~30%。范曉梅[1]在對12 000名活產兒進行調查中發現,HIE的發病率為1%,其中以胎兒窘迫為主要病因,占HIE發病的91.7%。大腦被剝奪氧和葡萄糖后可引起神經元損傷和死亡,當神經和神經膠質細胞處在發育時期,這種損傷就更為嚴重[2]。催產素(oxytocin,OT)是一種古老的內分泌激素,早期對OT的研究多側重于其在分娩發動、乳汁分泌等方面的作用,近年來學者逐漸重視OT與神經精神系統發育的相關性研究。本實驗室曾報道OT對孕晚期胎鼠海馬缺氧無糖損傷(oxygen and glucose deprivation,OGD)有神經保護作用,其機制可能與γ-氨基丁酸(GABA)有關[3]。現進一步圍繞OT對OGD胎鼠海馬催產素受體(oxytocin receptor,OTR)、γ-氨基丁酸 A 受體 β1 亞基(gamma-amimobutyric acid receptor A β1 subunit,GABAAR β1)表達的影響,探討OT在胎兒神經保護方面的作用機制。
1 材料與方法
1.1 動物及材料
1.1.1 實驗動物 孕齡20 d SD大鼠4只,體重500~800 g,由南京市江寧區青龍山動物繁殖場提供。
1.1.2 試劑及器材 人工腦脊液(artificial cerebrospinal fluid,ACSF)成分(mmol·L-1)[4]:葡萄糖 10.0、NaCl 120.0、KCl 3.33、NaH2PO41.25、MgSO42.4、NaHCO326.0、CaCl22.5;通入 95%O2+5%CO2混合氣體至少30 min達到飽和,流量約為200 ml·min-1,HCl調至 pH 7.35 ~7.45。缺氧無糖人工腦脊液(artificial cerebrospinal fluid/oxygen and glucose deprivation,ACSF/OGD):將混合氣體95%O2+5%CO2換為95%N2+5%CO2,并且將ACSF中的葡萄糖換為同濃度的蔗糖。OT(上海第一生化藥業),OTR兔抗大鼠多克隆抗體(武漢博士德),GABAAR β1兔抗大鼠多克隆抗體(Bioworld公司);SP免疫組化試劑盒(北京四正柏生物公司);數顯恒流泵(上海滬西分析儀器廠);混合氣體95%O2+5%CO2、95%N2+5%CO2(南京特種氣體)。
1.2 方法
1.2.1 離體海馬腦片制備 孕鼠乙醚吸入麻醉,2%碘酒及75%乙醇消毒腹部剖腹取出胚胎,剝除胎盤完全暴露胎鼠,斷頭取腦后置于0~4℃ACSF中降溫1 min。用刀片冠狀面切割全腦制作1~2 mm腦片,保留包含海馬的腦片,共得包括海馬區腦片40片。將腦片轉移至溫度為(32.0±0.5)℃的ACSF中,不斷通入95%O2+5%CO2混合氣體,流量為 200 ml·min-1,孵育2~3 h備用。
1.2.2 實驗分組和給藥方法 實驗用海馬腦片共40片,對照組和實驗組各20片。對照組用正常ACSF孵育2 h,待其充分作用后通入 ACSF/OGD,行OGD 15 min。實驗組則將正常 ACSF換成含10-6mmol·L-1OT的ACSF孵育,余同對照組。
1.2.3 評價
1.2.3.1 蘇木素-伊紅染色 海馬腦片經4%甲醛固定后,24 h內常規石蠟包埋切片,蘇木素-伊紅染色制片。切片光學顯微鏡40×10倍視野下觀察海馬組織CA1區神經元排列、細胞形態變化及細胞核情況。
1.2.3.2 SP免疫組化法半定量檢測海馬腦片CA1區OTR、GABAAR β1表達 具體操作按照試劑盒說明書。SP法即鏈霉素抗生素蛋白-過氧化物酶連接法。石蠟切片依次經過二甲苯脫蠟、抗原修復后,行一抗+生物素標記二抗+辣根酶標記鏈酶卵白素+辣根酶底物DAB顯色。免疫組化染色陽性反應為細胞膜呈黃棕色。每張切片光鏡20×10倍下定位海馬CA1區,然后40×10倍下用Image-Pro Plus 6.0圖像分析軟件測量CA1區陽性細胞的平均光密度值,分析OTR、GABAAR β1 的表達。
1.2.3.3 透射電鏡觀察 每組胎鼠各取2只,斷頭后立即取大鼠左側海馬組織2 mm×2 mm×5 mm,固定于3%戊二醛,1%鋨酸雙固定,Epon812樹脂包埋,超薄切片機切片,醋酸雙氧鈾-檸檬酸鉛雙重染色,透射電子顯微鏡觀察。電鏡下觀察神經元、膠質細胞等超微結構改變。
1.3 統計學處理
用SPSS 11.5統計軟件包進行統計學分析。實驗數據以均數±標準差表示,采用組間t檢驗及方差分析作統計學顯著性檢驗。
2 結 果
2.1 蘇木素-伊紅染色結果比較
光學顯微鏡下,細胞核呈深藍色,胞漿呈淡紅色。實驗組腦片中可見海馬CA1區錐體細胞呈多層排列,結構清晰,細胞排列較整齊緊密、分布亦較均勻,神經細胞數目多、外形規則,細胞層可分3~5層,胞核圓形或橢圓形,染色較淡,染色質均勻,偶見核深染或固縮,核膜邊界清晰,核仁圓且明顯。對照組腦片中可見海馬CA1區神經細胞層次變少,數量減少,排列紊亂、稀疏。部分神經細胞核深染、固縮,核仁不明顯,細胞周圍間隙增大。見圖1、2。
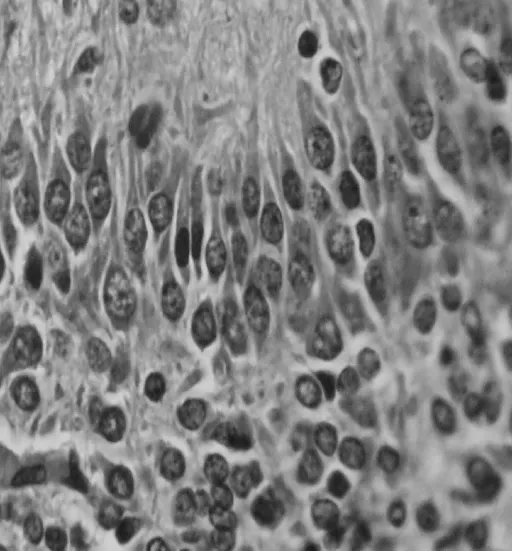
圖1 對照組錐體細胞形態 HE×400Fig 1 Morphology of cell in control group by HE staining×400
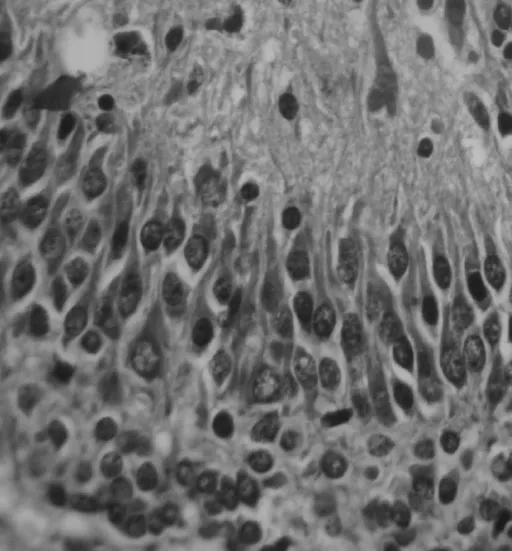
圖2 實驗組錐體細胞形態 HE×400Fig 2 Morphology of cell in experimental group by HE staining ×400
2.2 免疫組織化學染色結果比較
2.2.1 OT對胎鼠海馬腦片CA1區OTR表達的影響 實驗組與對照組胎鼠海馬腦片CA1區OTR免疫組織化學染色均有陽性反應,分別行平均光密度值測定,實驗組OTR表達的平均光密度值為(0.172±0.017),與對照組(0.152 ±0.024)比較顯著升高(P=0.048 <0.05),差異有統計學意義,見表1。

表1 海馬腦片CA1區OTR表達平均光密度值比較Tab 1 Comparison of integrated option density of OTR expression in CA1 areas of hippocampus
2.2.2 OT 對胎鼠海馬腦片 CA1 區 GABAAR β1 表達的影響 實驗組與對照組胎鼠海馬腦片CA1區GABAAR β1免疫組織化學染色均有陽性反應,分別行平均光密度值測定,實驗組GABAARβ1表達的平均光密度值為(0.142 ±0.018),與對照組(0.124 ±0.020)比較顯著升高(P=0.036 <0.05),差異有統計學意義,見表2。
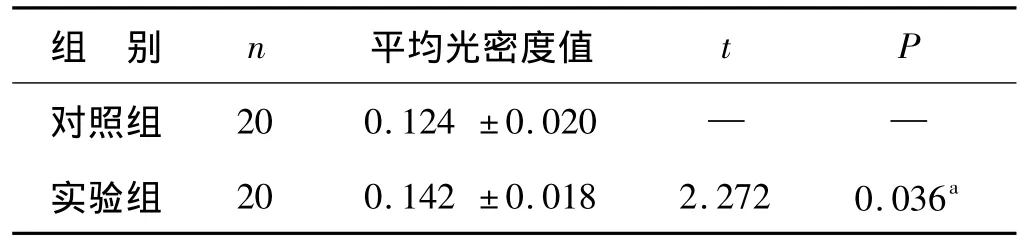
表2 海馬腦片CA1區GABAAR β1表達平均光密度值比較Tab 2 Comparison of integrated option density of GABAAR β1 expression in CA1 areas of hippocampus
2.3 電鏡觀察海馬神經細胞的損傷情況
對照組大量神經元受損、變性、壞死,核固縮或碎裂,部分核膜溶解,染色質呈團塊狀凝集,核仁碎裂,胞質內細胞器明顯減少導致電子密度變低。其中細胞核超微結構改變見圖3。
實驗組細胞核、粗面內質網、線粒體均較對照組有所改善,核膜較光滑,染色質細小而分散,胞漿腫脹較對照組減輕,可見較多的細胞器。亦可見核膜皺褶內陷,核固縮,染色質凝集、邊集等凋亡現象。其中細胞核超微結構改變見圖4。
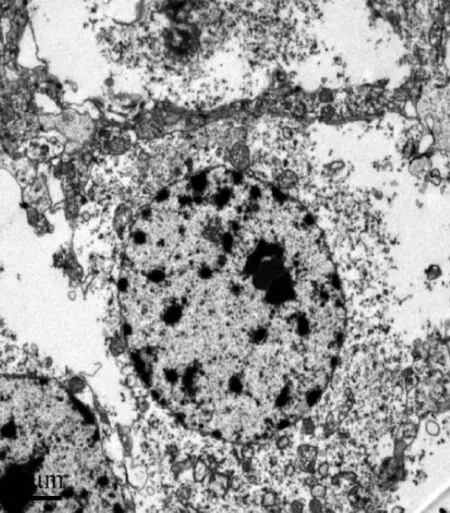
圖3 對照組海馬細胞電鏡下超微結構Fig 3 Ultralstructure of hippocampal cells in control group by transmission electron microscopy
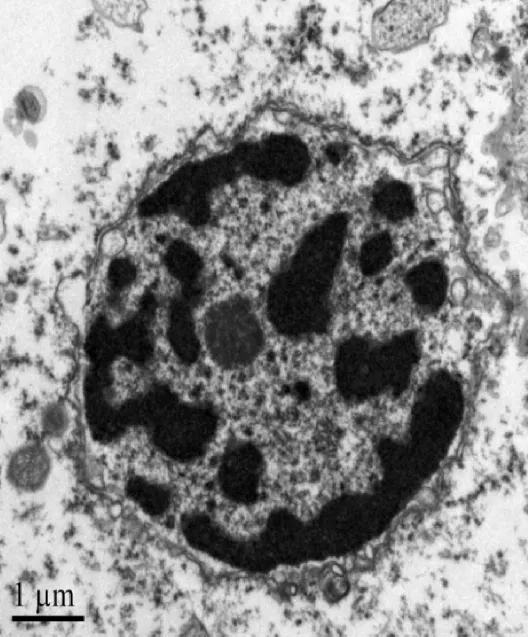
圖4 實驗組海馬細胞電鏡下超微結構Fig 4 Ultralstructure of hippocampal cells in experimental group by transmission electron microscopy
3 討 論
胚胎中晚期及出生早期是海馬神經元發育成熟的關鍵時期,海馬結構中錐體細胞的產生、遷移、定位等均于胚胎時期完成。由于中樞神經系統對氧具有高敏感性,發育中的神經元對氧的需求較高。分娩過程對胎腦來說是具有高損傷風險的應激性事件,而這種應激主要來自產前、產時宮縮形成的相對缺氧狀態。因此,離體狀態下研究OT對孕晚期胎鼠海馬OGD是否有神經保護作用及作用機制具有重要意義。
3.1 OT及OTR系統
OT為9個氨基酸組成的多肽,在哺乳、分娩、應激等刺激下釋放入血液循環。OTR是經典G蛋白偶聯受體,當OT與OTR胞外區結合后,活化胞內區Gq亞單位后激活磷脂酶C-β進而產生一系列的生理功能[5]。本實驗中經OT預處理的胎鼠海馬腦片經OGD后,CA1區OTR較對照組顯著升高,上調了OTR在細胞膜上的表達。
3.2 GABA及GABAR系統
在成熟的大腦中GABA是重要的抑制性神經遞質,GABA 通過與其受體(gamma-aminobutyric acid receptor,GABAR)結合而發揮作用。GABAAR在神經系統廣泛分布,主要介導突觸后抑制效應,其中β1亞基是受體主要激活位點。在未成熟神經元,GABA是主要的興奮性神經遞質,對胎兒期和新生兒期神經元發育至關重要。當GABA與GABAAR結合,配體門控氯離子通道開放,神經元胞膜對Cl-通透性增加,Cl-流出神經元,神經元產生去極化效應,激活電壓依賴性Ca2+通道,從而使細胞內Ca2+濃度升高,對神經元的生長和分化發揮重要作用[6]。研究發現分娩時主要來源于母體下丘腦的OT通過胎盤屏障和胎兒血腦屏障到達胎兒大腦[7],通過降低氯離子內向協同轉運體(Na+-K+-2Cl-cotransporter 1,NKCC1)的活性以減少Cl-的內源性轉運,使得神經元內 Cl-濃度下降[8]。本實驗中經OT預處理的胎鼠海馬腦片經OGD后,CA1區GABAAR β1較對照組顯著升高,上調了GABAARβ1在細胞膜上的表達。當GABA作用于GABAAR時,配體門控Cl-通道開放增加,Cl-順濃度差內流增加,GABA效應由興奮性向抑制性轉化。
3.3 OT 與 OTR、GABAAR β1 關系
缺血缺氧可直接導致海馬細胞損傷、能量衰竭。腦血流和氧運輸的減少啟動潛在有害生化級聯反應,包括葡萄糖氧化磷酸化中斷,細胞內ATP迅速耗竭,乳酸堆積、細胞膜去極化、興奮性氨基酸釋放以及細胞內Na+、Ca2+、水、自由基堆積,從而導致細胞毒性水腫和細胞死亡。本實驗海馬腦片石蠟切片HE染色、電鏡結果均提示,實驗組細胞的變性壞死明顯減少,OT對海馬神經元起保護作用。
本實驗研究結果顯示,經OT預處理的胎鼠海馬腦片 OGD后與對照組比較,OT顯著上調 OTR、GABAAR β1表達。OT可能通過一系列的下游機制抑制NKCC1活性,降低神經元內Cl-濃度,Cl-順濃度差內流增加,當GABA與GABAAR結合時,配體門控Cl-通道開放增加,GABA效應由興奮性向抑制性轉化,導致神經元去極化抑制,減少神經元的耗氧量,從而增強大腦耐受缺氧損傷的能力,減輕分娩中缺氧和低血糖等傷害事件對胎兒大腦的損傷,實現對胎兒神經系統的保護作用。
[1]范曉梅.120例新生兒缺血缺氧性腦病的發病情況與臨床分析[J].中國婦幼保健,2008,23(14):3496-3697.
[2]SCADUDI J,GALLO V.New concepts in perinatal hypoxia ischemic encephalopathy[J].Curr Neurol Neurosci Rep,2008,8(2):130-138.
[3]陳麗,于紅,任慕蘭.催產素對孕晚期胎鼠神經保護作用的研究[J].中國婦幼健康研究,2009,20(3):248-251.
[4]PUGLIESE A M,COPPI E,VOLPINI R,et al.Role of adenosine A3 receptor on CA1 hippocampal neurotransmission during oxygen-glucose deprivation of different duration[J].Biochem Phamacol,2007,74(5):768-779.
[5]GIMPL G,FAHRENHOLZ F.The oxytocin receptor system:structure,function,and regulation[J].Physiol Rev,2001,81:629-683.
[6]王堯,杜子威.神經生物化學與分子生物學[M].北京:人民衛生出版社,1996:189-191.
[7]WAHL R U.Could oxytocin administration during labor contribute to autism and related behavioral disorders?–A look at the literature[J].Med Hypotheses,2004,63(3):456-460.
[8]TYZIO R,COSSART R,KHALILOV I,et al.Maternal oxytocin triggers a transient inhibitory switch in GABA signaling in the fetal brain during delivery[J].Science,2006,314(5806):1788-1792.

