體外DCs在抗CD45RB抗體誘導免疫耐受中的作用機制①
劉金鵬 鄧春艷 齊 暉 李富榮 (暨南大學第二臨床醫學院深圳市人民醫院臨研中心,深圳518020)
體外DCs在抗CD45RB抗體誘導免疫耐受中的作用機制①
劉金鵬 鄧春艷 齊 暉 李富榮 (暨南大學第二臨床醫學院深圳市人民醫院臨研中心,深圳518020)
目的:探討樹突狀細胞(dendritic cells,DCs)在抗CD45RB抗體誘導的免疫耐受中所發揮的作用,從而闡明抗CD45RB抗體誘導免疫耐受的機制。方法:采用DCs的常規誘導方法(rmG M-CSF、IL-4和LPS),在誘導過程中加入不同劑量的抗CD45RB抗體,成熟后利用流式細胞儀檢測細胞表型、周期和吞噬能力,ELISA法檢測IL-12分泌量,混合淋巴細胞培養檢測DCs對T細胞增殖能力的影響。結果:DCs經抗CD45RB抗體處理后,CD11C和CD83表達升高,CD86表達下降,自身增殖和吞噬能力增強,但分泌IL-12和刺激T細胞增殖的能力明顯下降。結論:耐受性樹突狀細胞(tolerogenic dendritic cells,tDCs)能顯著抑制T細胞的增殖,它的產生是抗CD45RB抗體誘導免疫耐受的主要機制之一。
抗CD45RB抗體;樹突狀細胞;免疫耐受
目前已有大量實驗證明,抗CD45RB抗體能夠在同種異體移植模型中誘導移植物長期存活,并在受體體內形成特異性的免疫耐受[1-3],Deng等[4]還發現抗CD45RB抗體誘導的耐受狀態有其特殊性,它需要受體B淋巴細胞和完整的胸腺,胸腺來源的調節性T細胞將耐受從胸腺轉向外周,而DCs在T細胞和B細胞的發育、分化中,以及記憶T細胞和B細胞的形成和維持中發揮著重要的作用,那么抗CD45RB抗體誘導的免疫耐受體系中DCs有何作用,目前還沒有相關報道。本實驗就DCs在抗CD45RB抗體誘導的免疫耐受中如何發揮作用,利用在骨髓細胞來源DCs的分化中加入不同劑量的抗CD45RB抗體,觀察抗CD45RB抗體對BMC來源mDCs在形態、表型、細胞周期、吞噬能力以及分泌IL-12能力上的變化,再通過混合淋巴細胞培養體系模擬同種異體移植排斥反應來分析mDCs的免疫學功能,以闡明DCs在抗CD45RB抗體誘導免疫耐受中的作用,為抗CD45RB抗體的臨床應用奠定基礎。
1 材料與方法
1.1 實驗動物 6~8周雌性C57BL/6小鼠購自南方醫科大學,6~8周雄性BALB/c小鼠購于廣東省實驗動物中心,均飼養在SPF級動物實驗室(暨南大學第二臨床醫學院實驗動物中心)。
1.2 DCs的誘導 無菌提取C57BL/6小鼠的股骨和脛骨,用RPMI1640培養基(Thermo,America)沖出髓腔內的骨髓細胞,然后用淋巴細胞分離液分離出單核細胞,加入完全培養基(含10%fetal calf serum, rmG M-CSF和IL-4各10 ng/ml,PeproTech,USA),細胞濃度為1×106個/ml,37℃,5%CO2培養2天后棄懸浮細胞,加完全培養基繼續培養;第4天半量換液,加刺激劑LPS 1μg/ml(Sigma,USA),第6天收獲mDCs為對照組;在完全培養基里分別添加不同劑量的抗CD45RB抗體(5、10、20和40μg/ml,克隆號: Cat.#BE0019,BioXcell,Lebanon)收獲的mDCs為實驗組。
1.3 mDCs表型的檢測 收獲各組mDCs,將其濃度調整為1×106個/ml,分別取100μl細胞懸液,加入FITC(Fluorescein isothiocyanate)-CD11C和 FITC-I-Ab (BD Pharmingen,America),PE(phycoerythrin)-CD83和PE-CD86(eBioscience,USA)及相應的 Isotype,37℃避光孵育15~20分鐘,流式細胞儀(Epics ALTRA型, American)檢測其細胞表型。
1.4 mDCs細胞周期檢測 將各組mDCs細胞懸液移入離心管,1 200 r/min離心5分鐘,棄上清,用PBS洗滌細胞兩遍,然后用70%乙醇固定細胞,4℃過夜;用PBS洗滌2次后用0.4 ml PBS重懸,加入RNase-A 20μl(1mg/ml,G ibco,America)37℃作用30分鐘,再加入碘化丙啶 50μl(0.5 mg/ml,Sigma, America)中,避光冰浴30分鐘后,流式細胞儀檢測以multicycle analysis軟件分析。
1.5 mDCs吞噬抗原能力的檢測 將各組mDCs用含10%FBS的RPMI1640培養基重懸,取5×105個細胞,加入FITC-Dextran至終濃度1 mg/ml(Molecular Probs,America),混勻后分為兩管,一管置于4℃作為空白對照,另一管置于37℃檢測內吞能力,孵育2小時后用冰PBS液洗滌2次,流式細胞儀進行分析,以平均熒光強度(mean fluorescence intensity,MFI)表示DCs攝取Dextran的能力。DCs內吞量=DCs內吞平均熒光強度-DCs對照平均熒光強度。
1.6 mDCs分泌IL-12的檢測 取各組mDCs的培養上清液,小鼠IL-12 ELISA試劑盒(Biosource,American)檢測分泌IL-12的含量。
1.7 DCs和T細胞的分選 將各組mDCs和BALB/c小鼠的脾臟制成單細胞懸液,用全DC細胞磁珠和T細胞免疫磁珠(Miltenyi Biotec,Germany)分選DCs和T淋巴細胞,用流式細胞儀檢測其純度。
1.8 混合淋巴細胞反應(MRL) mDCs經絲裂霉素處理后作為刺激細胞,按4×104個/孔加入96孔板,再加入提取的T細胞(2×105個/孔)作為反應細胞,對照組則只加入BALB/c小鼠T細胞(2×105個/孔),然后補加10%FBS的RPMI1640至每孔終體積200μl,37℃、5%CO2培養箱培養3天,然后用CCK-8 ELISA試劑盒(DojinDo,Japan)檢測各組的吸光度(OD值)。每組均設3個復孔。
1.9 統計學處理 全部數據采用SPSS13.0統計軟件進行統計學分析,所有結果以 x—±s表示,采用方差分析或 t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 DCs形態學觀察 培養至第2天,細胞開始分為懸浮和貼壁兩種狀態,聚集成簇,大部分細胞形態規則,少量細胞已有毛刺出現;培養至第4天細胞數量開始增多,懸浮和貼壁細胞的比例為1∶1左右,體積較大且形態不均,大部分細胞已有毛刺樣突起;第6天,細胞的毛刺樣突起更加明顯(圖1),但是鏡下對照組和實驗組的mDCs細胞在形態和數量上無明顯差別。
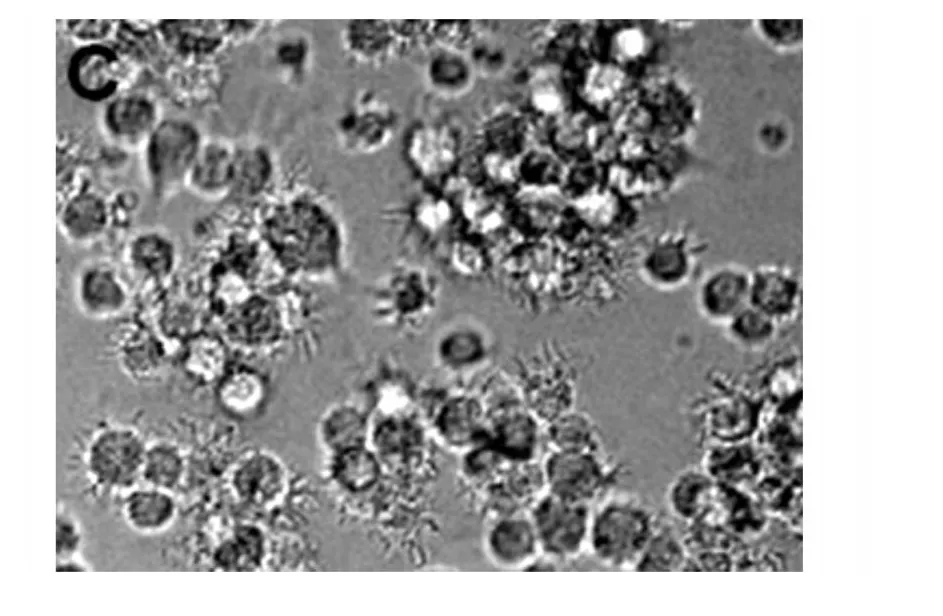
圖1 DCs的毛刺樣突起更為明顯(×200)Fig.1 The dendritic projections were more obviously(×200)
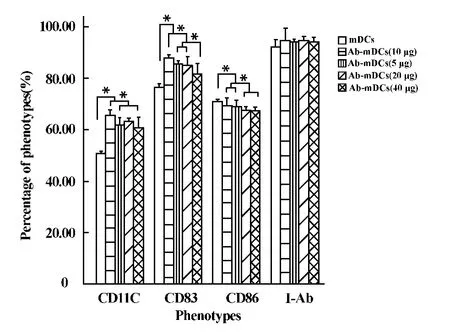
圖2 不同劑量的抗CD45RB抗體對DCs表型的影響Fig.2 Effect of different dosage of anti-CD45RB monoclonal antibody on the phenotype of DCs
2.2 mDCs表型的檢測 檢測mDCs表面的主要表型(CD11C、CD83、CD86和I-Ab),結果如圖2,發現實驗組加入各劑量抗CD45RB抗體的mDCs表面CD11C表達均高于對照組(P<0.05),而10μg/ml劑量組CD11C的表達明顯高于其它各劑量組(P<0.05)。CD83表達結果類似,實驗組明顯高于對照組(P< 0.05),實驗組中的10μg/ml劑量組CD83的表達最高(P<0.05),5μg/ml和20μg/ml劑量組間CD83的表達無差異(P>0.05),但均高于40μg/ml組(P<0.05)。實驗組中CD86的表達要顯著低于對照組 (P<0.05),且實驗組中的20μg/ml和40μg/ml劑量組低于5μg/ml和10μg/ml劑量組(P<0.05)。I-Ab的表達不受加入抗體劑量的影響,實驗組與對照組無差異(P>0.05)。
2.3 mDCs細胞周期檢測 實驗組處于G2-M期的細胞數明顯多于對照組(P<0.01),但是實驗組中的5、10和20μg/ml三個劑量組之間處于G2-M期的細胞數無明顯差異(P>0.05,圖3)。
2.4 mDCs攝取抗原能力的檢測 實驗組中5、10和20 μg/ml三個劑量組的抗原吞噬能力無差異(P>0.05),但與對照組相比,三個劑量組的抗原吞噬能力為對照組的6~8倍(圖4),具有顯著性差異(P<0.01)。
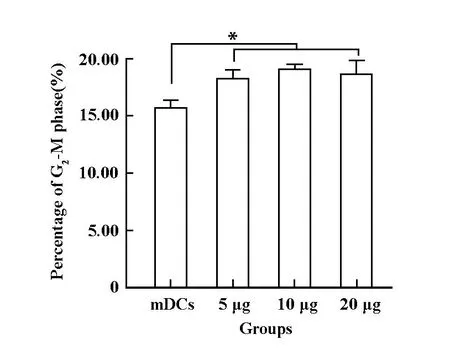
圖3 DCs細胞周期的檢測Fig.3 Determine of cycle of DCs
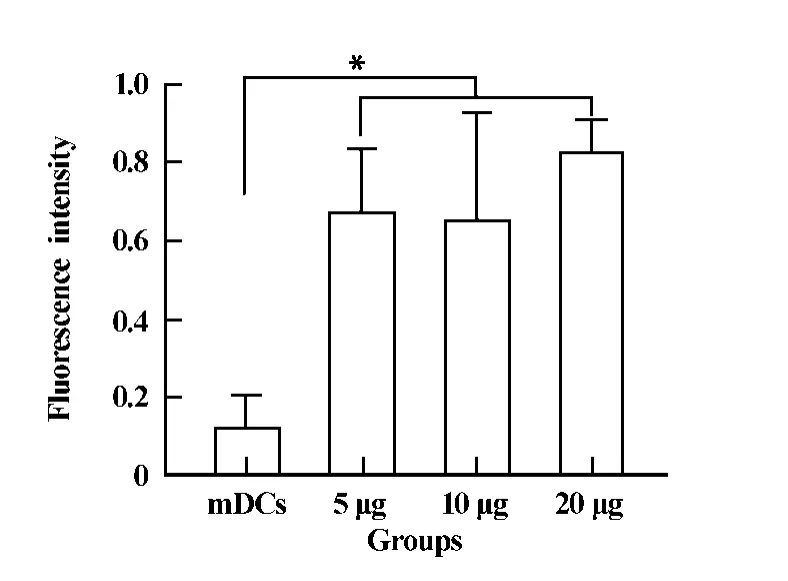
圖4 DCs抗原攝取能力的檢測Fig.4 Determine of phagocytic function of DCs
2.5 mDCs分泌IL-12水平 實驗組IL-12分泌量明顯低于對照組(P<0.01),實驗組中5、10和20μg/ml三個劑量組IL-12的分泌量依次降低,且存在顯著性差異(P<0.01),20μg/ml劑量組的IL-12分泌量只有對照組的1/3(圖5),說明抗體加入量與mDCs分泌IL-12的能力呈明顯的負相關性。
2.6 混合淋巴細胞反應 實驗分為三組:①mDCs+ T;②DCs(10μg)+T;③單獨T細胞組(設零組)。結果如圖6,①組的OD值明顯大于②組(P<0.01),說明經抗CD45RB抗體處理后的DCs具有明顯抑制T增殖的能力。
3 討論
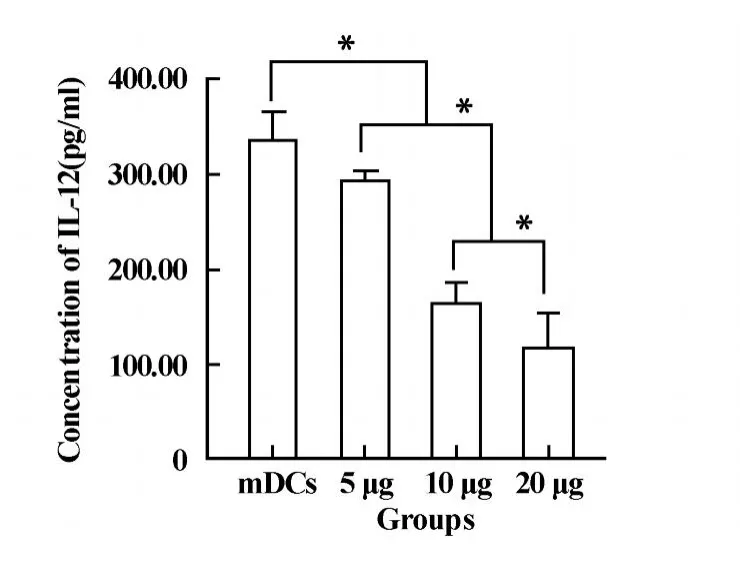
圖5 各組上清液IL-12的含量(pg/ml)Fig.5 IL-12 activity in the supernatant of different groups (pg/ml)
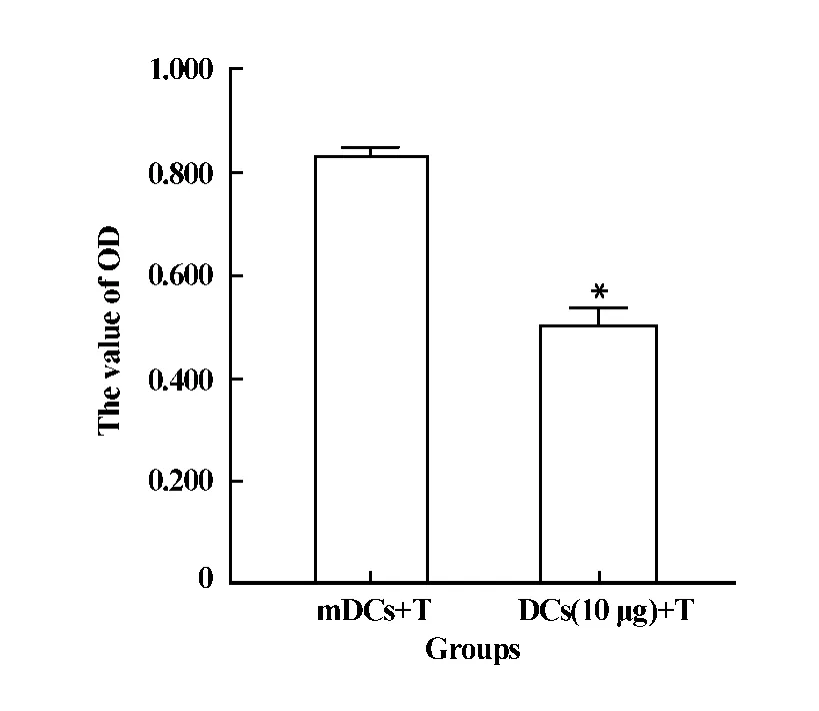
圖6 混合淋巴細胞反應Fig.6 Mixed lymphocyte reaction
以往認為DCs是激活T細胞初始免疫反應的細胞,隨著人們認識逐漸深入,發現DCs參與免疫耐受的誘導,并提出tDCs這一概念。tDCs具有以下幾種特性:①表面缺乏免疫應答所必需的CD40、CD80和CD86等共刺激分子,不能有效遞呈抗原和激活T細胞,導致免疫耐受;②能夠誘導外周T細胞的無能或低能反應,并激活T細胞凋亡;③誘導調節性T細胞(regulator T cell,Treg cell)和Th2細胞的產生,從而引起特異性免疫耐受。而抗CD45RB抗體在體外誘導的免疫耐受可能與tDCs有關。本研究結果發現,經抗CD45RB抗體處理后,mDCs表面共刺激分子CD86的表達下降,而且mDCs的特異性標記CD11C和成熟標記CD83表達升高。CD86的表達下降說明mDCs遞呈抗原和激活 T細胞的能力降低[5]。而CD11C表達升高可能是抗CD45RB抗體增強細胞內物質積累,使更多mDCs進入分裂期。CD83升高說明mDCs可能與胸腺中T細胞和B細胞之間的相互作用得到了加強,因為CD83分子和其分泌的可溶性CD83分子可與胸腺中T細胞和B細胞表面的CD83配體結合,使T細胞和B細胞的發育和分化受到影響[6-9]。一些學者報道CD83表達升高不影響mDCs刺激T細胞增殖能力,但可引起可溶性CD83分子的增多[10,11]。可溶性CD83分子可使T細胞增殖能力受到明顯抑制使其移植物的長期存活[12,13]。由此可見,經抗CD45RB抗體處理后,mDCs不但激活T細胞的能力受到抑制,而且自身數量以及分泌的耐受性可溶性CD83分子增多,將有利于機體免疫耐受的產生。
目前研究認為,DCs之所以能夠導致免疫耐受的發生,還依賴于它本身具有一些未成熟階段的生物學功能,如吞噬抗原能力增強和分泌IL-12能力下降等。對Ab-mDCs的功能經Dextran內吞實驗和IL-12含量測定發現,抗CD45RB抗體能夠使實驗組mDCs的抗原吞噬能力顯著增強,而IL-12分泌能力受到顯著抑制。IL-12作為DCs抗原提呈和活化T細胞過程中最為重要的細胞因子[14],它的減少使初始T細胞更易向Th2細胞轉化,引起IFN-γ分泌減少、IL-10分泌增加,進而誘導T細胞“無反應”和免疫耐受的發生。
IL-4是促使DCs成熟的生長因子,如果在DCs的誘導過程中不添加IL-4,就會誘導出具有免疫耐受性的DCs,它能夠抑制同種異體移植物的排斥,引起免疫耐受的形成。而本實驗中加入了IL-4促使DC成熟,所以誘導的mDCs能夠刺激T淋巴細胞增殖,由于實驗組又添加了抗CD45RB抗體,結果mDCs刺激T淋巴細胞增殖的能力明顯受到抑制,這就說明抗CD45RB抗體可以使mDCs獲得免疫耐受性。
綜上所述,抗CD45RB抗體能夠成功的誘導出一種tDCs,它具有顯著抑制T細胞增殖的能力。但tDCs是否可以引起移植物的長期存活,以及耐受動物體內是否存在這種tDCs,還有待進一步體內實驗的研究證實。
1 Rayat G R,G ill R G.Indefinite survival of neonatal porcine islet xenografts by simultaneous targeting of LFA-1 and CD154 or CD45RB [J].Diabetes,2005;54(2):443-451.
2 Visser L,Poppema S,de Haan Bet al.Prolonged survival of rat islet xenografts in mice after CD45RB monotherapy[J].Transplantation, 2004;77(3):386-391.
3 Zhong T,Liu Y,Jiang Jet al.Long-term limb allograft survival using a short course of anti-CD45RB monoclonal antibody,LF 15-0195,and rapamycinin a mouse model[J].Transplantation,2007;84(12):1636-1643.
4 Deng S P,Moore DJ,Huang XLet al.Cutting edge:transplant tolerance induced by Anti-CD45RB requires B lymphocytes[J].J Immunology, 2007;178(10):6028-6032.
5 Segura E,Nicco C,Lombard Bet al.ICAM-1 on exosomes from mature dendritic cells is critical for efficient naive T-cell priming[J].Blood, 2005;106(1):216-223.
6 Hock B D,Kato M,Mckenzie J Let al.A soluble form of CD83 is released from activated dendritic cells and B lymphocytes,and is detectable in normal human sera[J].Int Immunol,2001;13(7):959-967.
7 Prazma C M,Yazawa N,Fujimoto Yet al.CD83 expression is a sensitive marker of activation requiredfor B cell and CD4+Tcell longevity in vivo [J].J Immunol,2007;179(7):4550-4562.
8 Lechmann M,Shuman N,Wakeham Aet al.The CD83 reporter mouse elucidates the activity of the CD83 promoter in B,T,and dendritic cell populations in vivo[J].PANS,2008;105(33):11887-11892.
9 Fujimoto Y,Tu L,Miller A Set al.CD83 expression influences CD4+T cell development in the thymus[J].Cell,2002;108(6):755-767.
10 Kuwano Y,Prazma C M,Yazawa Net al.CD83 influences cell-surface MHC classⅡexpression on B cells and other antigen-presenting cells [J].Int Immunol,2007;19(8):977-1002.
11 Wolenski M,Cramer S O,Ehrlich Set al.Enhanced activation of CD83-positive T cells[J].Scand J Immunol,2003;58(3):306-311.
12 Dudziak D,Nimmerjahn F,Bornkamm G Wet al.Alternative splicing generates putative soluble CD83 proteins that inhibit T cell proliferation [J].J Immunol,2005;174(11):6672-6676.
13 Xu J F,HuangBJ,Y in Het al.A limited course of soluble CD83 delays acute cellular rejection of MHC-mismatched mouse skin allografts[J]. Transpl Int,2007;20(3):266-276.
14 Kadowaki N.Dendritic cells:a conductor of Tcell differentiation[J].Allergol Int,2007;56(3):193-199.
[收稿2009-10-09 修回2009-11-16]
(編輯 倪 鵬)
The role of DC in anti-CD45RB antibody-induced immune tolerance
LIU Jin-Peng,DENG Chun-Yan,QI Hui,LI Fu-Rong.Clinical Research Center,Shenzhen People’s Hospital,the Second Medical College of University of Jinan,Shenzhen518020,China
Objective:T o investigate the role of dendritic cells(DCs)in the anti-CD45RB antibody-induced immune tolerance,and the mechanism of immune tolerance induced by anti-CD45RB antibodies.Methods:DCs were induced by conventional methods(rmG M-CSF,IL-4 andLPS),different dosesof anti-CD45RB antibodieswere added in the induction process.Then,mature cellswere harvested,andflow cytometry (FCM)was used to determine cell phenotypes,cycle and phagocytosis,ELISA method was performed to examine the concentration of IL-12 and the ability of T cell proliferation was observed by mixed lymphocyte culture.Results:The DCs preparation was shown a high expression of CD11C and CD83,a low expression of CD86,with strong proliferative and phagocytic capacity after treated with anti-CD45RB antibody.Its secretion of IL-12 was decreased,and it could less effectively stimulate T cell proliferation after treated with anti-CD45RB antibody.Conclusion: One of the mechanismsof anti-CD45RB monoclonal antibody-induced tolerance is to generate tolerogenic dendritic cells(tDCs),significantly inhibiting the proliferation of T cells.
Anti-CD45RB antibody;Dendritic cell;Immune tolerance
R392.4 文獻標識碼 A 文章編號 1000-484X(2010)02-0113-04
①本文為國家自然科學基金資助項目(No.30772042)
劉金鵬(1982年-),男,在讀碩士,主要從事干細胞與組織工程研究,E-mail:lekai0822@163.com;
及指導教師:李富榮(1962年-),男,博士,研究員,主要從事干細胞和細胞移植方面的研究,E-mail:frli62@ yahoo.com。

