花生過(guò)敏原Ara h 6的分離純化及鑒定
羅春萍,高金燕,胡純秋,陳紅兵,*,閆 飛
(1. 南昌大學(xué) 食品科學(xué)與技術(shù)國(guó)家重點(diǎn)實(shí)驗(yàn)室,江西 南昌 330047;2.南昌大學(xué) 中德聯(lián)合研究院,江西 南昌 330047;3.南昌大學(xué)環(huán)境與化學(xué)工程學(xué)院,江西 南昌 330047;4.南昌大學(xué)生命科學(xué)與食品工程學(xué)院,江西 南昌 330047)
花生過(guò)敏原Ara h 6的分離純化及鑒定
羅春萍1,2,3,高金燕4,胡純秋1,2,陳紅兵1,2,*,閆 飛2,3
(1. 南昌大學(xué) 食品科學(xué)與技術(shù)國(guó)家重點(diǎn)實(shí)驗(yàn)室,江西 南昌 330047;2.南昌大學(xué) 中德聯(lián)合研究院,江西 南昌 330047;3.南昌大學(xué)環(huán)境與化學(xué)工程學(xué)院,江西 南昌 330047;4.南昌大學(xué)生命科學(xué)與食品工程學(xué)院,江西 南昌 330047)
為高效分離純化花生過(guò)敏原Ara h 6,通過(guò)脫脂、蛋白浸提、陰離子交換層析分離得到目的蛋白,并用十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)、基質(zhì)輔助激光解吸/電離飛行時(shí)間質(zhì)譜(MALDI-TOF/MS)及免疫印跡技術(shù)(Western blotting)對(duì)其進(jìn)行鑒定。結(jié)果表明,該蛋白為花生過(guò)敏原Ara h 6,其分子質(zhì)量約為15kD,純度大于95%,得率為22.5%。該方法簡(jiǎn)單、高效,可為花生過(guò)敏的進(jìn)一步研究提供實(shí)驗(yàn)材料。
花生過(guò)敏;Ara h 6;分離純化
Abstract :In order to effectively isolate and purify peanut allergen Ara h 6, peanut was subjected to a series of sequential treatments, namely de-fatting, protein extraction and anion-exchange chromatographic. Sodium dodecyl sulfate polyacrylamide gel electropheresis (SDS-PAGE), matrix-assisted laser desorption/ionization time of flight mass spectrometry (MALDI-TOF/MS) and Western blotting were used for the identification of target protein. The results indicated that the purified target protein was peanut allergen Ara h 6 with a molecular weight of 15 kD. The purity of Ara h 6 was more than 95%, and the recovery rate was 22.5%. Based on these investigations, a simple and efficient approach to purifying Ara h 6 is achieved, which will provide experimental materials for further research on peanut allergy.
Key words:peanut allergy;Ara h 6;isolation and purification
Ara h 6是花生中的過(guò)敏原之一,屬于2S白蛋白家族,與花生主要過(guò)敏原Ara h 2的氨基酸序列有59%的同源性[1]。Ara h 6約占花生蛋白總含量的4.5%[2],其分子質(zhì)量約為15kD,等電點(diǎn)為5~6[3]。近年來(lái),Ara h 6蛋白在花生過(guò)敏反應(yīng)中的重要作用得到越來(lái)越多的關(guān)注,因而獲得高純度的具有天然活性的Ara h 6蛋白將為其結(jié)構(gòu)和性質(zhì)的研究提供必不可少的材料。迄今為止,Suhr[3]、Marsh[4]和Koppelman[5]等用陰離子交換層析結(jié)合凝膠層析或高效液相色譜等技術(shù)分離了Ara h 6,而只用陰離子交換層析法分離純化Ara h 6的方法尚未見(jiàn)報(bào)導(dǎo)。本實(shí)驗(yàn)以花生為研究對(duì)象,采用DEAESepharose Fast Flow陰離子交換法分離純化得到高純度的花生過(guò)敏原Ara h 6,并通過(guò)SDS-PAGE電泳、MALDITOF/MS質(zhì)譜和Western blotting鑒定,旨在為進(jìn)一步開(kāi)展花生過(guò)敏原Ara h 6的結(jié)構(gòu)與功能等研究提供良好的實(shí)驗(yàn)材料。
1 材料與方法
1.1 材料、試劑與儀器
新鮮花生 市購(gòu);DEAE-Sepharose Fast Flow GE公司;牛血清白蛋白(電泳純) 中國(guó)醫(yī)學(xué)科學(xué)院血液學(xué)研究院;兔抗花生過(guò)敏原Ara h 6多克隆抗體 實(shí)驗(yàn)室自制;HRP酶標(biāo)羊抗兔IgG二抗 Sigma公司;其他常用生化試劑均為分析純。
PB-10型pH計(jì) 德國(guó)Sartorius公司;高速冷凍離心機(jī) Backman公司;蛋白質(zhì)分離純化系統(tǒng) 上海青浦滬西儀器廠;迷你型蛋白電泳儀、電轉(zhuǎn)儀、凝膠成像儀 Bio-Rad公司。
1.2 方法
1.2.1 分離純化與鑒定工作流程圖
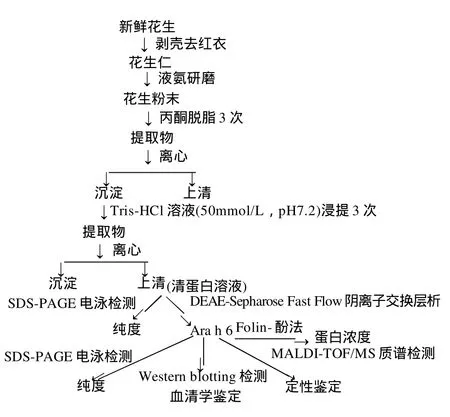
1.2.2 花生蛋白的粗提
參照Koppelman等[5]和Bernard等[6]的方法對(duì)花生進(jìn)行粗提。
1.2.2.1 花生脫脂
新鮮花生剝殼去紅衣,用液氮研磨成細(xì)粉末。將花生粉末與丙酮溶液按1:5(m/V)混合,磁力攪拌(4℃)脫脂2h后,4℃、9000r/min離心15min,棄上清,將該沉淀反復(fù)脫脂3次,冷風(fēng)吹干后得脫脂花生粉末。
1.2.2.2 花生蛋白浸提
將脫脂花生粉末與Tris-HCl溶液(50mmol/L,pH7.2)按1:5(m/V)混合,磁力攪拌(4℃)10h后,4℃,9000r/min離心15min,取上清,并收集沉淀。向沉淀中加入Tris-HCl溶液(50mmol/L,pH7.2)反復(fù)浸提兩次,-20℃保存?zhèn)溆谩?/p>
1.2.3 離子交換層析分離純化花生過(guò)敏原Ara h 6
參照張英坤等[7]的方法采用陰離子交換樹(shù)脂DEAESepharose Fast Flow(2.0cm×30cm)進(jìn)行分離純化。用Tris-HCl溶液(50mmol/L,pH7.2)平衡柱子,待柱子平衡后,加入12mL花生粗蛋白溶液,并用Tris-HCl溶液(50mmol/L,pH7.2)進(jìn)行洗脫,洗脫至基線后改用含0~0.2mol/L NaCl的Tris-HCl溶液(50mmol/L,pH7.2)連續(xù)梯度洗脫。流速為1.5mL/min,分別收集洗脫峰部分,4min/管,紫外吸收法測(cè)定A280nm,檢測(cè)蛋白質(zhì)。
1.2.4 分離純化蛋白的純度鑒定
采用SDS-PAGE電泳進(jìn)行蛋白的純度鑒定[8]。將收集所得的蛋白溶液分別取樣,與等體積2×上樣緩沖液混合制成電泳樣品,采用不連續(xù)SDS-PAGE電泳,使用5%濃縮膠和15%分離膠。電泳后,考馬斯亮藍(lán)染色、脫色。Quantity one軟件灰度掃描分析蛋白純度。
1.2.5 花生過(guò)敏原Ara h 6的質(zhì)譜鑒定
將純化的蛋白進(jìn)行SDS-PAGE電泳,考馬斯亮藍(lán)染色,將目的條帶割下,加入滅菌蒸餾水,密封,冷凍保存。送至暨南大學(xué)生命與健康工程研究院功能蛋白質(zhì)中心進(jìn)行MALDI-TOF/MS質(zhì)譜鑒定。
1.2.6 花生過(guò)敏原Ara h 6的血清學(xué)鑒定
采用Western blotting鑒定。純化的Ara h 6蛋白經(jīng)SDS-PAGE電泳分離后轉(zhuǎn)移至PVDF膜上,用1% TBST室溫封閉1h,加入1:5000(V/V)稀釋的抗花生過(guò)敏原Ara h 6的血清,4℃反應(yīng)過(guò)夜;用TBS洗膜后加1:5000(V/V)稀釋的HRP酶標(biāo)羊抗兔IgG二抗,室溫反應(yīng)2h,洗膜后加顯色液4-氯-1-萘酚顯色即可。
1.2.7 花生過(guò)敏原Ara h 6得率的測(cè)定
參照Folin-酚法[9]測(cè)定分離所得的蛋白樣品濃度,以牛血清白蛋白作為標(biāo)準(zhǔn)蛋白制定標(biāo)準(zhǔn)曲線,并計(jì)算Ara h 6蛋白的得率。
2 結(jié)果與分析
2.1 花生蛋白粗提物的電泳分析
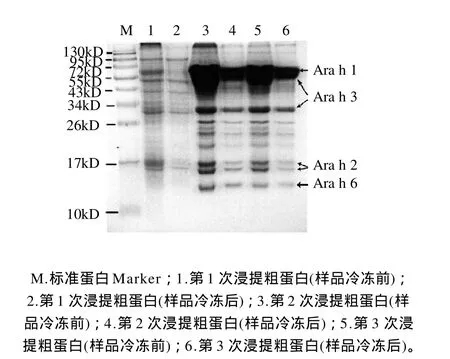
圖1 花生蛋白粗提物SDS-PAGE電泳圖Fig.1 SDS-PAGE of the first, second and third extraction products of crude peanut proteins
花生仁經(jīng)粉碎、脫脂、浸提等操作后獲得花生粗蛋白溶液,脫脂花生粉末經(jīng)3次浸提后所得蛋白粗提物的SDS-PAGE電泳圖見(jiàn)圖1。粗提物中主要為Ara h 1~3和Ara h 6,其中Ara h 3的含量最高,其次是Ara h 1,Ara h 6的含量比Ara h 2略低。比較脫脂花生粉末反復(fù)浸提的結(jié)果可知,對(duì)該花生粉末經(jīng)3次提取即可提取花生中的大部分蛋白。第1次提取的粗提物中花生蛋白的含量非常低,這可能是由于花生中存在某種物質(zhì)抑制了花生蛋白的提取,且該抑制物溶于Tris-HCl溶液,經(jīng)離心后可被除去。
Ara h 6在花生蛋白中的含量較低,本實(shí)驗(yàn)采用多次浸提方法可使原料的利用率提高。且在整個(gè)粗提過(guò)程中未使用變性劑,始終保持低溫的條件,均可使蛋白保留天然活性。此外,經(jīng)研究發(fā)現(xiàn),花生粗蛋白溶液經(jīng)反復(fù)凍融后,其濃度明顯降低。這是因?yàn)榛ㄉ鞍字饕獮橘A藏蛋白,易發(fā)生凝聚現(xiàn)象。因此,花生蛋白粗提后應(yīng)盡快用于離子交換層析,盡量減少因凝聚而導(dǎo)致其可溶性蛋白含量降低。
2.2 離子交換層析分離純化花生過(guò)敏原Ara h 6
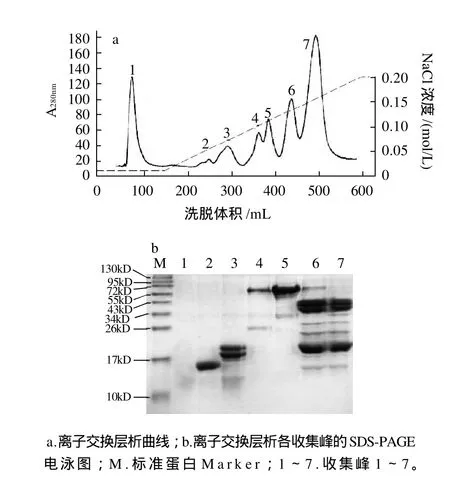
圖2 陰離子交換層析分離花生過(guò)敏原Ara h 6Fig.2 Anion-exchange chromatographic profile of peanut allergen Ara h6 extract on DEAE-Sepharose Fast Flow column and SDS-PAGE of 7 resultant fractions
在pH7.2的條件下,花生蛋白中的一些堿性蛋白質(zhì)帶正電荷,不能被DEAE-Sepharose Fast Flow柱吸附而直接被洗脫下來(lái),如圖2a峰1所示,該蛋白為分子質(zhì)量小于14kD的小分子蛋白。Ara h 6等酸性蛋白質(zhì),在該pH值條件下帶負(fù)電荷,可被DEAE-Sepharose Fast Flow 柱吸附。蛋白質(zhì)所帶電荷數(shù)不同,與樹(shù)脂的結(jié)合力也不同,隨著NaCl離子強(qiáng)度的增加,蛋白按結(jié)合力的強(qiáng)弱被依次洗脫下來(lái),其洗脫曲線見(jiàn)圖2a。其中圖2a峰2在NaCl離子強(qiáng)度為0.05mol/L時(shí)被洗脫下來(lái),SDSPAGE電泳檢測(cè)為目標(biāo)蛋白花生過(guò)敏原Ara h 6(如圖2b峰2),其分子質(zhì)量約為15kD,與Koppelman等[5]分離的Ara h 6的分子質(zhì)量相同,灰度掃描該蛋白純度大于95%(圖略)。
在洗脫過(guò)程中隨著NaCl離子強(qiáng)度的增加,繼Ara h 6后出現(xiàn)的第3個(gè)峰即為花生過(guò)敏原Ara h 2,SDS-PAGE電泳檢測(cè)為分子質(zhì)量約為18kD和20kD的兩個(gè)條帶(圖2b),灰度掃描該蛋白純度約為85%。Ara h 6與Ara h 2的氨基酸序列有59%的同源性,它們的某些性質(zhì)非常相似,兩者的分離純化是研究的一個(gè)難點(diǎn),Marsh等[4]曾用反相高效液相色譜法分離Ara h 6和Ara h 2。但本實(shí)驗(yàn)發(fā)現(xiàn),簡(jiǎn)單的陰離子交換法即可分離這兩種蛋白,且兩者的純度都較高。
在NaCl離子強(qiáng)度達(dá)到0.1mol/L時(shí),峰4和峰5被洗脫下來(lái),SDS-PAGE電泳檢測(cè)為花生過(guò)敏原Ara h 1,其中灰度掃描峰5的蛋白純度約為80%。而在以往的分離Ara h 6的研究中,Suhr等[3]和Koppelman等[5]均先用凝膠層析法除去Ara h 1和其他一些雜蛋白,再用陰離子交換法來(lái)純化Ara h 6粗品。本實(shí)驗(yàn)所用的分離方法既得到了目的蛋白Ara h 6,又可得到純度較高的花生主要過(guò)敏原Ara h 1,方法更簡(jiǎn)單,分離所得的蛋白種類更多。
峰6和峰7含有大量的花生過(guò)敏原Ara h 3,該粗品可用于Ara h 3的進(jìn)一步分離純化。從離子交換層析的洗脫曲線可以看出,花生過(guò)敏原與陰離子交換樹(shù)脂DEAE-Sepharose Fast Flow的結(jié)合能力由弱到強(qiáng)依次為Ara h 6、Ara h 2、Ara h 1、Ara h 3。本實(shí)驗(yàn)采用改變鹽濃度而不是去改變pH值的方法來(lái)進(jìn)行梯度洗脫,因?yàn)辂}濃度更容易控制,在實(shí)驗(yàn)中利用恒流泵的輔助可以使流入柱的緩沖液中的鹽濃度平衡地上升,該方法的重現(xiàn)性非常好。
2.3 花生過(guò)敏原Ara h 6的質(zhì)譜鑒定結(jié)果
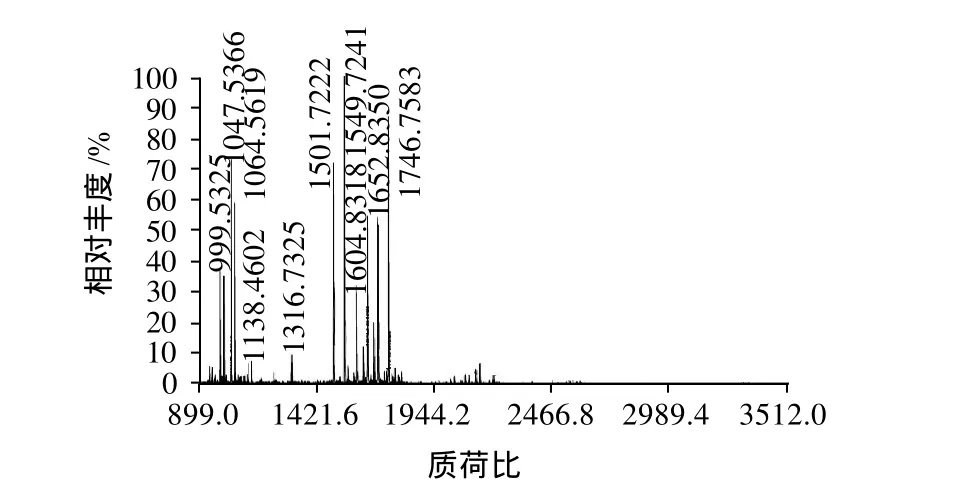
圖3 花生過(guò)敏原Ara h 6的質(zhì)譜圖Fig.3 MALDI-TOF-MS spectrum of peanut allergen Ara h 6
MALDI-TOF/MS是通過(guò)肽質(zhì)量指紋譜結(jié)合數(shù)據(jù)庫(kù)搜尋以分析蛋白質(zhì)序列而進(jìn)行蛋白質(zhì)鑒定,該質(zhì)譜操作簡(jiǎn)便、靈敏度高,同許多蛋白分離方法相匹配,且現(xiàn)有數(shù)據(jù)庫(kù)中有充足的關(guān)于多肽質(zhì)量/電荷比值的數(shù)據(jù),因而被廣泛用于分析鑒定未知蛋白質(zhì)[10]。本實(shí)驗(yàn)將分離所得目標(biāo)蛋白進(jìn)行胰蛋白酶酶解后,用MALDI-TOF/MS質(zhì)譜分析獲得了一個(gè)一級(jí)質(zhì)譜圖(圖3)和7個(gè)二級(jí)質(zhì)譜圖(圖略)。根據(jù)一級(jí)和二級(jí)質(zhì)譜數(shù)據(jù)使用GPS Explore軟件(軟件版本號(hào):V3.6,美國(guó)應(yīng)用生物系統(tǒng)公司)進(jìn)行分析,分析后的每一個(gè)樣品的一級(jí)和二級(jí)質(zhì)譜數(shù)據(jù)再整合成一個(gè)文件,使用MASCOT(軟件版本號(hào):V2.1,英國(guó)Matrix Science公司)搜庫(kù)軟件對(duì)NCBlnr數(shù)據(jù)庫(kù)進(jìn)行檢索比對(duì),結(jié)果發(fā)現(xiàn)本實(shí)驗(yàn)純化所得的蛋白與花生過(guò)敏原Ara h 6相匹配,匹配度為100%,該過(guò)敏原在NCBlnr數(shù)據(jù)庫(kù)中的序列號(hào)為gil75114094,分子質(zhì)量為16.9kD,等電點(diǎn)為6.13,肽段序列比對(duì)結(jié)果見(jiàn)表1。本實(shí)驗(yàn)在用SDS-PAGE電泳對(duì)目標(biāo)蛋白進(jìn)行鑒定的基礎(chǔ)上,通過(guò)MALDI-TOF/MS質(zhì)譜鑒定進(jìn)一步證明了該蛋白為花生過(guò)敏原Ara h 6。
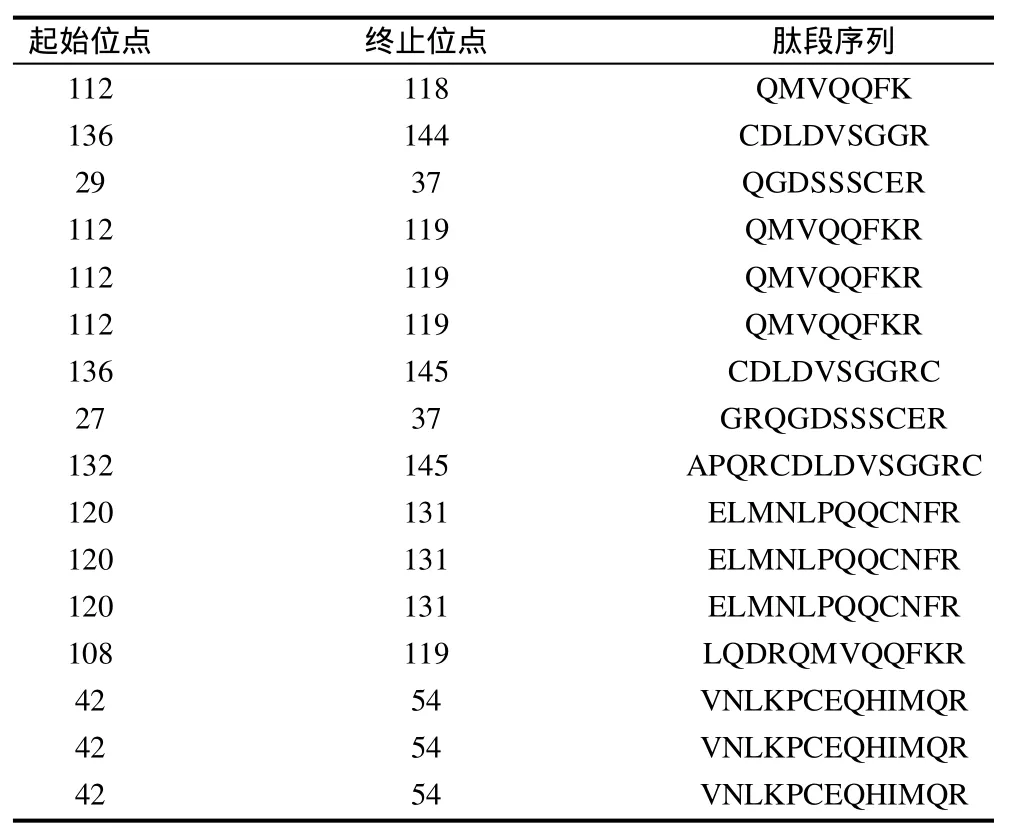
表1 花生過(guò)敏原Ara h 6質(zhì)譜鑒定肽段序列比對(duì)結(jié)果Table 1 Identification of peptides in peanut allergen Ara h 6 by mass spectroscopy
2.4 花生過(guò)敏原Ara h 6的Western blotting分析
Western blotting鑒定蛋白質(zhì)是根據(jù)被測(cè)蛋白能否與特異性抗體結(jié)合的特性和該蛋白的分子質(zhì)量,該方法具有高效、簡(jiǎn)便、靈敏等特點(diǎn),是檢測(cè)樣品中是否存在蛋白抗原的一種可靠方法[11]。本實(shí)驗(yàn)將純化所得的目標(biāo)蛋白進(jìn)行Western blotting檢測(cè),結(jié)果顯示,與SDSPAGE電泳相對(duì)應(yīng)的Ara h 6組分的泳道在分子質(zhì)量約15kD處出現(xiàn)單一的條帶,如圖4所示。說(shuō)明兔抗花生過(guò)敏原Ara h 6抗體可以特異性地識(shí)別Ara h 6,并且與其他蛋白條帶無(wú)特異性的識(shí)別,進(jìn)一步證明了本實(shí)驗(yàn)分離得到了高純度的花生過(guò)敏原Ara h 6。
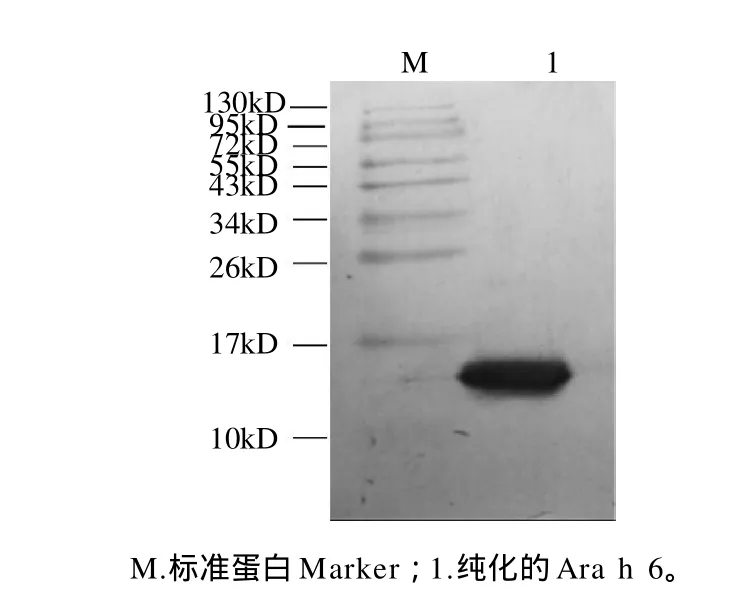
圖4 花生過(guò)敏原Ara h 6的Western blotting分析Fig.4 Western blotting analysis of peanut allergen Ara h 6
2.5 花生過(guò)敏原Ara h 6的得率
花生過(guò)敏原Ara h 6約占花生總蛋白含量的4.5%[2],目前報(bào)道的該蛋白的純化方法均比較復(fù)雜,很難計(jì)算Ara h 6的得率或其得率很低。因此,關(guān)于純化所得花生過(guò)敏原Ara h 6蛋白的得率尚未見(jiàn)報(bào)道。本實(shí)驗(yàn)以Ara h 6占花生總蛋白含量的4.5%為依據(jù)計(jì)算經(jīng)分離所得的Ara h 6的得率,陰離子法分離得到的花生過(guò)敏原Ara h 6的蛋白含量及得率如表2所示。結(jié)果表明,該陰離子交換法分離所得的Ara h 6的得率為22.5%。

表2 陰離子法分離得到的花生過(guò)敏原Ara h 6的得率Table 2 Recovery rate of Ara h 6 purified by anion-exchange chromatography
3 結(jié) 論
本研究選用新鮮花生為原料,采用陰離子交換法分離得到花生過(guò)敏原Ara h 6。經(jīng)SDS-PAGE電泳檢測(cè),目標(biāo)蛋白的分子質(zhì)量約為15kD,純度大于95%,且蛋白得率為22.5%。經(jīng)MALDI-TOF/MS質(zhì)譜和Western blotting進(jìn)一步鑒定該蛋白為花生過(guò)敏原蛋白Ara h 6。本實(shí)驗(yàn)所用方法的優(yōu)越性在于采用了簡(jiǎn)單的離子交換層析法,得到了高純度的目標(biāo)蛋白。該方法簡(jiǎn)單,易操作,成本低,實(shí)驗(yàn)所得高純度的花生過(guò)敏原Ara h 6可用于開(kāi)展該蛋白的結(jié)構(gòu)與功能研究。
[1] KLEBER-JANKE T, CRAMERI R, APPENZELLER U, et al. Selec-tive cloning of peanut allergens including profilin and 2S albumins by phage disply technology[J]. Allergy Immunology, 1999, 119(4): 265-274.
[2] van WIJK F, NIERKENS S, HASSING I, et al. The effect of the food matrix on in vivo immune responses to purified peanutallergens[J].Toxicological Sciences, 2005, 86(2): 333-341.
[3] SUHR M, WICKLEIN D, LEPP U, et al. Isolation and characterization of natural Ara h 6: Evidence for a further peanut allergen with putative clinical relevance based on resistance to pepsin digestion and heat[J].Mol Nutr Food Res, 2004, 48: 390-399.
[4] MARSH J, RIGBY N, WELLNER K, et al. Purification and characterisation of a panel of peanut allergens suitable for use in allergy diagnosis[J]. Mol Nutr Food Res, 2008, 52: 272-285.
[5] KOPPELMAN S J, JONG G A H, LAAPER-ERTMANN M, et al.Purification and immunoglobulin E-binding properties of peanut allergen Ara h 6: Evidence for cross-reactivity with Ara h 2[J]. Clin Exp Allergy, 2005, 35: 490-497.
[6] BERNARD H, MONDOULET L, DRUMARE M F, et al. Identification of a new natural Ara h 6 isoform and of its proteolytic product as major allergens in peanut[J]. J Agric Food Chem, 2007, 55: 9663-9669.
[7] 張英坤, 陳紅兵. 離子交換層析法分離花生過(guò)敏原Ara h 2的研究[J]. 食品科學(xué), 2006, 27(12): 259-262.
[8] 汪家政, 范明. 蛋白質(zhì)技術(shù)手冊(cè)[M]. 北京: 科學(xué)技術(shù)出版社, 2000:77-110.
[9] 李建武, 余瑞元, 袁明秀, 等. 生物化學(xué)實(shí)驗(yàn)原理和方法[M]. 北京:北京大學(xué)出版社, 2001: 216-223.
[10] 陳晶, 付華, 陳益. 質(zhì)譜在肽和蛋白質(zhì)序列分析中的應(yīng)用[J]. 有機(jī)化學(xué), 2002, 22(2): 81-90.
[11] 哈洛 E, 萊恩 D. 抗體技術(shù)實(shí)驗(yàn)指南[M]. 北京: 科學(xué)出版社, 2002:161-165.
Purification and Identification of Peanut Allergen Ara h 6
LUO Chun-ping1,2,3,GAO Jin-yan4,HU Chun-qiu1,2,CHEN Hong-bing1,2,*,YAN Fei2,3
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China;3. School of Environmental and Chemical Engineering, Nanchang University, Nanchang 330047, China;4. School of Life Sciences and Food Engineering, Nanchang University, Nanchang 330047, China)
TS201.21
A
1002-6630(2010)15-0076-04
2010-04-20
南昌大學(xué)食品科學(xué)與技術(shù)國(guó)家重點(diǎn)實(shí)驗(yàn)室目標(biāo)導(dǎo)向項(xiàng)目(SKLF-MB-200807);
江西省主要學(xué)科學(xué)術(shù)和技術(shù)帶頭人培養(yǎng)項(xiàng)目([2004]234號(hào));教育部新世紀(jì)優(yōu)秀人才支持計(jì)劃項(xiàng)目(NCET-08-07-04)
羅春萍(1985—),女,碩士研究生,研究方向?yàn)樯锛庸すこ獭-mail:went_fly@163.com
*通信作者:陳紅兵(1967—),男,教授,博士,研究方向?yàn)槭称飞锛夹g(shù)。E-mail:chbgjy@hotmail.com

