樺褐孔菌多糖IOP3a的分離純化及其體外抗腫瘤活性研究
陳義勇,顧小紅,湯 堅
(1.江南大學 食品科學與技術國家重點實驗室,江蘇 無錫 214122;2.常熟理工學院生物與食品工程學院,江蘇 常熟 215500)
樺褐孔菌多糖IOP3a的分離純化及其體外抗腫瘤活性研究
陳義勇1,2,顧小紅1,湯 堅1
(1.江南大學 食品科學與技術國家重點實驗室,江蘇 無錫 214122;2.常熟理工學院生物與食品工程學院,江蘇 常熟 215500)
采用水浴浸提,Sevage法去除蛋白分離得到粗多糖,DEAE-SepharoseCL-6B離子交換柱、SepharoseCL-6B和Sephadex G-200凝膠柱層析得到樺褐孔菌均一純多糖IOP3a,用MTT法研究IOP3a對Jurkat、Daudi腫瘤細胞體外抑制作用。結果表明:IOP3a對腫瘤細胞Jurkat和Daudi的增殖具有明顯的體外抑制作用(P<0.01),并且具有量效依賴性,其最大抑制率分別達到71.84%和75.14%。
樺褐孔菌多糖;純化;體外抗腫瘤
Abstract:Water extraction and deproteinization by Sevag method were carried out for the preparation of a crude polysaccharide extract from Inonotus obliquus, named IOP. IOP was subjected to sequential treatments with DEAE-Sepharose CL-6B anion exchange, Sepharose CL-6B and Sephadex G-200 columns for purification purpose and a polysaccharide fraction, named IOP3a,was obtained, which was identified to contain a single composition. The inhibitory effect of IOP3a on the proliferation of Jurkat and Daudi tumor cells in vitro was evaluated by MTT assay. It was found that IOP3a had an obvious anti-tumor activity in a dose-dependent manner in vitro (P < 0.01) and that the maximum inhibitory ratio of IOP3a on Jurkat and Daudi tumor cells were 71.84% and 75.14%, respectively.
Key words:Inonotus obliquus polysaccharide;purification;anti-tumor activity in vitro
樺褐孔菌(Inonotus obliquus)是一種應用很廣泛的藥用真菌,主要寄生于白樺樹、銀樺、赤楊等的樹干或樹皮下,菌絲體極其耐寒,能耐受-40℃的低溫,主要分布在北緯45°~50°地區的北美、芬蘭、波蘭、俄羅斯的西伯利亞、遠東部分地區、勘察加半島、中國的黑龍江和吉林、日本的北海道等國家和地區[1]。樺褐孔菌多糖具有抗腫瘤活性[2-4]、降血糖活性[5]、免疫調節活性[6-8]、抗氧化、降血脂等功能,在醫藥工業上有著廣闊的應用前景。但是目前關于樺褐孔菌多糖的分離純化鮮有報道,因此實驗就樺褐孔菌多糖IOP3a分離、純化及其體外抗腫瘤活性進行研究,以期為樺褐孔菌資源的開發及其在醫藥、保健食品等領域的應用提供理論依據。
1 材料與方法
1.1 材料與試劑
樺褐孔菌由黑龍江亞布力土產公司提供,經常熟理工學院冀宏研究員鑒定為擔子菌亞門、多孔菌科褐臥孔菌屬。
Jurkat 細胞(人T淋巴細胞白血病細胞株)、Daudi細胞(人B淋巴細胞瘤細胞),由中國人民解放軍軍事醫學科學院惠贈。
DEAE-Sepharose CL-6B、Sepharose CL-6B、Sephadex G-200填料 Pharmacia公司;小牛血清、四氮甲基偶氮哇鹽(MTT)、二甲基亞砜(DMSO) 美國Sigma公司;RPM I1640培養液 美國Gibco公司; 葡萄糖、苯酚、濃硫酸、乙醇等均為國產分析純。
1.2 儀器與設備
DJ-04粉碎機 上海淀久中藥機械制造有限公司;RE-52A型旋轉蒸發儀 上海亞榮生化儀器公司;752型紫外-可見分光光度計 上海精密科學儀器有限公司;LD4-ZA型離心機 北京醫用離心機廠;SHB-B循環水式真空泵 鄭州長城科工貿公司;LGJ-10冷凍干燥儀南京百思威科技有限公司;DG3022型酶標儀 美國Bio-Rad公司;Nu-3500型CO2培養箱 德國Nuaice公司。
1.3 方法
1.3.1 原料預處理
樺褐孔菌經過粉碎后,過40目篩,用體積分數為80%的乙醇溶液在70℃條件下回流2次,每次3h,以有效去除部分醇溶性物質,然后1000r/min離心20min,去除上清液,沉淀經60℃真空干燥,得到預處理樺褐孔菌粉。
1.3.2 樺褐孔菌多糖(IOP)的提取及初步純化
取經過處理的樺褐孔菌粉,以水作為溶劑提取多糖,提取液離心去掉沉淀,合并濾液,減壓濃縮,在濾液中加95%乙醇,使乙醇含量達到80%,靜置過夜,次日經過離心后收集沉淀,用乙醇洗滌3次,冷凍干燥。將冷凍干燥后的樺褐孔菌粗多糖分別加入一定量的去離子水溶解,用Sevag法去除游離蛋白:將Sevag試劑(氯仿與丁醇體積比4:1)加入樣品中,體積為樣品體積的1/4,充分振蕩,3000r/min離心30min,去除蛋白形成的沉淀,重復5~6次。上清液濃縮后流水透析2d,去離子水透析2d,3000r/min離心30min,濃縮,冷凍干燥,得到初步純化的水提粗多糖IOP。
1.3.3 IOP的DEAE-Sepharose CL-6B離子交換分級純化
將DEAE-Sepharose CL-6B預處理并裝柱(2.6cm×37cm),用大量的磷酸鹽緩沖液平衡8h,體積流量控制為90mL/h,而后將經過初步分離純化后的IOP水溶液上柱,依次用pH7.03的磷酸鹽緩沖液、0~1.5mol/L KCl(配制于磷酸鹽緩沖液)進行線性梯度洗脫,每管9mL自動部分收集器收集,苯酚-硫酸法[9]跟蹤檢測多糖含量(OD490nm),分別收集單一組分,然后透析脫鹽濃縮。
1.3.4 IOP3的Sepharose CL-6B凝膠柱分級純化
IOP3分別經Sepharose CL-6B(2.6cm×160cm)柱層析,用0.02mol/L KCl溶液洗脫,體積流量控制為20mL/h,每管4mL自動部分收集器收集,苯酚-硫酸法[9]跟蹤檢測多糖含量(OD490nm)。
1.3.5 IOP3a的Sephadex G-200凝膠柱分級純化
IOP3a經Sephadex G-200(2.6cm×160cm)柱層析,用0.02mol/L KCl溶液洗脫,體積流量控制為20mL/h,每管4mL自動部分收集器收集,苯酚-硫酸法[9]跟蹤檢測多糖含量(OD490nm)。再經去離子水透析,最后冷凍干燥,得到水溶性樺褐孔菌多糖純品(IOP3a)。
1.3.6 IOP3a組分的紫外掃描
將經SepharoseCL-6B柱層析分離得到的IOP3a進行全波長掃描。
1.3.7 IOP3a的體外抗腫瘤活性
1.3.7.1 細胞培養
在37℃、體積分數為5%的CO2孵箱中對Jurkat、Daudi腫瘤細胞在RPMI1640培養液(含10%滅活胎小牛血清、青霉素1×105U/L和鏈霉素100mg/L)中常規培養,隔天傳代,調整細胞生長狀態,取對數生長期、生長良好的細胞,再調整細胞密度為1×106個/mL進行實驗。
1.3.7.2 IOP3a體外對腫瘤細胞的抑制作用
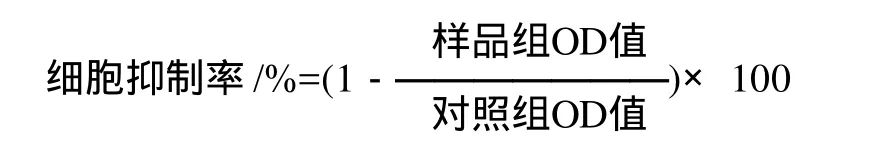
采用 MTT比色法[10],取對數生長期的Jurkat細胞和Daudi細胞,每孔100μL,接種于96孔塑料培養板內,靜止培養12h后,對照組加0.9%生理鹽水不加IOP3a,樣品組每孔內分別加入樺褐孔菌多糖組分IOP3a,使其終質量濃度分別為0.7、2.3、7、70、200μg/mL,每個質量濃度設3個平行孔,然后將培養板移入CO2培養箱中,在37℃、5% CO2以及飽和濕度條件下培養24h后,每孔內分別加入MTT試劑20μL,其終質量濃度為500mg/L。37℃繼續孵育6h后,終止培養,吸取棄除上清液后,每孔加入100μL二甲基亞砜(DMSO),輕輕振蕩10min,使MTT還原產物完全溶解,用酶標儀在570nm波長處測定對照組和樣品組各孔OD值,按以每組3個孔的平均值作為各組的平均OD值,根據下列公式計算腫瘤細胞Jurkat和Daudi的抑制率。
1.4 數據分析
采用SAS軟件AVOVA(P<0.05)程序進行顯著性分析,Duncan程序進行多重比較。
2 結果與分析
2.1 IOP的DEAE-SepharoseCL-6B離子交換分級純化
IOP經過DEAE-SepharoseCL-6B柱分離所得洗脫曲線見圖1。洗脫得到組分IOP1、 IOP2、 IOP3、IOP4,收集各組分,用自來水透析(截留分子質量為120kD)48h,然后用去離子水透析24h,冷凍干燥后計算可知,IOP1、 IOP2、 IOP3、 IOP4分別占總洗脫量的32.2%、 40.3 %、 14.7%、12.8%,IOP經DEAESepharoseCL-6B柱分離純化后,多糖的回收率達85.6%(表 1)。
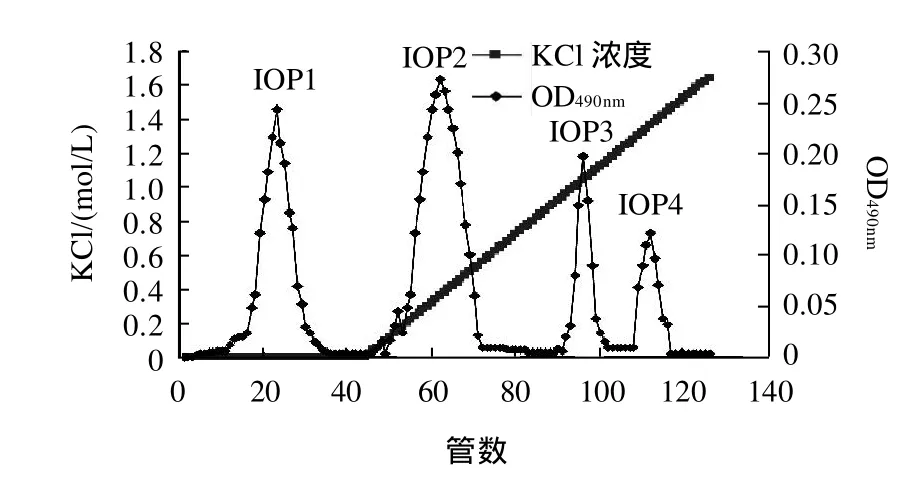
圖1 IOP的DEAE-SepharoseCL-6B柱層析洗脫曲線Fig.1 Elution profile of IOP on DEAE-SepharoseCL-6B column

表1 IOP經DEAE-SepharoseCL-6B柱層析各組分所占比例和回收率Table 1 Ratio and recovery rate of each fraction (IOP 1 through 4) of IOP in the purification on DEAE-SepharoseCL-6B column
經過初步的抗腫瘤實驗,比較IOP四個組分的抗腫瘤活性,證明IOP3的抗腫瘤活性最強,因此將IOP3進一步分離純化,得到單一組分,并進一步研究單一組分的體外抗腫瘤活性。
2.2 IOP3的SepharoseCL-6B凝膠柱分級純化
利用SepharoseCL-6B凝膠柱對IOP3組分進行進一步的分離純化,其IOP3組分的洗脫結果如圖2所示。
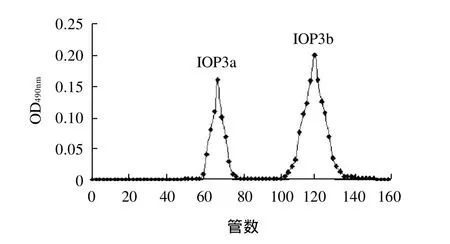
圖2 IOP3的SepharoseCL-6B層析洗脫曲線Fig.2 Elution profile of IOP3 on SepharoseCL-6B column
由圖2可以看出,IOP3組分經過凝膠柱色譜洗脫分離,得到2個相對分子質量不同的組分IOP3a、 IOP3b。
2.3 IOP3a 的Sephadex G-200凝膠柱分級純化
經過初步的抗腫瘤活性篩選,比較IOP3a和IOP3b的體外抗腫瘤活性,結果表明IOP3a的體外抗腫瘤活性強于IOP3b,因此IOP3b暫不做下一步的研究。為檢驗所收集的IOP3a是否為均一的組分,對IOP3a進行了第二次凝膠柱層析,結果如圖3所示。
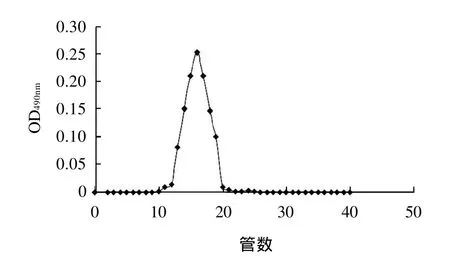
圖3 IOP3a的Sephadex G-200柱層析洗脫曲線Fig.3 Elution profile IOP3a on Sephadex G-200 column
由圖3可知,IOP3a經第二次凝膠柱層析只洗脫分離出一個單一的峰,表明IOP3a為相對分子質量分布均一的多糖組分。
2.4 IOP3a組分的紫外掃描圖譜
為進一步驗證IOP3a的純度,將經SepharoseCL-6B柱層析分離得到的IOP3a進行全波長掃描,其掃描結果見圖4。
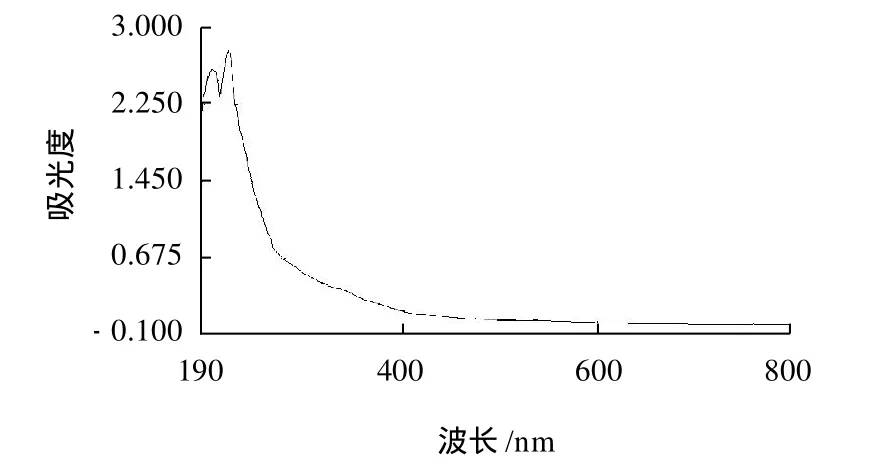
圖4 IOP3a紫外掃描圖Fig.4 UV absorption spectrum of IOP3a
由圖4可以看出,IOP3a組分在特征吸收峰260nm和280nm波長處均無吸收,表明該組分不含有核酸及蛋白質。
2.5 IOP3a對Jurkat細胞增殖的影響
表2 樺褐孔菌多糖IOP3a對Jurkat細胞的抑制作用(±s,n=3)Table 2 Inhibitory effect of IOP3a on Jurkat cells (± s,n=3)
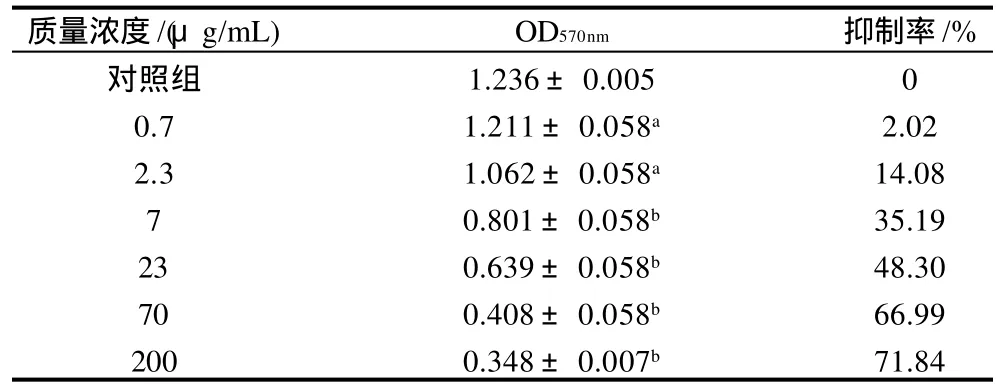
表2 樺褐孔菌多糖IOP3a對Jurkat細胞的抑制作用(±s,n=3)Table 2 Inhibitory effect of IOP3a on Jurkat cells (± s,n=3)
注:a.與對照組比較差異顯著(P<0.05);b.與對照組比較差異極顯著(P<0.01)。下同。
質量濃度/(μg/mL) OD570nm 抑制率/%對照組 1.236±0.005 0 0.7 1.211±0.058a 2.02 2.3 1.062±0.058a 14.08 7 0.801±0.058b 35.19 23 0.639±0.058b 48.30 70 0.408±0.058b 66.99 200 0.348±0.007b 71.84
從表2可以看出,IOP3a對腫瘤細胞Jurkat的增殖具有明顯的抑制作用,而且隨著多糖質量濃度的增加呈現出作用增強的趨勢,具有量效依賴性,與對照組相比有顯著性差異(P<0.01)。
2.6 IOP3a對Daudi細胞增殖的影響
表3 樺褐孔菌多糖IOP3a對Daudi細胞的抑制作用(±s,n=3)Table 3 Inhibitory effect of IOP3a on Daudi cells (±s,n=3)
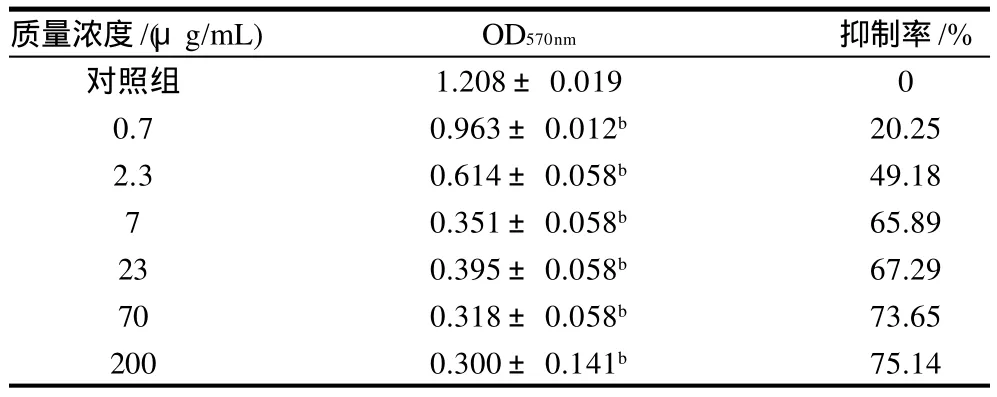
表3 樺褐孔菌多糖IOP3a對Daudi細胞的抑制作用(±s,n=3)Table 3 Inhibitory effect of IOP3a on Daudi cells (±s,n=3)
質量濃度/(μg/mL) OD570nm 抑制率/%對照組 1.208±0.019 0 0.7 0.963±0.012b 20.25 2.3 0.614±0.058b 49.18 7 0.351±0.058b 65.89 23 0.395±0.058b 67.29 70 0.318±0.058b 73.65 200 0.300±0.141b 75.14
從表3 可以看出,IOP3a對腫瘤細胞Daudi的增殖具有明顯的抑制作用,而且隨著多糖質量濃度的增加呈現出作用增強的趨勢,具有量效依賴性,與對照組相比有顯著性差異(P<0.01)。
3 結 論
IOP經過離子交換層析和凝膠過濾層析得到均一的多糖組分IOP3a。
IOP3a對腫瘤細胞Jurkat和Daudi的增殖具有明顯的體外抑制作用(P<0.01),其最大抑制率分別達到71.84%和75.14%,而且隨著多糖質量濃度的增加呈現出作用增強的趨勢,具有量效依賴性。
[1] 黃年來. 俄羅斯神秘的民間藥用真菌: 樺褐孔菌[J]. 中國食用菌,2002, 21 (4): 7-8.
[2] KIM Y O, HANB S B, LEE H W, et al. Immuno-stimulating effect of the endo-polysaccharide produced by submerged culture of Inonotus obliquus[J]. Life Sciences, 2005, 77: 2438-2456.
[3] JAROSZ A, SKORSKA M, RZYMOWSKA J, et al. Effect of the extracts from fungus Inonotus obliquus on catalase level in Hela and Nocardia cells[J]. Acta Biochem Polon, 1990, 37(1): 149-152.
[4] KIM Y O, PARK H W, KIM J H, et al. Anti-cancer effect and structural characterization of endo- polysaccharide from cultivated mycelia of Inonotus obliquus[J].Life Sciences, 2006, 79: 72-80.
[5] MIZUNO T, ZHUANG C, ABE K, et al. Antiumor and hypo-glycemic activities of polysaccharides from the scleritia and mycelia of Inonotus obliquu[J]. Int J Med Mushrooms, 1999, 1(4): 301-316.
[6] BABITSKAIA V G, SHCHERBA V V, IKONNIKOVA N V. Melanin complex of the fungus Inonotus obliquus[J]. Priklbiokhim Microbiol,2000, 36(4): 439-442.
[7] WASSER S P. Medicinal mushrooms as a source of antitumor and immunmodulating polysaccharides[J]. Appl Microbiol Biotechnol, 2002,60: 258-274.
[8] RZYMOWSKA J. The effect of aqueous extracts from Inonotus obliquus on the mitotic index and enzyme activities[J]. Boll Chim Garm, 1998,137(1): 13-15.
[9] 張惟杰. 糖復合物生化研究技術[M]. 杭州: 浙江大學出版社, 2003.
[10] CAO Wei, LI Xiaoqing, LIU Li. Structure of an anti-tumor polysaccharides from Angelica sinensis (Oliv.) Diels[J]. Carbohydrate Polymers,2006, 66: 149-159.
Isolation, Purification and Anti-tumor Activity of a Polysaccharide, IOP3a from Inonotus obliquus
CHEN Yi-yong1,2,GU Xiao-hong1,TANG Jian1
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. School of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
O629.12;R730
A
1002-6630(2010)15-0091-04
2009-12-24
陳義勇(1974—),男,講師,博士研究生,研究方向食品科學與天然活性成分。E-mail:chenyyxp@126.com

