酪蛋白糖巨肽對小鼠腸道免疫系統(tǒng)的影響
李 偉,陳慶森*
(天津商業(yè)大學(xué)生物技術(shù)與食品科學(xué)學(xué)院,天津市食品生物技術(shù)重點實驗室,天津 300134)
酪蛋白糖巨肽對小鼠腸道免疫系統(tǒng)的影響
李 偉,陳慶森*
(天津商業(yè)大學(xué)生物技術(shù)與食品科學(xué)學(xué)院,天津市食品生物技術(shù)重點實驗室,天津 300134)
研究酪蛋白糖巨肽(CGMP)對正常小鼠腸相關(guān)淋巴組織的免疫應(yīng)答反應(yīng)的影響,對闡述CGMP的生物學(xué)功能具有重要意義。本實驗將BALB/c雌性小鼠28只隨機(jī)分為4組,每組7只,分別為0.9%生理鹽水對照組(0.2mL/d),低、中、高3種劑量組(30、120、300μg/d)。連續(xù)灌胃16d后,取脾臟、PP結(jié)(peyer's patches)和腸系膜淋巴結(jié)(mesenteric lymph node,MLN),制備細(xì)胞懸液,進(jìn)行三色熒光標(biāo)記后,用流式細(xì)胞儀檢測CD3+、CD3+CD4+和CD3+CD8+T淋巴細(xì)胞亞群的變化。結(jié)果表明:CGMP各劑量組均能夠促進(jìn)脾臟和PP結(jié)中CD3+和CD3+CD4+細(xì)胞的顯著增加(P<0.05),高劑量能引起脾臟CD3+CD8+淋巴細(xì)胞的顯著增多(P<0.05),低劑量能引起脾臟CD3+CD4+/ CD3+CD8+的顯著增加(P<0.05);低劑量CGMP能使MLN中CD3+CD8+淋巴細(xì)胞顯著增減少(P<0.01)。研究證實長期灌胃CGMP會誘導(dǎo)腸黏膜產(chǎn)生獲得性的免疫應(yīng)答,并且不會引起機(jī)體產(chǎn)生口服耐受。
酪蛋白糖巨肽;T淋巴細(xì)胞亞群;腸系膜淋巴結(jié);PP結(jié);脾臟
Abstract :In order to explore the effect of casein-glycomacropeptide (CGMP) on the intestinal mucosal immune response in normal mice, 28 female BALB/c mice were randomly divided into 4 groups for 7 mice in each group and by gavage given physiological saline (as control group) or CGMP at dosages of 30, 120μg/d and 300μg/d (low-, medium- and high-dosage groups)for 16 consecutive days. After treatment, all the mice were sacrificed and their spleen, peyer's patches and mesenteric lymph node (MLN) were collected to examine the change of CD3+, CD3+CD4+ and CD3+CD8+T lymphocytes subpopulations using flow cytometry. The results indicated that CGMP resulted in a significant increase in CD3+ and CD3+CD4+ lymphocytes in spleen and peyer's patches (P<0.05) in a dosage-dependent manner. Compared with the control group, high-dosage CGMP administration resulted in a higher percentage of CD3+CD8+ lymphocytes in spleen(P<0.05), and low-dosage CGMP administration made the CD3+CD4+/CD3+CD8+ ratio significantly (P<0.05) increase but the percentage of CD3+CD8+lymphocytes in MLN significantly decrease (P<0.01). The above results demonstrate that long-term gastric perfusion of CGMP can induce intestinal mucosal adaptive immune response without tolerance to its oral administration.
Key words:CGMP;T lymphocyte subgroup;MLN;peyer's patch;spleen
眾多的研究證實,在正常機(jī)體內(nèi)各淋巴細(xì)胞亞群相互作用,維持著機(jī)體正常免疫功能。T淋巴細(xì)胞是機(jī)體免疫系統(tǒng)內(nèi)功能最重要的一群細(xì)胞,當(dāng)不同淋巴細(xì)胞亞群的數(shù)量和功能發(fā)生異常時,可導(dǎo)致機(jī)體免疫功能紊亂并發(fā)生一系列病理變化。Gautreaux等[1]研究發(fā)現(xiàn)當(dāng)去除腸系膜淋巴結(jié)、固有層和上皮內(nèi)的CD4+和CD8+淋巴細(xì)胞后,會引起腸道菌群的移位,這反映了淋巴細(xì)胞亞群對于維持腸道微生態(tài)區(qū)系具有重要作用。腹瀉、腸易激綜合征和炎癥性腸病等腸道疾病都與腸黏膜屏障受損有關(guān)[2]。人體胃腸黏膜表面積有200~300m2,通過不斷對腸道內(nèi)的營養(yǎng)物質(zhì)、食物抗原、病原微生物和益生菌做出相應(yīng)的免疫應(yīng)答來維持機(jī)體的免疫平衡狀態(tài),大量的研究表明合理的飲食使腸道免疫功能處于最佳狀態(tài)[3]。營養(yǎng)物質(zhì)不僅僅維持著機(jī)體的正常生長需要,而且通過腸道調(diào)節(jié)機(jī)體的免疫狀態(tài)方面的研究已經(jīng)越來越引起人們的關(guān)注[4]。因此,尋找并研究一些食源性生物活性物質(zhì),促進(jìn)機(jī)體內(nèi)淋巴細(xì)胞亞群的平衡,維持機(jī)體正常的免疫功能以及新藥的研制具有重要價值。
酪蛋白糖巨肽(casein-glycomacropeptide,CGMP)是κ-酪蛋白經(jīng)凝乳酶和胃蛋白酶酶解后形成的含有64個氨基酸的不同種類的肽段[5]。CGMP富含支鏈氨基酸,蛋氨酸含量較低,不含苯丙氨酸,因此可以作為肝病患者和苯丙酮尿病患者的特定食品[6]。另外,它還具有多種生物學(xué)活性:1)促進(jìn)雙歧桿菌的增殖,抑制細(xì)菌和病毒的黏附[7];2)調(diào)節(jié)免疫反應(yīng);3)抑制胃腸道分泌[8]。國內(nèi)外研究報道顯示,CGMP可以作為改善腸道微生態(tài)區(qū)系的活性物質(zhì)。目前,CGMP作為功能性食品添加劑引起了科研工作者的興趣,特別是關(guān)于灌胃CGMP后的免疫性研究越來越重要。Ledoux等[9]通過用GMP皮下免疫兔子,能夠在血液中檢測到抗GMP抗體,說明GMP通過皮下注射可以引起機(jī)體產(chǎn)生特異性的免疫應(yīng)答。但是,Mikkelsen等[10]發(fā)現(xiàn)小鼠飼喂GMP后,并不能夠從血液中檢測到抗GMP抗體。本實驗通過對BALB/c小鼠灌胃不同劑量的CGMP,用流式細(xì)胞儀檢測外周免疫器官,特別是腸相關(guān)淋巴組織中的T淋巴細(xì)胞亞群的變化,來探討CGMP對腸黏膜免疫應(yīng)答的影響。
1 材料與方法
1.1 材料與試劑
6周齡BALB/c雌性小鼠28只,SPF級,體質(zhì)量19~23g,由中國人民解放軍軍事醫(yī)學(xué)科學(xué)院實驗動物中心提供; CGMP純品(澳大利亞原產(chǎn)) 上海統(tǒng)園食品技術(shù)有限公司。
CD3-FITC(NO:555274)、CD4-Percp(NO:553052)、CD8α-PE(NO:553032)、CD3-FITC (NO:555274)、PE Rat IgG2a,κ同型對照(NO:553930)、FITC Rat IgG2b,κ同型對照(NO:553988)、PerCP Rat IgG2a,κ同型對照(NO:553933)、10×溶血素(NO:349202) BD公司。
1.2 儀器與設(shè)備
FACSCalibur流式細(xì)胞儀 Becton Dickinson公司;LD5-10型離心機(jī) 北京醫(yī)用離心機(jī)廠;XW-80A漩渦混合儀 上海滬西分析儀器廠有限公司
1.3 方法
1.3.1 實驗動物分組
將小鼠隨機(jī)分為4組,每組7只,分別為0.9%生理鹽水對照組,低、中、高3種劑量組。預(yù)飼2周后進(jìn)行實驗。按表1分別對各組進(jìn)行灌胃,連續(xù)灌胃16d。各組小鼠自由飲食、飲水。

表1 實驗分組(n=7)Table 1 Grouping of mice in this study
1.3.2 樣本采集
連續(xù)灌胃16d后,斷頸處死小鼠后,無菌操作解剖小鼠,剪取脾臟和腸系膜淋巴結(jié),并剝離MLN上附帶的脂肪組織,分別放入盛有10%胎牛血清的PBS溶液的凍存管中。從胃下3cm處至回盲部剪斷小腸,將小腸與腸系膜剝離后放入分別盛有10%胎牛血清的PBS溶液的培養(yǎng)皿中,用眼科剪剪取小腸表面肉眼可見的PP結(jié),放入盛有10%胎牛血清的PBS溶液的凍存管中。將取得的樣本放入4℃冰箱保存,24h內(nèi)制備細(xì)胞懸液。
1.3.3 細(xì)胞懸液的制備
脾臟細(xì)胞懸液的制備:參考文獻(xiàn)[11]進(jìn)行。將脾臟放于325目的標(biāo)準(zhǔn)篩網(wǎng)上,先用眼科剪將脾臟剪碎,用注射器芯輕輕擠壓組織,用2mL 含5%胎牛血清的PBS液沖洗,用離心管接住所得沖洗液;將沖洗液通過325目的篩網(wǎng)濾去細(xì)胞團(tuán),經(jīng)過1200r/min離心5min后,棄上清,加入1×溶血素1mL,靜置8min,待紅細(xì)胞完全破裂,溶液變得透亮后,加入1mL PBS,1200r/min離心5min,棄上清,加入0.5mL PBS,調(diào)整細(xì)胞濃度為107個/mL。用0.4%的臺盼藍(lán)溶液檢測細(xì)胞的活率達(dá)到95%以上。
PP結(jié)和MLN細(xì)胞懸液的制備:參考文獻(xiàn)[12]進(jìn)行。用鑷子將MLN從5%胎牛血清的PBS溶液中取出,放于325目的標(biāo)準(zhǔn)篩網(wǎng)上,先用鑷子將MLN表面的脂肪剝離,用注射器芯輕輕擠壓組織,用2mL含5%胎牛血清的PBS液沖洗,用離心管接住所得沖洗液;1200r/min離心,5min,后,棄上清,加入2mL PBS,重復(fù)以上步驟兩次,通過325目的標(biāo)準(zhǔn)篩過濾后,調(diào)整細(xì)胞濃度為107個/mL。用0.4%的臺盼藍(lán)溶液檢測細(xì)胞的活率達(dá)到95%以上。制備PP結(jié)細(xì)胞懸液的方法同上。
1.3.4 三色熒光標(biāo)記
CD3-FITC、CD4-Percp單抗試劑按體積比1:9的比例用PBS進(jìn)行稀釋,CD8α-PE稀釋比為1:4;10×溶血素與蒸餾水按照體積比1:9的比例進(jìn)行稀釋。分別對脾臟、MLN和PP結(jié)細(xì)胞懸液管中加入稀釋后的CD3-FITC、CD4-Percp、CD8α-PE單抗各5μL;陰性管中加入同型對照抗體。渦旋混勻,避光室溫靜置30min。1200r/min離心5min,棄上清,用2mL PBS洗滌一次,加入含1g/100mL多聚甲醛的PBS溶液0.5mL混勻,放于4℃冰箱中待測。
1.3.5 流式細(xì)胞儀分析
淋巴細(xì)胞亞群用流式細(xì)胞儀進(jìn)行分析,首先通過調(diào)整熒光電壓,使陰性群體位于散點圖的左下角。利用前向光和側(cè)向光圈出淋巴細(xì)胞群體。其中CD3+細(xì)胞、CD4+細(xì)胞和CD8+細(xì)胞分別用FL1、FL2和FL3通道進(jìn)行獲取,每管獲取10000個細(xì)胞。結(jié)果用CD3+細(xì)胞、CD4+細(xì)胞和CD8+細(xì)胞分別占門內(nèi)淋巴細(xì)胞的百分比表示。利用BD CellQuest Pro數(shù)據(jù)分析軟件對十字門內(nèi)細(xì)胞的比例進(jìn)行統(tǒng)計。
1.4 數(shù)據(jù)分析
用SPSS11.5對數(shù)據(jù)進(jìn)行One-way方差分析,結(jié)果用均值±標(biāo)準(zhǔn)差(±s)表示,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結(jié)果與分析
2.1 不同劑量CGMP對脾臟淋巴細(xì)胞亞群的影響
表2 連續(xù)灌胃CGMP 16d后小鼠脾臟淋巴細(xì)胞亞群的變化(±s,n=7)Table 2 Spleen lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days (±s,n=7)

表2 連續(xù)灌胃CGMP 16d后小鼠脾臟淋巴細(xì)胞亞群的變化(±s,n=7)Table 2 Spleen lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days (±s,n=7)
注:*.與對照組比較,差異顯著(P<0.05);**.與對照組比較,差異極顯著(P<0.01);表中“%”表示以淋巴細(xì)胞計。下同。
分組 淋巴細(xì)胞比例/%CD3+ CD3+CD4+ CD3+CD8+ CD3+CD4+/CD3+CD8+對照組 25.26±3.22 17.91±2.54 6.435±1.38 2.85±0.42低劑量組 33.47±5.04** 25.35±4.73** 6.95±0.50 3.64±0.57*中劑量組 32.94±2.41** 24.07±2.51** 7.53±0.41 3.21±0.41高劑量組 32.96±4.11** 25.26±3.36** 8.02±1.75** 3.26±0.67
由表2可知,連續(xù)灌胃16d后,各劑量組與對照組相比,CD3+、CD3+CD4+淋巴細(xì)胞顯著增多(P<0.01);高劑量組CD3+CD8+淋巴細(xì)胞顯著高于對照組(P<0.01),中低劑量組則無顯著變化;3個劑量都會引起CD3+CD4+/ CD3+CD8+比值升高,其中,低劑量組與對照組相比有顯著差異性(P<0.05)。隨著劑量升高,CD3+CD8+的比例不斷升高,高劑量組與對照組相比差異具有統(tǒng)計學(xué)意義(P<0.01)。
2.2 不同劑量CGMP對MLN中淋巴細(xì)胞亞群的影響
由表3可知,各劑量組與對照組相比,3個劑量組的CD3+和CD3+CD4+淋巴細(xì)胞比例沒有顯著變化;3個劑量組的CD3+CD8+淋巴細(xì)胞都顯著減少;低、高劑量組CD3+CD4+/ CD3+CD8+比值顯著高于對照組(P<0.05)。
表3 連續(xù)灌胃CGMP 16d后小鼠腸系膜淋巴結(jié)淋巴細(xì)胞亞群的變化(±s,n=7)Table 3 MLN lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days(±s,n=7)

表3 連續(xù)灌胃CGMP 16d后小鼠腸系膜淋巴結(jié)淋巴細(xì)胞亞群的變化(±s,n=7)Table 3 MLN lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days(±s,n=7)
分組 淋巴細(xì)胞比例/%CD3+ CD3+CD4+ CD3+CD8+ CD3+CD4+/CD3+CD8+對照組 79.77±2.25 66.71±4.26 12.67±2.66 5.54±1.64低劑量組 74.23±8.23 64.93±6.49 8.96±1.75** 7.40±0.96*中劑量組 76.51±4.93 65.63±4.44 9.75±0.52* 6.74±0.49高劑量組 79.65±5.99 69.41±7.33 9.64±1.58* 7.40±1.65*
2.3 不同劑量CGMP對PP結(jié)淋巴細(xì)胞亞群的影響
表4 連續(xù)灌胃CGMP 16d后小鼠Peyer’s Patches淋巴細(xì)胞亞群的變化(±s,n=7)Table 4 Peyer’s patches lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days(±s,n=7)
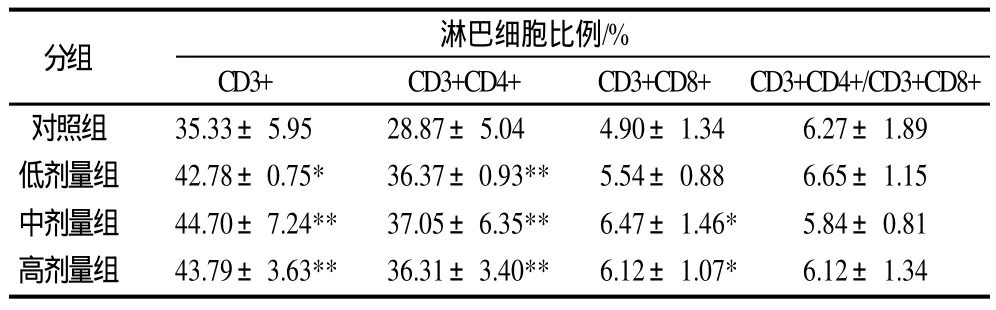
表4 連續(xù)灌胃CGMP 16d后小鼠Peyer’s Patches淋巴細(xì)胞亞群的變化(±s,n=7)Table 4 Peyer’s patches lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days(±s,n=7)
分組 淋巴細(xì)胞比例/%CD3+ CD3+CD4+ CD3+CD8+ CD3+CD4+/CD3+CD8+對照組 35.33±5.95 28.87±5.04 4.90±1.34 6.27±1.89低劑量組 42.78±0.75* 36.37±0.93** 5.54±0.88 6.65±1.15中劑量組 44.70±7.24** 37.05±6.35** 6.47±1.46* 5.84±0.81高劑量組 43.79±3.63** 36.31±3.40** 6.12±1.07* 6.12±1.34
由表4可知,3個劑量組CD3+淋巴細(xì)胞顯著高于對照組(P<0.05);3個劑量組的CD3+CD4+淋巴細(xì)胞顯著高于對照組(P<0.01);CGMP會引起CD3+CD8+比例的增高,其中,中、高劑量組CD3+CD8+顯著高于對照組(P<0.05);CD3+CD4+/ CD3+CD8+比值與對照組相比并無顯著變化。
3 討 論
3.1 PP結(jié)、脾臟和腸系膜淋巴結(jié)作為研究對象的意義
外周免疫器官包括淋巴結(jié)、脾臟和黏膜相關(guān)淋巴組織。脾臟是機(jī)體最大的免疫器官,內(nèi)含有大量的淋巴細(xì)胞,是機(jī)體細(xì)胞免疫和體液免疫的中心。腸相關(guān)淋巴組織(gut-associated lymphoid tissue,GALT)是機(jī)體最大的淋巴組織。其中,誘導(dǎo)腸黏膜免疫部位主要包括PP結(jié)和MLN,效應(yīng)部位是上皮內(nèi)和固有層淋巴細(xì)胞。這些腸相關(guān)淋巴組織的淋巴細(xì)胞直接參與了腸道抗原的識別、呈遞和免疫效應(yīng),它們能夠反映腸道黏膜免疫系統(tǒng)的功能和狀態(tài)。因此,MLN、PP結(jié)和脾臟中T淋巴細(xì)胞各亞群數(shù)量的變化能夠反映出小鼠灌胃CGMP后能否誘導(dǎo)腸黏膜產(chǎn)生免疫應(yīng)答反應(yīng)。
目前,關(guān)于CGMP對腸黏膜免疫的調(diào)節(jié)作用研究的并不是很多,國外的研究主要集中在體外免疫實驗。本研究利用小鼠作為實驗?zāi)P停ㄟ^灌胃實驗對引起腸黏膜免疫反應(yīng)的誘導(dǎo)位點PP結(jié)和腸系膜淋巴結(jié)以及脾臟T淋巴亞群的變化進(jìn)行研究,既可以觀察CGMP灌胃后是否產(chǎn)生口服耐受,也能夠為進(jìn)一步研究CGMP介導(dǎo)腸黏膜免疫機(jī)理提供線索。
3.2 CGMP引起外周免疫器官T淋巴細(xì)胞亞群變化原因的探討
目前,關(guān)于CGMP引起小鼠腸相關(guān)淋巴組織的T淋巴細(xì)胞及其亞群的變化的作用機(jī)制尚不清楚,國內(nèi)外文獻(xiàn)未見相關(guān)的報道。通過實驗結(jié)果分析,發(fā)現(xiàn)CGMP能夠促進(jìn)外周免疫器官如脾臟、PP結(jié)中T淋巴細(xì)胞的增多,說明CGMP能夠引起這些外周免疫器官產(chǎn)生相應(yīng)的免疫應(yīng)答,可能原因是CGMP作為免疫活性肽進(jìn)入胃腸道后,首先與腸相關(guān)淋巴組織接觸,引起腸黏膜免疫系統(tǒng)的應(yīng)答,發(fā)生特異性的細(xì)胞免疫,促進(jìn)成熟的T淋巴細(xì)胞向外周免疫器官遷移,并且引起了這些免疫組織中T淋巴細(xì)胞亞群發(fā)生改變。
PP結(jié)是腸道最主要的免疫起始位點,也是T細(xì)胞和B細(xì)胞發(fā)生初始免疫應(yīng)答的主要場所之一,PP結(jié)中CD4+和CD8+細(xì)胞在腸黏膜免疫應(yīng)答起著重要作用,CGMP能夠促進(jìn)PP結(jié)中CD3+和CD3+CD4+、CD3+CD8+細(xì)胞的顯著增加,它們的顯著增加能夠反映高劑量CGMP促進(jìn)T淋巴細(xì)胞在淋巴濾泡中的增殖和分化,可能的途徑是CGMP由腸上皮M細(xì)胞傳遞給PP結(jié)內(nèi)的樹突細(xì)胞,高劑量能刺激PP結(jié)CD4+、CD8+T淋巴細(xì)胞增殖,并通過腸系膜淋巴結(jié)到達(dá)黏膜免疫的效應(yīng)位點。
高劑量CGMP可以使脾臟CD3+、CD4+和CD8+淋巴細(xì)胞的顯著增加;脾臟T淋巴細(xì)胞的增多可能與血液淋巴細(xì)胞循環(huán)有關(guān)。Otani[13]等通過體外實驗發(fā)現(xiàn)酪蛋白水解的GMP片段能夠抑制由分裂原LPS誘導(dǎo)的脾臟淋巴細(xì)胞的增殖,表明其對免疫反應(yīng)具有抑制作用。一方面可能是CGMP通過腸相關(guān)淋巴組織和血液循環(huán)進(jìn)入脾臟,在細(xì)胞因子的作用下,使脾臟淋巴細(xì)胞產(chǎn)生免疫應(yīng)答;另外,可能是通過淋巴細(xì)胞再循環(huán),其他淋巴組織中增殖的T淋巴細(xì)胞進(jìn)入脾臟。MLN中含有大量的T淋巴細(xì)胞,CGMP能使MLN中CD3+CD8+淋巴細(xì)胞顯著減少,但是CD3+CD4+淋巴細(xì)胞沒有顯著變化,從而引起CD3+CD4+/CD3+CD8+的比值增加,可能與淋巴細(xì)胞遷移有關(guān)。
另外,腸道微生物對于形成腸道黏膜免疫屏障具有重要作用,腸道共生菌的動態(tài)平衡直接影響著腸黏膜免疫的動態(tài)平衡,進(jìn)而影響著機(jī)體的免疫系統(tǒng),對于維持機(jī)體健康具有重要作用。由于CGMP能夠改善腸道的微生物區(qū)系[14],所以有可能微生物區(qū)系的變化也會影響腸黏膜細(xì)胞免疫,使腸相關(guān)淋巴組織淋巴細(xì)胞亞群發(fā)生變化。
4 結(jié) 論
通過CGMP對脾臟、PP結(jié)和腸系膜淋巴結(jié)T淋巴細(xì)胞亞群變化的影響結(jié)果分析,反映了這3個部位在介導(dǎo)CGMP引起的細(xì)胞免疫過程中起著重要作用,長期灌胃能夠介導(dǎo)腸黏膜免疫,促進(jìn)脾臟和PP結(jié)T淋巴細(xì)胞亞群顯著增多。研究發(fā)現(xiàn),長期灌胃CGMP可以誘導(dǎo)腸黏膜產(chǎn)生獲得性的免疫應(yīng)答,不會引起口服耐受。灌胃CGMP可以刺激機(jī)體腸相關(guān)淋巴組織輔助性T淋巴細(xì)胞增多,通過分泌相應(yīng)的細(xì)胞因子,調(diào)節(jié)機(jī)體的細(xì)胞免疫和體液免疫,對增強(qiáng)小鼠腸黏膜免疫屏障功能和阻止腸道病原菌和病毒的感染有重要作用。
另外,“藥食同源”的概念正在深入人心,通過改善飲食來調(diào)節(jié)機(jī)體免疫功能,進(jìn)而維持機(jī)體健康是目前食品領(lǐng)域研究的一個熱點。CGMP可以作為增強(qiáng)免疫調(diào)節(jié)的功能性食品,增加腸相關(guān)淋巴組織輔助性T淋巴細(xì)胞的數(shù)量,維持腸黏膜免疫屏障功能。因此,CGMP在生物制藥和功能性食品研發(fā)領(lǐng)域具有很重要的開發(fā)前景。
[1] GAUTREAUX M D, DEITCH E A, BERG R D. T lymphocytes in host defense against bacterial translocation from the gastrointestinal tract[J]. Infection and Immunity, 1994, 62(7): 2874-2884.
[2] 李偉, 陳慶森. 腸道黏膜免疫屏障及其菌群與機(jī)體健康關(guān)系的研究進(jìn)展[J]. 食品科學(xué), 2008, 29(11): 645-654.
[3] CALDER P C, KEW S. The immune system: a target for functional food[J]. Br J Nutr, 2002, 88 (2): 165-177.
[4] de WITT R C, KUDSK K A. The gut s role in metabolism, mucosal barrier function, and gut immunology[J]. Infect Dis Clin North Am,1999, 13(2): 465-481.
[5] MARTINEZ M J, CARRERA SANCHEZ C, RODRIGUEZ PATINO J M, et al. Bulk and interfacial behaviour of caseinoglycomacropeptide(GMP)[J]. Colloids Surf B Biointerfaces, 2009, 71(2): 230-237.
[6] NEY D M, GLEASON S T, van CALCAR S C, et al. Nutritional management of PKU with glycomacropeptide from cheese whey[J]. Inherit Metab Dis, 2009, 32(1): 32-39.
[7] NAKAJIMA K, TAMURA N, KOBAYASHI-HATTORI K, et al. Prevention of intestinal infection by glycomacropeptide[J]. Biosci Biotechnol Biochem, 2005, 69(12): 2294-2301.
[8] BRODY E P. Biological activities of bovine glycomacropeptide[J]. Br J Nutr, 2000, 84 (1): 39-46.
[9] LEDOUX N, MAHE S, DUBARRY M, et al. Intraluminal immunoreactive caseinomacropeptide after milk protein ingestion in humans[J].Nahrung, 1999, 43(3): 196-200.
[10] MIKKELSEN T L, RASMUSSEN E, OLSEN A, et al. Immunogenicity of kappa-casein and glycomacropeptide[J]. J Dairy Sci, 2006, 89(3):824-830.
[11] SASAI K, YOSHIMURA K, LILLEHOJ H S, et al. Analysis of splenic and thymic lymphocyte subpopulations in chickens infected with Salmonella enteritidis[J]. Vet Immunol Immunopathol, 1997, 59(3/4):359-367.
[12] RAMIRO-PUIG E, PEREZ-CANO F J, RAMOS-ROMERO S, et al.Intestinal immune system of young rats influenced by cocoa-enriched diet[J]. J Nutr Biochem, 2008, 19(8): 555-565.
[13] OTANI H , HATA I. Inhibition of proliferative responses of mouse spleen lymphocytes and rabbit Peyer s patch cells by bovine milk caseins and their digests[J]. J Dairy Res, 1995, 62(2): 339-348.
[14] 曹晉宜, 陳慶森, 王友湘, 等. 酪蛋白糖巨肽對小鼠腸道菌群消長規(guī)律的影響[J]. 食品科學(xué), 2007, 28(11): 536-540.
Effect of Casein-glycomacropeptide on Intestinal Mucosal Immunity in Mice
LI Wei,CHEN Qing-sen*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300134, China )
R151.1
A
1002-6630(2010)15-0240-04
2010-04-19
國家自然科學(xué)基金項目(30771524)
李偉(1983—),男,碩士研究生,研究方向為生物活性物質(zhì)的開發(fā)與利用。E-mail:lwcy1983@yahoo.cn
*通信作者:陳慶森(1957—),男,教授,碩士,研究方向為發(fā)酵生物技術(shù)、酶工程與蛋白質(zhì)資源開發(fā)。E-mail:chqsen@tjcu.edu.cn

