重組人 Semaphorin3A誘導體外培養的大鼠大腦皮層神經元軸突損傷的實驗研究
陶玉倩, 田 青, 葉文華, 楊 穎, 張 賽
神經元的壞死、凋亡存在于很多神經系統疾病的病理生理過程中,既往研究表明[1],在神經元凋亡的典型形態學標志出現之前,常可觀察到軸突損傷,軸突損傷對于整個神經元死亡來說可能是一個早期引發因素[2],然而在神經元死亡早期,有關軸突網絡的退縮、崩解的分子生物化學機制還不清楚。Sema3A是分子量為 100kD的一種分泌型蛋白,由Luo等[3]首次從雞腦中提取。在神經系統發育過程中,Sema3A作為一種抑制性軸突導向因子,通過誘發軸突末端生長錐崩解[3]來實現對軸突生長的定向導航作用。近年來研究表明,成年動物神經系統中也有 Sema3A的表達,尤其在神經系統遭受損傷后,例如脊髓創傷[4]、腦梗死[5]等,Sema3A與軸突再生的局限性有關[6]。而 Sema3A是否對體外培養的神經元軸突生長具有阻滯作用,還未見文獻報道。本實驗擬以體外培養的 SD大鼠神經元為細胞模型,觀察外源性 Sema3A對于神經元軸突生長的影響,進而探討 Sema3A在神經元死亡早期所起到的初始引發作用。
1 材料和方法
1.1 主要試劑與儀器 重組人 Sema3A/Fc融合蛋白購自 R&D System公司,溶于0.01mol/LPBS后,-20℃保存備用。胰酶、DNA酶、胰酶抑制劑、阿糖胞苷、L-多聚賴氨酸、Hoechst33342染液、MTT等均購自 Sigma公司。小鼠抗大鼠 MAP-2抗體購自 Programma公司;FITC偶聯羊抗小鼠熒光二抗購自 Jackson公司。Neurobasal培養基、B27均購自 Invitrogen公司。細胞培養箱(Heraus公司)、熒光顯微鏡(Olympus公司)、酶標儀(Bio-TEK公司)等實驗儀器均由中山大學附屬第一醫院神經科實驗室提供。
1.2 神經元原代培養 新生 24h內的 SD大鼠,由中山大學醫學院實驗動物中心提供。解剖顯微鏡下,用顯微手術鑷無菌剝取大腦皮層,并剔除腦膜及血管組織,D-Hanks液沖洗后剪碎(以上操作均在冰上進行)。胰酶 (0.25mg/m l)消化,37℃,15min;離心 800rpm,1min,棄上清。加入 D-Hanks液(含 0.08mg/ml DNA酶及 0.56mg/ml胰酶抑制劑),終止消化,并吹散成懸液;靜置 15min后,取上清;離心 1500rpm,5min,棄上清。Neurobasal培養液(含 1%胎牛血清、2%B27)重懸細胞,吹散為單細胞懸液。細胞計數后調整為合適的細胞密度,接種于 L-多聚賴氨酸(0.1mg/m l)預包被的培養皿中,置于 37℃,5%CO2的培養箱中培養。接種 24h后加入阿糖胞苷(10μmol)抑制膠質細胞生長,接種 3d后半量換液,以后每 3~4d半量換液一次。
1.3 神經元生長錐觀察 原代神經元接種于六孔培養板,培養 24h后,進行 Sema3A(終濃度為0.5 mg/m l)處理,24h后置于倒置相差顯微鏡下觀察。
1.4 MAP-2、Hoechst33342免疫熒光染色 原代神經元接種于放有滅菌蓋玻片的六孔培養板中,制成細胞爬片。培養 3d后,進行 Sema3A處理。48h后,吸棄培養液,PBS漂洗 3次;4%多聚甲醛冰上固定 30min,PBS漂洗 3次;0.1%TritonX-100/PBS 37℃破膜 30min,PBS漂洗 3次;正常山羊血清室溫封閉 30min后棄血清免洗,加入小鼠抗大鼠MAP-2一抗(1∶200,1%BSA/PBS稀釋),濕盒內孵育 4℃過夜。次日吸棄一抗,PBS漂洗 3次;滴加FITC偶聯的羊抗小鼠熒光二抗(1∶100,1%BSA/PBS稀釋)避光室溫孵育 1h,PBS漂洗后再滴加 Hoechst33342染液,染色 10m in;PBS充分漂洗后中性甘油封片。熒光顯微鏡下觀察拍照。
1.5 軸突長度測量 神經元貼壁培養 3d后,加入終濃度為 5mg/m l的 Sema3A,連續作用48h后,MAP-2免疫熒光染色,并拍攝顯微鏡下熒光圖像,利用 Image-Pro Plus 6.0軟件進行圖像分析,以軸突末端至其胞體結合部的循跡距離為尺度界定標準,測量圖像中所有細胞的軸突長度。正常對照組在相同時間點進行熒光染色,并拍照測量軸突長度。兩組分別隨機選取 10個視野,共有 250個神經元的軸突納入測量。
1.6 MTT法測細胞活力 原代培養神經元,調整細胞濃度為 2×104個/L,種植于 96孔培養板,培養 3d后,棄除原培養液,加入各種工作液。實驗分組:正常對照組(工作液為正常培養液)、Sema3A處理組(工作液為含不同濃度 Sema3A的細胞培養液,其中 Sema3A終濃度分別為 0.1、0.5、1.0、2.5、5.0mg/ml),每組設立 6個平行復孔及 1個空白對照孔。各組工作液作用 48h后,進行 MTT檢測:每孔加入 MTT 20μl(終濃度為 5mg/ml,避光),37℃,5%CO2培養箱繼續培養 4h后,小心棄除上清,加入DMSO100μl,振蕩 10min溶解紫色結晶物,用酶標儀檢測 490nm波長處吸光度值(A490nm,OD)。兩組數據均扣除空白對照孔 A490nm值后,計算細胞存活率 Survival(%)=Sema3A處理組 A490nm值/正常對照組 A490nm值 ×100%。
1.7 統計學處理 采用 SPSS 13.0統計軟件分析數據,計量數據以均數±標準差(±s)表示,兩組獨立樣本均數間比較采用 t檢驗,多組獨立樣本均數比較采用單因素方差分析,組間兩兩比較采用Bonferroni法,P<0.05為差異具有統計學意義。實驗結果均經重復實驗 3次。
2 結 果
2.1 Sema3A引起神經元生長錐崩解 倒置相差顯微鏡下觀察,神經元貼壁培養 24h后,軸突開始由胞體發出并向外延伸。正常對照組神經元軸突末端呈扇形膨大,細小絲狀分支由扇形膨大處發出并向外伸展,為正常生長錐形態(見圖1A);而加入外源性 Sema3A的神經元軸突末端尖銳,扇形膨大結構消失,生長錐崩解(見圖1B)。
2.2 Sema3A抑制神經元軸突生長 熒光顯微鏡下觀察并測量神經元軸突長度。神經元貼壁培養5~6d后,觀察可見對照組 MAP-2免疫陽性細胞的軸突較為粗壯、健康并且細胞之間軸突聯系密切(見圖2A);而 Sema3A處理組的神經元軸突較為纖細,部分細胞發生軸突退化與崩解(見圖2B)。經測量對照組神經元軸突平均長度為(289.24±47.84)μm,而 Sema3A處理組的軸突平均長度顯著縮短為(95.56±25.26)μm,兩組比較有統計學意義(P<0.001,見圖3)。表明 Sema3A對體外培養的皮層神經元的軸突生長具有明顯的抑制作用。
2.3 Sema3A的神經元毒性作用 MTT法檢測不同 Sema3A劑量組的神經元活性。實驗結果顯示,Sema3A 0.5mg/m l開始對神經元產生毒性作用,細胞存活率與正常對照組比較,降至 84.45±0.94(%);Sema3A的 IC50約為 2.5mg/ml;隨著 Sema3A劑量梯度增加,細胞存活率逐漸下降(見表1)。
表1 Sema3A對神經元生存率的影響(±s,n=6)

表1 Sema3A對神經元生存率的影響(±s,n=6)
與正常對照組比較*P<0.001,△P>0.05
組別 A 490nm 生存率 (%)正常對照組Sema3A 0.1(mg/ml)Sema3A 0.5(mg/ml)Sema3A 1.0(mg/ml)Sema3A 2.5(mg/ml)Sema3A 5.0(mg/ml)0.53±0.03 0.53±0.03△0.45±0.03*0.38±0.01*0.24±0.02*0.23±0.02*100.00±0.00 98.64±6.31△84.45±0.94*70.78±1.64*45.11±2.35*43.44±2.29*

圖1 倒置相差顯微鏡普光下生長錐觀察 (×200)

圖2 MAP-2、Hoechst33342免疫熒光染色 (×200)
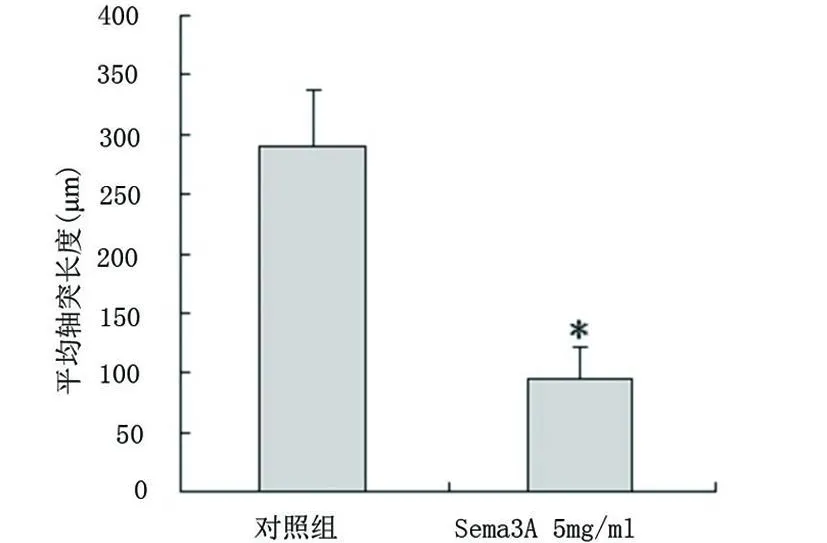
圖3 神經元平均軸突長度測量結果(±s,n=6)
3 討 論
在神經系統發育過程中,神經元的軸突沿著特定的路徑不斷延伸,直至到達將與其建立突觸聯系的靶點(靶細胞的胞體、樹突或軸突),最終形成精密的神經網絡。而這一過程的精確調節,需要軸突生長導向因子[7]的介導。在體內,Sema3A作為一種抑制性軸突導向因子,主要在胚胎期表達,在神經系統發育過程中通過介導位于軸突末端高度能動和敏感的結構-生長錐[8]的崩解來促使軸突生長方向的逆轉,從而起到對軸突生長的定向導航作用[9]。而近年來研究表明,成年動物神經系統中也有 Sema3A的表達,尤其在神經系統遭受損傷后,Sema3A有一定的表達上調[4,5,10]。已有體內實驗證實,中樞神經系統損傷后形成膠質瘢痕,侵入損傷核心區的腦脊膜成纖維細胞能夠表達分泌型 Sema3A[11],并且外周神經損傷后,脊髓背根神經節(DRG)發出的軸突不能穿越有 Sema3A表達的瘢痕組織[12]。
既往研究已經證實,Sema3A在體內對胚胎發育中的神經元起到軸突導向的作用[9]。本次實驗以體外培養的新生乳鼠大腦皮層神經元為細胞模型,予以外源性蛋白 Sema3A(終濃度 0.5mg/ml)處理 24h后,可通過倒置相差顯微鏡觀察到神經元生長錐發生崩解,說明出生后動物的神經元仍然對于 Sema3A敏感,在體外 Sema3A對于新生動物的神經元同樣具有誘導生長錐崩解的作用。
已有體內實驗證明,Sema3A在中樞神經系統損傷后的膠質瘢痕中表達,起到抑制神經元軸突延伸的作用[11],而相關體外實驗尚無文獻報道。本次實驗將體外培養的皮層神經元予以 Sema3A(終濃度 5mg/ml)處理48h,可觀察到神經元軸突變得纖細,部分細胞發生軸突退化與崩解;從而在細胞水平證明了 Sema3A對于出生后動物的神經元,可發揮明顯的誘發軸突損傷及抑制軸突生長的作用。另外,本實驗應用不同濃度的 Sema3A處理神經元,觀察到隨著 Sema3A劑量梯度增加,細胞存活率逐漸下降;提示 Sema3A不僅抑制軸突生長,而且隨其濃度增加也逐漸具有一定的神經元毒性。并且,已有文獻報道,Sema3A在一定濃度范圍內能夠誘導體外培養的小腦顆粒神經元凋亡[13]。那么,Sema3A作為一種軸突導向因子,不僅在軸突導向方面發揮作用,在特定的因素誘導下,可能通過某種抑制性信號導致神經元活性降低甚至誘發細胞凋亡,而其軸突導向和細胞死亡的信號轉導是否通過同一條信號通路,還需要進一步的實驗證實。
通過本次實驗觀察,并結合以往文獻報道,可以推測,由Sema3A激活的抑制性信號不僅局限于神經系統發育的早期,其在動物出生乃至成年后仍然發揮作用。在體內神經系統遭受損傷后,在病理性細胞凋亡的過程中,病灶周圍處于應激狀態但仍有活力的神經元或相關膠質細胞可能會分泌 Sema3A等抑制性軸突導向因子,繼而被周圍細胞表面 Sema3A受體復合體Neurotrophin-1/Plexin-A1(Nrp-1/PlexinA-1)[14]所識別,最終激活胞內信號通路,導致軸突損傷,甚至細胞死亡。
綜上所述,在正常神經系統發育過程中,Sema3A起到重要的軸突導向作用,以確保建立精密有效的神經網絡,而在成年動物神經系統損傷后,Sema3A可能通過誘導軸突損傷,對軸突再生產生消極影響,阻礙新的軸突網絡的建立形成,并進一步誘發神經元損傷甚至凋亡。然而對于 Sema3A誘發軸突損傷的機制,其激活的信號轉導通路如何,本實驗未做深入研究。對于 Sema3A誘導神經元軸突損傷的實驗研究有助于闡釋 Sema3A在神經元死亡早期所起到的初始引發作用,進而為早期神經保護提供新的靶點和思路。
[1]Wakade TD,Palmer KC,Mccauley R,etal.Adenosine-induced apoptosis in chick embryonic sympathetic neurons:a new physiological role for adenosine[J].JPhysiol,1995,488(Pt 1):123-138.
[2]Raff MC,Whitmore A,Finn JT.Axonal self-destruction and neurodegeneration[J].Science,2002,296(5569):868-871.
[3]Luo Y,Raible D,Raper JA.Collapsin:a protein in brain that induces the collapse and paralysisof neuronal growth cones[J].Cell,1993,75(2):217-227.
[4]Pasterkamp RJ,Giger RJ,Ruitenberg MJ,etal.Expression of the gene encoding the chemorepellent semaphorin IIIis induced in the fibroblast component of neural scar tissue formed following injuries of adult but not neonatal CNS[J].Mol Cell Neurosci,1999,13(2):143-166.
[5]Hou ST,Keklikian A,Slinn J,etal.Sustained up-regulation of semaphorin 3A,Neuropilin1,and doublecortin expression in ischem ic mouse brain during long-term recovery[J].Biochem Biophys Res Commun,2008,367(1):109-115.
[6]Pasterkamp RJ,Verhaagen J.Semaphorins in axon regeneration:developmental guidancemolecules gone wrong[J]?Philos Trans R Soc Lond B Biol Sci,2006,361(1473):1499-1511.
[7]Chilton JK.Molecular mechanisms of axon guidance[J].Dev Biol,2006,292(1):13-24.
[8]Lowery LA,Van Vactor D.The trip of the tip:understanding the growth conemachinery[J].Nat Rev Mol Cell Biol,2009,10(5):332-343.
[9]Yazdani U,Terman JR.The semaphorins[J].Genome Biol,2006,7(3):211.
[10]Klebanov O,Nitzan A,Raz D,etal.Upregulation of Semaphorin 3A and the associated biochem ical and cellular events in a ratmodel of retinal detachment[J].Graefes Arch Clin Exp Ophthalmol,2009,247(1):73-86.
[11]Niclou SP,Franssen EH,Ehlert EM,etal.Meningeal cell-derived semaphorin 3A inhibits neurite outgrowth[J].Mol Cell Neurosci,2003,24(4):902-912.
[12]DeWinter F,Oudega M,Lankhorst AJ,etal.Injury-induced class 3 semaphorin expression in the ratspinal cord[J].Exp Neurol,2002,175(1):61-75.
[13]Shirvan A,Ziv I,Fleminger G,etal.Semaphorins as mediators of neuronal apoptosis[J].JNeurochem,1999,73(3):961-971.
[14]Takahashi T,Fournier A,Nakamura F,etal.Plexin-neuropilin-1 complexes form functional semaphorin-3A receptors[J].Cell,1999,99(1):59-69.

