重組水稻α-半乳糖苷酶的分離純化及酶學性質研究
李蘇紅,朱旻鵬,李拖平*
(1.沈陽師范大學工程技術學院,遼寧 沈陽 110034;2.遼寧大學輕型產業學院,遼寧 沈陽 110036)
重組水稻α-半乳糖苷酶的分離純化及酶學性質研究
李蘇紅1,朱旻鵬1,李拖平2,*
(1.沈陽師范大學工程技術學院,遼寧 沈陽 110034;2.遼寧大學輕型產業學院,遼寧 沈陽 110036)
對重組水稻α-半乳糖苷酶的分離純化及其酶學性質進行研究。結果表明:該重組酶分子質量約為59kD;最適酶反應溫度為45℃,最適pH值為5.0;酶活力在0~20℃,pH4.0~7.0最為穩定;酶學動力學常數Km為0.78mmol/L,Vmax為10.16mmol/(mg·min)。多數的金屬離子和有機離子對酶催化作用沒有影響,Hg2+、Ag+及-SH基團抑制劑p-chloromercuribenzoic acid(pCMB)對酶活性有強烈抑制作用。
重組;α-半乳糖苷酶;純化;酶學性質
Abstract:A crude enzyme solution rich in recombinant riceα-galactosidase from the engineering strainE. colipET-32a (+)-Gal/ Origami DE obtained from our laboratory was prepared and purified on a Ni-Sepharose affinity column. The purifiedαgalactosidase showed a single protein band in SDS-PAGE with a molecular mass of 59 kD. This enzyme exhibited the highest activity at the conditions of pH 5.0 and 45 ℃. Meanwhile, it showed the best stability at pH 4.0-7.0 and 0-20 ℃. The kinetic parametersKm andVmax were 0.78 mmol/L and 10.16 mmol/(mg·min), respectively. Most of metal and organic ions did not affect the activity of this enzyme. However, Ag+, Hg2+andpCMB (p-chloromercuribenzoic acid) significantly decreased its activity by 84%, 87% and 92%, respectively.
Key words:recombinant;α-galactosidase;purification;enzymatic characterization
很多的植物低聚糖和多糖中都發現有半乳糖苷,它主要出現在植物貯存營養物質和進行光合作用活躍的組織里[1],α-半乳糖苷酶(α-galactosidase,α-Gal,EC3.2.1.22)屬外切糖苷酶類,能夠專一性催化非還原末端α-半乳糖苷鍵的水解,它不僅能夠水解含α-半乳糖苷的半乳甘露低聚糖和棉子糖族低聚糖(如蜜二糖、棉子糖、水蘇糖、毛蕊花糖等);而且能夠水解含該鍵的多糖,如α-半乳甘露聚糖等。此外,它還能作用于含有α-半乳糖苷的糖蛋白和糖脂質[2-5]。α-半乳糖苷酶廣泛存在于植物、動物和微生物中,α-半乳糖苷酶在食品、制糖、飼料、醫藥工業等領域得到廣泛的應用[6]。
不同來源的α-半乳糖苷酶其理化特性相差明顯。根據其氨基酸序列的同源性在CAZy數據庫(http://afmb.cnrs-mrs.fr/CAZy/)中α-半乳糖苷酶被分類于糖水解酶家族(GH family)的第4、27、36和57族。其中來源于真核生物的酶具有相當程度的同源性,多屬于第27族。而來源于細菌類的酶則多屬于第36族。
以植物取材的α-半乳糖苷酶研究的較多[1-3]。在各種動物組織中,以人和鼠的甲狀腺、腎和脾的酶活最高[7]。在20世紀60~70年代,國內外開始微生物產α-半乳糖苷酶及酶性質的研究,已篩選出一些產α-半乳糖苷酶活性的微生物,主要有短雙歧桿菌、青霉菌、酵母菌、放線菌等。1972年,Beutlert等[8]首次研究了α-半乳糖苷酶動力學和熱力學穩定性,使人們對α-半乳糖苷酶的特性有了更深一步了解。隨著分離純化技術的發展,研究得到了越來越多的純化酶。近年來,基因工程技術的應用為高活力α-半乳糖苷酶的提取制備提供了一個廣闊的空間。一些不同來源的α-半乳糖苷酶基因被克隆并在大腸桿菌、畢赤酵母中獲得表達。我國α-半乳糖苷酶的商品化生產量少、種類貧乏且價格昂貴,通過基因工程獲得高活力、熱穩定及pH值穩定范圍廣的α-半乳糖苷酶是該酶大規模生產應用的有效途徑。
目前,水稻的全基因組序列已經確定[9]。核酸序列數據庫中有7個被推定為α-半乳糖苷酶基因,本實驗報道了源于水稻α-半乳糖苷酶基因之一(BAC79549)重組酶(recombinant riceα-Gal)的純化及酶學性質。以期為拓寬α-半乳糖苷酶在食品、飼料添加劑等方面的應用和對水稻全基因組的構造及其生理生化機能的解析提供參考。
1 材料與方法
1.1 菌種
基因重組水稻α-半乳糖苷酶(BAC79549)的大腸桿菌工程菌株(pET-32a(+)-Gal/OrigamiDE)[10]由本實驗室提供。
1.2 試劑與儀器
pNPG 蜜二糖、棉子糖、水蘇糖、槐豆膠和角豆膠 美國Sigma公司;牛血清白蛋白和蛋白質分子質量標準 Takara公司;HisTrap HP(鎳離子螯合柱)和PD-10脫鹽柱 Aamershampharmacia Biotech公司;其余試劑為國產分析純。
AKTAFPLC蛋白純化系統和蛋白電泳儀Aamershampharmacia Biotech公司。
1.3 重組水稻α-半乳糖苷酶的制備
將大腸桿菌工程菌株按1%接于含卡那霉素(15μg/mL)、四環素(12.5μg/mL)和氨芐青霉素(50μg/mL)的LB培養基中在15℃、250r/min條件下培養,同時加入異丙基-β-D-硫代吡喃半乳糖苷(IPTG)(0.1mmol/L)誘導72h。4℃、6000r/min離心10min,棄上清液收集菌體。用pH7.0,含有500mmol/L NaCl的50mmol/L HEPES緩沖液懸浮菌體,在冰水浴中超聲破碎菌體后,4℃、10000r/min離心10min收集上清,即得粗酶液。
1.4 重組水稻α-半乳糖苷酶的純化
將5mL過濾后的粗酶液加入用平衡緩沖液(pH7.0,含500mmol/L NaCl的50mmol/L HEPES)平衡好的1mL HisTrap HP,以1mL/min的流速用上述平衡緩沖液洗柱8min后,用咪唑(imidazole)濃度0至500mmol/L的平衡緩沖液對目的蛋白進行線性梯度洗脫。用SDS-PAGE電泳鑒定純化蛋白,最后用PD-10脫鹽柱脫鹽。
1.5 蛋白質分子質量和濃度的測定
采用LaemmLi法進行SDS-PAGE測定蛋白質分子質量。采用Lowry法,以牛血清白蛋白為標準測定蛋白質濃度。
1.6 酶活力測定
將0.1mL的10mmol/LpNPG與0.8mL的McIlvaine緩沖液(pH5.0)混合,于45℃預熱5min后,加入0.1mL的酶液混勻,45℃條件下準確反應10min,立即加入1mL的0.2mol/L Na2CO3溶液終止反應。在405nm波長處測其OD值,以對硝基酚的生成量表示酶活力。一個酶活力單位(U)定義為每分鐘分解pNPG釋放1μmol對硝基酚所需的酶量。
1.7 重組水稻α-半乳糖苷酶酶學性質研究
1.7.1 酶的最適反應pH值及pH值穩定性
在pH值分別為3.0~9.5之間的反應體系中測定酶活力,研究酶促反應的最適pH值。將酶分別置于不同pH值的緩沖體系中,20℃保溫1h,測定其對應的剩余相對酶活力,以酶活力最高者為100%,研究酶的pH值穩定性。pH3.0~7.5用McIlvaine緩沖液;pH7.0~8.5用0.1mol/L HEPES緩沖液;pH8.5~9.5用Glycine-NaOH緩沖液。
1.7.2 酶的最適反應溫度及熱穩定性
分別在20~60℃范圍內測定酶活力,考察酶的最適反應溫度。將酶液置于pH5.0的緩沖體系中,分別在不同溫度下保持1h,測定其對應的剩余相對酶活力,以酶活力最高者為100%,考察酶的溫度穩定性。
1.7.3 不同金屬離子對酶活力的影響
在反應體系中分別加入各種金屬離子及化合物,使其在反應體系中的終濃度達到1mmol/L,然后測定酶活力,以未加入的酶液做對照,考察金屬離子及化合物對酶活力的影響。
1.7.4 動力學常數Km測定
將酶液分別與0.5、1、2、3、5、10mmol/L的pNPG作用,每隔1min取樣,在405nm波長處測其OD值測定,用Line-weaver-Burk 雙倒數作圖法求出以pNPG為底物的酶的Km值。
2 結果與分析
2.1 重組水稻α-半乳糖苷酶的鎳離子螯合柱親和純化
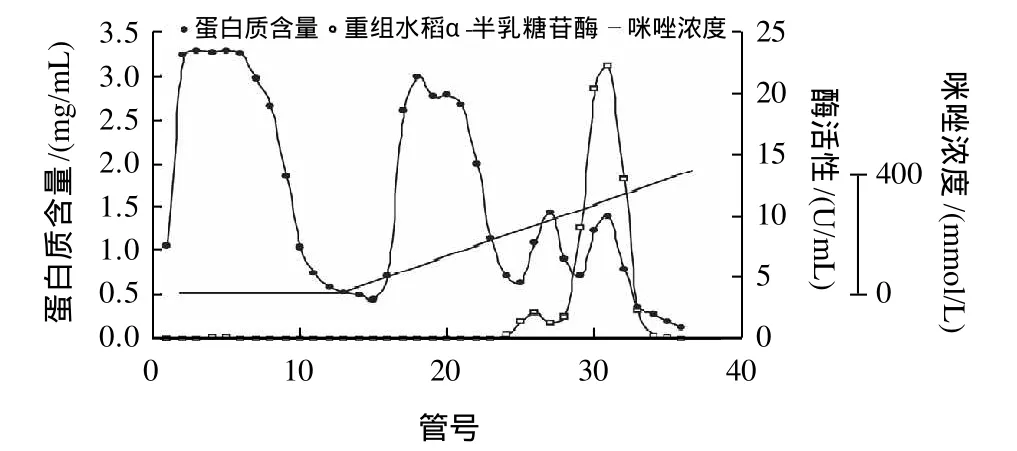
圖1 重組水稻α-半乳糖苷酶的鎳離子螯合柱親和純化Fig.1 Purification of recombinant riceα-galactosidase on Ni-Sepharose affinity column
經多次實驗比較,確定重組水稻α-半乳糖苷酶粗酶液在pH值為7的條件下,經HisTrap HP (鎳離子螯合柱)進行純化的效果最好,純化結果如圖1。
純化的酶經12.5%的SDS-PAGE電泳檢測,如圖2所示,純化后僅有一條單一的蛋白條帶,分子質量約為59kD,其上帶有Trx·Tag約17kD,因而估算天然水稻α-半乳糖苷酶的分子質量約為42kD,與CAZy數據庫的推算相吻合。
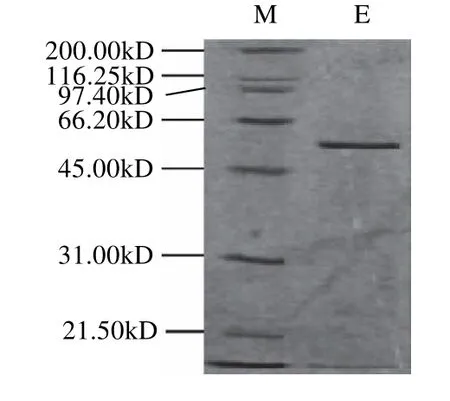
圖2 重組水稻α-半乳糖苷酶的SDS-PAGE電泳Fig.2 SDS-PAGE of recombinant riceα-galactosidase
重組水稻α-半乳糖苷酶的純化結果見表1,活力回收率為21.2%,純化倍數為29.7,純化酶的比活力為9.5U/mg。

表1 重組水稻α-半乳糖苷酶的純化Table 1 Results of purification of recombinant riceα-galactosidase
酶的快速純化一直都是酶工程研究中有待突破的難點。本實驗采用的大腸桿菌工程菌株pET-32a(+)-Gal/Origami DE可利用載體上固有的融合蛋白Trx·Tag使酶基因穩定高效表達,在此基礎上根據載體上特有的純化標簽,采用鎳離子親和層析技術對蛋白質進行了快速純化,經一步純化即得到純度較高的酶蛋白。
2.2 重組水稻α-半乳糖苷酶的酶學性質
2.2.1 酶的最適反應pH值及pH值穩定性
純化的重組水稻α-半乳糖苷酶在不同pH值緩沖液體系中,測定其酶活性結果如圖3所示,酶的最適反應pH值為5.0,當pH值大于5.5或小于4.5時,酶的活性都會急劇下降。該酶在不同的pH值緩沖液體系中,20℃中保溫1h,其pH穩定性如圖4所示,在pH4.0~7.0之間,保持著90%以上的酶活性。
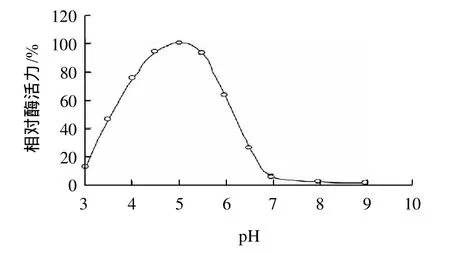
圖3 pH值對重組水稻α-半乳糖苷酶活性的影響Fig.3 Effect of pH on the activity of recombinant riceα-galactosidase
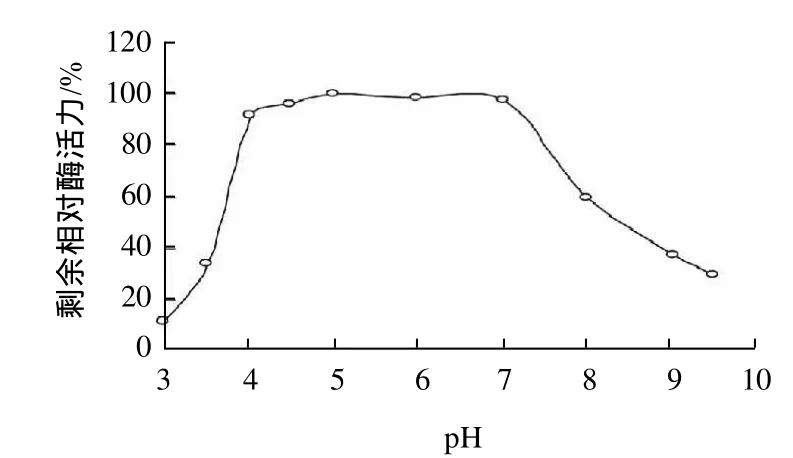
圖4 pH值對重組水稻α-半乳糖苷酶穩定性的影響Fig.4 Effect of pH on the stability of recombinant riceα-galactosidase
2.2.2 酶的最適反應溫度及熱穩定性
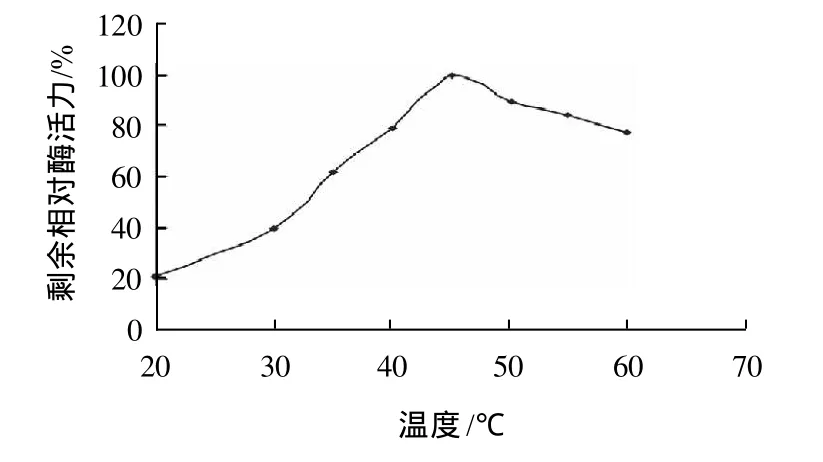
圖5 溫度對重組水稻α-半乳糖苷酶活性的影響Fig.5 Effect of temperature on the activity of recombinant riceα-galactosidase
在上述標準反應體系中,于20~60℃分別測定酶活力,結果如圖5所示,該酶的最適反應溫度為45℃。酶的熱穩定性實驗表明(圖6),該酶在0~20℃是穩定的,保溫1h后剩余相對酶活力仍為100%。保存溫度超過20℃,其熱穩定性急劇下降,大于40℃時酶活力喪失為0,對高溫頗為敏感。該酶在0~4℃,加入牛血清蛋白(2mg/mL)做保護劑的情況下,可保存數月酶活力不變。
2.2.3 不同金屬離子及有機離子對酶活力的影響
由表2可知,大部分的金屬離子及化合物對酶活力幾乎沒有影響,而Hg2+、Ag+及對酶活性有強烈抑制作用。Hg2+對α-半乳糖苷酶活性的抑制可以推測是由于酶分子結構中的半胱氨酸在酶的活性中心位置[11];Ag+對α-半乳糖苷酶活性的抑制則說明酶的活性中心可能存在具有羧基的氨基酸或組氨酸[12]。一些α-半乳糖苷酶的活性會被-SH基團抑制劑如pCMB所抑制,同樣pCMB對水稻α-半乳糖苷酶的酶活性也表現了強烈的抑制作用,這可能是因為該酶在活性中心或其附近存在巰基[13]。

表2 一些金屬離子及有機離子對重組水稻α-半乳糖苷酶活力的影響Table 2 Effects of organic and metal ions on the activity of recombinant riceα-galactosidase
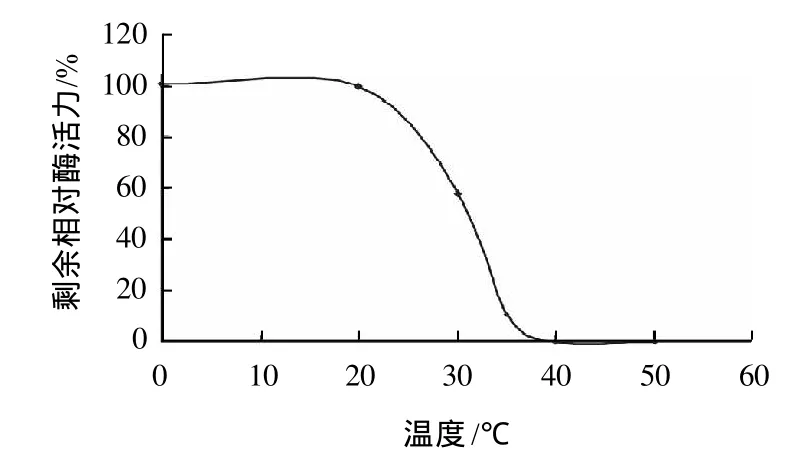
圖6 溫度對重組水稻α-半乳糖苷酶穩定性的影響Fig.6 Effect of temperature on the stability of recombinant riceαgalactosidase
2.2.4 酶動力學參數的確定
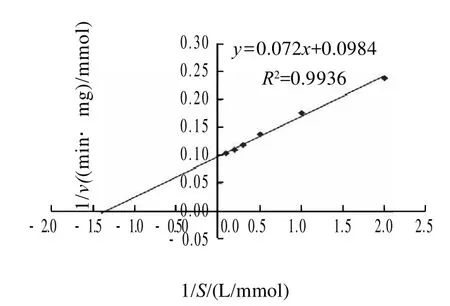
圖7 pNPG濃度與反應速率的Lineweaver-Burk雙倒數曲線Fig.7 Lineweaver-Burk plot of recombinant riceα-galactosidase
以pN P G作為底物,測定底物反應速率,用Lineweaver-Burk雙倒數作圖法(圖7)求得Km值為0.78mmol/L;Vmax為 10.16mmol /(mg·min)。
3 結 論
根據實驗得酶活力回收率為21.2%,純化倍數為29.7,純化酶的比活性為9.5U/mg。SDS-PAGE電泳檢測重組酶分子質量約為59kD,推測天然水稻α-半乳糖苷酶的分子質量約為42kD。酶的最適反應pH值為5.0,在pH4.0~7.0之間穩定性高。酶的最適反應溫度為45℃,分別在0~20℃保溫1h后剩余酶活力仍為100%,可在0~4℃長期保存。酶的動力學常數Km為0.78mmol/L,Vmax為10.16mmol/(mg·min)。 Hg2+、Ag+及-SH抑制劑pCMB對酶活性有強烈抑制作用。
[1] CHROST B, SCHMITZ K. Purification and characterization of multiple forms ofα-galactosidase inCucumis meloplants[J]. J Plant Physiol, 2000, 156:483-491.
[2] FUJIMOTO Z, KANEKO S, KIM W, et al. The tetramer structure of the glycoside hydrolase family 27α-galactosidase I fromUmbelopsis vinacea[J]. Bioscience, Biotechnology, and Biochemistry, 2009, 73(10):2360-2364
[3] 梁素鈺, 鄭學勤. 具血型轉換功能的咖啡α-半乳糖苷酶基因的克隆與表達[J]. 遺傳, 2005, 27(5):759-764.
[4] SIMERSKA P, MONTI D, CECHOVA I, et al. Induction and characterization of an unusual alpha-D-galactosidase fromTalaromyces flavus[J].J Biotechnol, 2007, 128(1):61-71.
[5] 許堯興, 李艷麗, 柳永, 等. 黑曲霉變種RM48α-半乳糖苷酶的分離純化及其酶學性質研究[J]. 浙江大學學報:農業與生命科學版,2009, 35(2):147-152.
[6] 楊冠東, 劉芳, 李荷.α-半乳糖苷酶的研究進展概況[J]. 現代食品科技, 2006, 22(3):275-279.
[7] ASANO N, ISHII S, KIZU H, et al.In vitroinhibition and intracellular enhancement of lysosomalα-galactosidase activity in Fabry lymphoblasts by 1-deoxygalactonojirimycin and its derivatives[J]. Eur J Biochem, 2000, 267(13):4179-4186.
[8] BEUTLER E, KUHL W. Purification and properties of humanαgalactosidases[J]. J Bio Chem, 1972, 247:7195-7200.
[9] International Rice Genome Sequencing Project. The map-based sequence of the rice genome[J]. Nature, 2005, 436:793-800.
[10] SUHONG L, WOOK-DONG K, KANEKO S, et al. Expression of rice(Oryza sativaL. var. Nipponbare) alpha-galactosidase genes inEscherichia coiland characterization[J]. Biosci Biotechnol Biochem, 2007, 71(2):520-526.
[11] FRIDJONSSON O, WATZLAWICK H, GEHWEILER A, et al. Cloning of the gene encoding a novel thermostableα-galactosidase fromThermusbrockianusITI3601[J]. Appl Environ Microbiol, 1999, 65(9):3955-3963.
[12] ZAPATER I, ULLAH A, WODZINSKI R. Extracellular alpha-galactosidase (EC 3.2.1.22) fromAspergillus ficuumNRRL 3135 purification and characterization[J]. Prep Biochem, 1990, 20(3/4):263-296.
[13] KONDOH K, MORISAKI K, KIM W, et al. Cloning and expression of the gene encodingStreptomyces coelicolorA3(2) alpha-galactosidase belonging to family 36[J]. Biotechnol Lett, 2005, 27(9):641-647.
Isolation, Purification and Characterization of Recombinantα-Galactosidase from Rice
LI Su-hong1,ZHU Min-peng1,LI Tuo-ping2,*
(1. College of Engineering and Technology, Shenyang Normal University, Shenyang 110034, China;2. College of Light Industry, Liaoning University, Shenyang 110036, China)
TS201.2
A
1002-6630(2010)21-0304-04
2010-06-28
遼寧省科技廳博士科研啟動資助項目(20081031);教育部歸國留學人員科研啟動基金項目
李蘇紅(1968—),女,副教授,博士,研究方向為食品生物技術。E-mail:leesuhong@126.com
*通信作者:李拖平(1967—),男,教授,博士,研究方向為應用糖質化學。E-mail:ltp0401@126.com

