N+注入誘變選育混合糖發酵L-乳酸高產菌株
龐 銳,潘麗軍*,姜紹通,吳學鳳
(合肥工業大學生物與食品工程學院,安徽 合肥 230009)
N+注入誘變選育混合糖發酵L-乳酸高產菌株
龐 銳,潘麗軍*,姜紹通,吳學鳳
(合肥工業大學生物與食品工程學院,安徽 合肥 230009)
采用低能N+注入技術對米根霉As3.819進行誘變選育,以提高該菌株利用混合糖(葡萄糖、木糖)發酵生產L-乳酸的能力。實驗結果表明,菌株的存活率曲線呈典型的“馬鞍型”,在注入劑量為50×2.5×1013ions/cm2時具有較高的正突變率。選育獲得突變株N50-7,其L-乳酸產量為79.42g/L,比出發菌株提高了17.75%,且遺傳穩定性較好。對突變株N50-7的發酵培養基進行了初篩,在混合糖150g/L(葡萄糖100g/L、木糖50g/L)、(NH4)2SO4 3.0g/L、KH2PO4 0.3g/L、MgSO4·7H2O 0.3g/L、ZnSO4·7H2O 0.4g/L的條件下發酵72h,L-乳酸產量最高達到103.81g/L,較初篩前提高了30.71%。
離子注入;米根霉;誘變育種;混合糖;L-乳酸
L-乳酸是一種重要的有機酸,在食品、飲料、飼料、現代醫藥、現代農藥、日用化工、造紙及電子等行業具有廣泛的應用前景,是21世紀最具發展前途的有機酸之一[1-2]。隨著以L-乳酸為原料,制成可生物降解的新型環保材料——聚乳酸(PLA)加工和應用技術的進步[3-4],作為原料的L-乳酸受到了人們的廣泛關注,已成為當今世界最熱門的生化產品之一,市場需求量巨大[2]。
木質纖維原料是地球上最豐富且價廉的可再生資源,水解得到同時含有葡萄糖和木糖等單糖的混合糖,是潛在的重要生物轉化原料[5-7],對于降低L-乳酸生產成本具有重要意義。然而傳統發酵技術是建立在利用淀粉質原料的基礎上,對五碳糖利用度低。因此,篩選混合糖高效利用菌株,研究混合糖條件下微生物定向生物合成,是利用廉價可再生資源獲得能源產品和化學品的重要方向[8]。
離子注入誘變育種是集化學誘變、物理誘變為一體的綜合誘變方法,不僅影響細胞的生理生化功能,還可使細胞中的染色體畸變、導致DNA鏈堿基的損傷、斷裂,從而使遺傳物質在基因水平或分子水平上發生改變或缺失。因此,其能夠在低劑量注入的情況下顯著提高生物的變異率,獲得損傷輕、突變率高、突變譜廣、遺傳穩定的誘變效果[9-11]。離子注入技術被廣泛地應用于微生物優良菌株的選育和改良研究中,為篩選高效的正突變菌株提供了廣闊的空間。
本工作擬利用N+注入的方式對實驗室保藏菌株米根霉As3.819進行誘變處理,篩選能夠利用混合糖發酵高產L-乳酸的米根霉菌株,并對發酵培養基進行初篩,以獲得米根霉利用混合糖發酵L-乳酸的適宜條件,為木質纖維原料生產L-乳酸打下良好的基礎。
1 材料與方法
1.1 菌種
米根霉(Rhizopus oryzae)As3.819 本實驗室保藏。
1.2 培養基
斜面保藏培養基:PDA培養基。
篩選培養基:葡萄糖平板(g/L):葡萄糖20、馬鈴薯200、瓊脂20、溴甲酚綠0.1、pH值自然;木糖平板(g/L):木糖20、馬鈴薯200、瓊脂20、溴甲酚綠0.1、pH值自然。
種子培養基(g/L):葡萄糖80、(N H4)2SO44、KH2PO40.3、ZnSO4·7H2O 0.44、MgSO4·7H2O 0.25、CaCO310(單獨滅菌),pH值自然。
初始發酵培養基(g/L):葡萄糖80、木糖40、(NH4)2SO44、KH2PO40.3、ZnSO4·7H2O 0.25、MgSO4·7H2O 0.35、CaCO360(單獨滅菌),pH值自然。
以上培養基皆于121℃滅菌15min。
1.3 培養方法
斜面及平板培養:32℃恒溫培養箱中培養3~5d。
液體種子培養:100mL三角瓶裝液量20%,接種孢子懸液(濃度為1×106個/mL)2mL,搖床轉速200r/min,32℃振蕩培養16h。
搖瓶發酵培養:250mL三角瓶裝液量20%,接種量10%,32℃、200r/min振蕩培養72h。
1.4 低能N+注入工藝與樣品處理
取新鮮活化斜面,用無菌水洗脫后制成濃度為1× 107個/mL的孢子懸液,吸取0.1mL均勻涂布于無菌培養皿上,以無菌風吹干后進行N+注入。離子注入在中國科學院等離子體物理研究所進行,N+能量為15keV,注入劑量為0(對照)~2.5×1015ions/cm2,真空度為10-3Pa。離子注入后,將經N+注入的培養皿和真空對照的培養皿分別用1mL無菌水洗脫,適當稀釋后各取0.1mL涂布于PDA平板上,置32℃條件下倒置培養3~4d,用于單菌落的挑選和存活率的計算。
1.5 離子注入誘變效果的計算
1.5.1 存活率的計算
采用菌落計數法。分別統計真空對照組和離子注入組的菌落總數,按式(1)計算。

1.5.2 突變率的計算
挑取離子注入后的單菌落分別進行發酵實驗,測試各菌株發酵混合糖的L-乳酸產量,以出發菌株作為對照,L-乳酸產量比出發菌株提高5%的視為正突變,降低5%的視為負突變,在±5%之間的視為未突變。根據L-乳酸產量分別計算正突變率、負突變率和總突變率。按式(2)、(3)、(4)計算。

1.6 檢測方法
1.6.1 L-乳酸含量的測定
采用EDTA定鈣法[12]。
1.6.2 發酵液中殘糖的測定
采用DNS與HPLC相結合的方法。
DNS法:殘糖以葡萄糖計。發酵液經8000r/min離心10min后,取上清液,采用DNS顯色法[13]測定殘糖的質量濃度。HPLC法:色譜儀型號為Waters e2695,色譜柱為Waters Carbohydrate Analysis Column(3.9mm× 300mm),檢測器為Waters 2424(ELS Detector),進樣量為10μL,流動相流速為1mL/min。流動相:75%乙腈-25%水;柱溫30℃。
1.6.3 生物量的測定
采用菌體干質量法[13]。
1.7 實驗設計
1.7.1 N+注入誘變利用混合糖發酵L-乳酸高產突變株的篩選
通過計算N+注入后各劑量下菌株的致死率和正突變率,確定N+注入該菌株的最佳誘變劑量。在該劑量下對菌株反復誘變,依次通過葡萄糖平板、木糖平板對菌株進行初篩,以獲得既能利用葡萄糖又能利用木糖高產L-乳酸的米根霉菌株。將各菌落的變色圈與原始菌株的變色圈相比,挑選變色圈大的保藏在PDA斜面上,用于搖瓶復篩。對復篩獲得的L-乳酸高產菌株進行遺傳穩定性的研究。
1.7.2 高產菌株的培養基篩選
以玉米秸稈為例,其充分水解得到的混合糖中葡萄糖和木糖的質量比約為2:1[7-8,14],因此本實驗混合糖發酵培養基中葡糖糖和木糖以2:1的比例添加。分別對糖濃度、氮源種類、氮源濃度、磷酸鹽種類、磷酸鹽濃度、鎂離子濃度、鋅離子濃度各因素進行單因素試驗篩選,以確定高產菌株利用混合糖發酵L-乳酸的適宜培養基組成。
2 結果與分析
2.1 N+注入篩選混合糖發酵L-乳酸的高產突變株
2.1.1 誘變劑量
對米根霉As3.819采用N+注入誘變,在15keV注入能量下,統計不同劑量的存活菌落數。以0劑量存活菌落數為對照,計算各注入劑量的存活率,繪制存活率曲線見圖1。分別在不同劑量下挑取一定量的單菌落進行搖瓶發酵,測定L-乳酸產量,同時與出發菌株對照計算突變率,其結果見圖2。
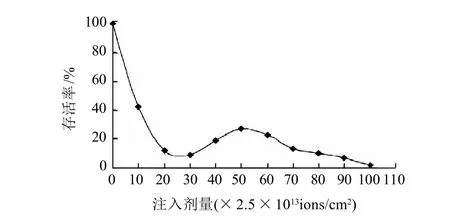
圖1 N+注入對菌體存活率的影響Fig.1 Survival rate of Rhizopus oryzae As3.819 implanted with N+ ions
由圖1可見,當N+注入劑量低于20×2.5×1013ions/cm2時,菌體的存活率隨著注入劑量的增大而迅速降低;當劑量達到30×2.5×1013ions/cm2后,存活率有短暫的回升,并在50×2.5×1013ions/cm2時達到最大值;此后隨著注入劑量的增加,菌體的存活率逐漸下降,整個過程呈“馬鞍型”變化曲線。出現這種現象的原因可能是:低劑量的N+注入時,能量沉積效應和動量轉移效應的綜合作用,導致了DNA損傷和生物膜等大分子的損傷,造成了存活率的下降;中高劑量注入時存活率上升,可能是N+注入后電荷積累發揮了作用,激活了細胞的修復機制和修復酶;高劑量N+注入時,細胞損傷程度大于其修復能力,電荷效應也由于達到了臨界值而產生庫侖爆炸,保護屏障消失[15-17]。
圖2顯示,隨著注入劑量的增加,菌株的突變率也隨之增加;而正突變率則隨著注入劑量的增加呈現先增大后減小的趨勢,在50×2.5×1013ions/cm2時菌株的正突變率最高;超過此劑量后,雖然菌體的突變率繼續增加,但正突變率呈下降趨勢。另外,在該注入劑量下菌體的負突變率低于正突變率,表明以該劑量進行離子注入可獲得較多的正突變株,有利于篩選工作的進行。
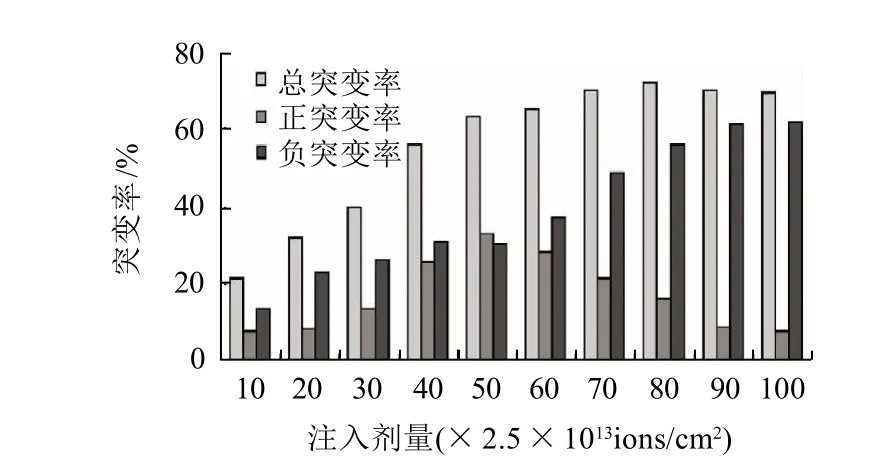
圖2 N+注入對菌株突變率的影響Fig.2 Effect of implantation dose of N+ ions on positive, negative and total mutant rate of Rhizopus oryzae As3.819
綜上所述,N+注入劑量在50×2.5×1013ions/cm2時,菌株的存活率為27.30%,且此劑量下菌株的正突變率最高。現代育種理論認為:被誘變微生物的致死率在75%左右即存活率在25%左右時產量性狀的正突變率較高,當在更高的致死率下,雖然突變率可能較高,但是負突變往往很高,而正突變卻很低[18]。實驗結果與該理論基本相符。因此,本實驗選擇N+注入的誘變劑量為50×2.5×1013ions/cm2。
2.1.2 誘變篩選的高產菌株及遺傳穩定性
采用最佳注入劑量50×2.5×1013ions/cm2對米根霉As3.819進行N+注入誘變處理,按照1.7.1節中所述的方法篩選高產菌株。將初篩獲得的48株菌進行搖瓶發酵試驗,測定L-乳酸產量,得到了3株高產突變株。此3株菌的L-乳酸產量均比原始菌株提高了10%以上,分別命名為N50-7、N50-13和N50-36。
為了確保篩選到的高產突變株的遺傳穩定性,對以上實驗中獲得的3株高產菌株進行連續傳代實驗。各菌株每傳一代重復3個搖瓶發酵測定L-乳酸產量,各代產量的平均值見表1。

表1 高產突變株的遺傳穩定性Table 1 Genetic stability of three high-yield mutant strains
從表1可以看出,菌株N50-7的L-乳酸產量較高,且一直保持在79.40g/L左右,遺傳特征穩定;而菌株N50-13開始的L-乳酸產量也比較高,但傳6代后產酸性能有所改變,L-乳酸產量迅速下降;菌株N50-36雖然具有很好的遺傳穩定性,但其L-乳酸產量較其他兩個菌株低。因此,選擇N50-7作為利用混合糖發酵生產L-乳酸的米根霉菌株進行進一步的研究。該菌株利用混合糖發酵L-乳酸的平均產量為79.42g/L,比出發菌株(67.45g/L)提高了17.75%。
2.2 高產菌株發酵的培養基篩選
2.2.1 種齡對發酵的影響
在L-乳酸發酵中選擇適當的種齡非常重要,過老或太年輕的種子都會對發酵產生不利影響。太年輕的種子接種后使菌種前期的生長緩慢,發酵周期延長,產酸低。過老的種子雖然菌體量較多,但會出現菌體過早衰退的現象,最終導致產酸能力下降[19]。因此,首先根據1.2.3節方法繪制米根霉N50-7菌體生長曲線,其結果見圖3。
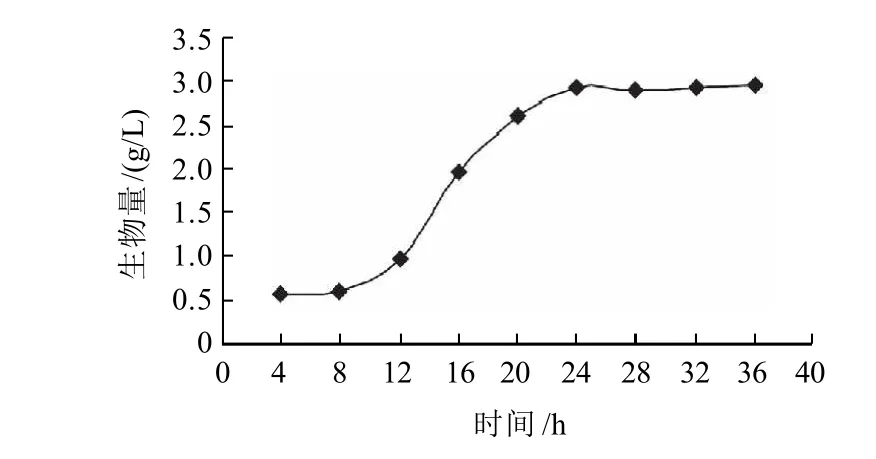
圖3 菌體生長曲線Fig.3 Growth curve of N50-7
由圖3可知,該菌種在培養12h左右開始進入對數生長期,之后菌體數量迅速增加;24h后菌體數量趨于穩定,進入穩定期。可見,該菌株的對數生長期應在12~24h。考慮到一般選用種齡在菌體處于分裂旺盛的對數生長中后期的菌種為宜,選擇了12~36h范圍內7個時間點的種子液進行搖瓶發酵實驗,其結果見圖4。
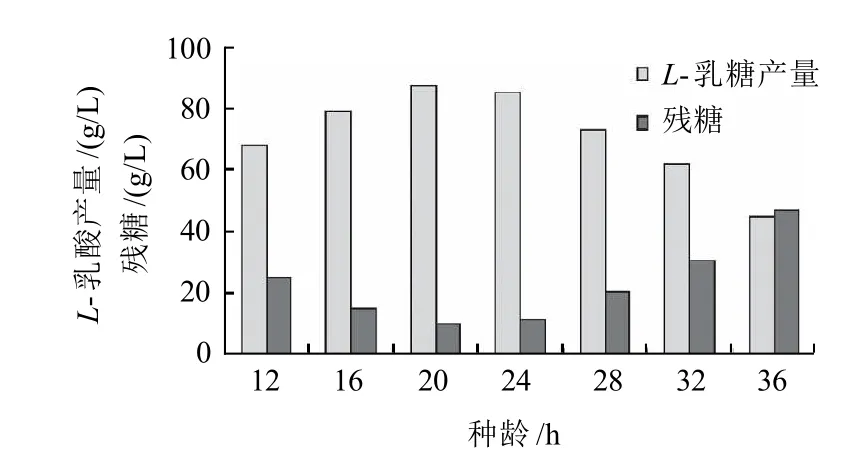
圖4 種齡對L-乳酸產量的影響Fig.4 Effect of seed age on L-lactic acid production
從圖4可以看出,采用20~24h的種子液發酵,糖消耗的較完全,L-乳酸產量較高。而采用過早或過晚的種子,L-乳酸的產量都較低。因此采用培養20h的種子液接種發酵最好,后續實驗均采用培養20h的種子液進行發酵實驗。
2.2.2 混合糖質量濃度對L-乳酸產量的影響
葡萄糖與木糖按質量比2:1,選擇不同的混合糖濃度進行發酵實驗。在初始發酵培養基中添加混合糖質量濃度分別為90、120、150、180g/L,觀察比較碳源濃度對L-乳酸產量的影響,結果見圖5(殘糖以葡萄糖計,計算轉化率)。
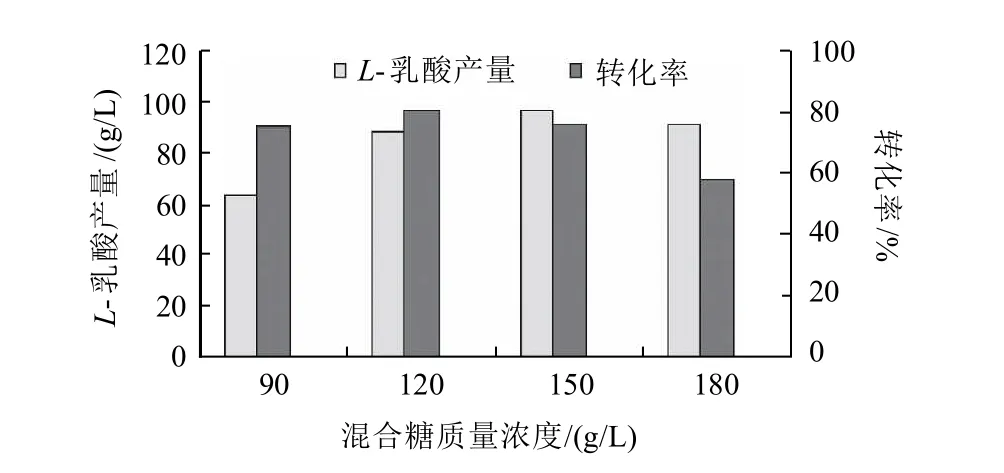
圖5 混合糖質量濃度對L-乳酸產量的影響Fig.5 Effect of total concentrations of glucose and xylose on L-lactic acid production
由圖5可知,混合糖質量濃度在90~150g/L范圍內,隨著葡萄糖、木糖質量濃度的增加,L-乳酸的產量增加。當混合糖質量濃度為120g/L時,轉化率最高,原料利用充分,但產酸量偏低;當混合糖濃度為150g/L時,產酸量最高,但轉化率稍有下降;當混合糖質量濃度上升到180g/L時,產酸量有所下降且轉化率明顯減小。綜合考慮,實驗選用混合糖質量濃度為150g/L,其中葡萄糖100g/L,木糖50g/L。
2.2.3 氮源種類對L-乳酸產量的影響
選取NH4Cl、(NH4)2SO4、NH4NO3、尿素4種氮源,按照碳氮比180:1分別添加進行發酵實驗,研究不同氮源對L-乳酸產量的影響,結果見圖6。
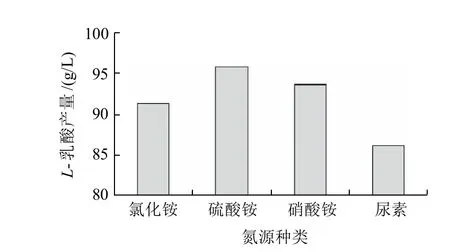
圖6 氮源種類對L-乳酸產量的影響Fig.6 Effect of nitrogen type on L-lactic acid production
由圖6可知,(NH4)2SO4作為氮源的乳酸產量最高,NH4NO3次之。實驗最終選用(NH4)2SO4作為培養基中的氮源。
2.2.4 硫酸銨質量濃度對L-乳酸產量的影響
分別添加1.0、2.0、3.0、4.0、5.0、6.0g/L的硫酸銨進行發酵實驗,考察硫酸銨質量濃度對L-乳酸產量的影響,結果見圖7。
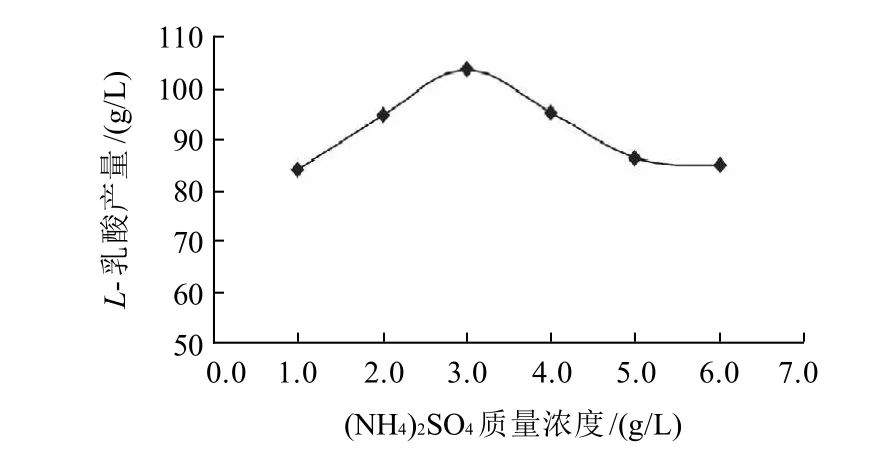
圖7 硫酸銨質量濃度對L-乳酸產量的影響Fig.7 Effect of (NH4)2SO4 concentration on L-lactic acid production
由圖7可知,低質量濃度的(NH4)2SO4對發酵產L-乳酸有明顯的促進作用,(NH4)2SO4質量濃度越高,L-乳酸產量越高。當培養基中(NH4)2SO4質量濃度高于3.0g/L后,L-乳酸產量減小,所以(NH4)2SO4質量濃度初步確定為3.0g/L。
2.2.5 磷酸鹽種類對L-乳酸產量的影響
選擇KH2PO4、NH4H2PO4、NaH2PO4、Ca3(PO4)24種磷酸鹽作為此菌種磷元素的提供者進行發酵實驗,結果見圖8。
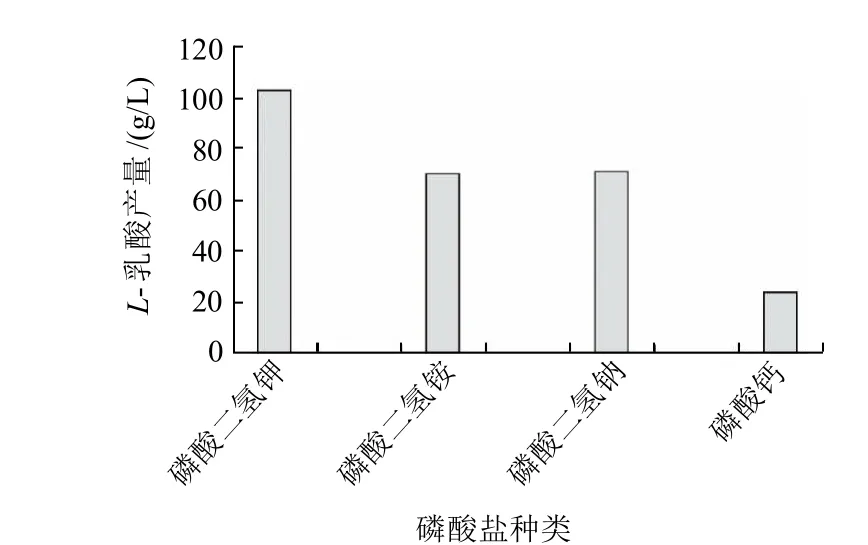
圖8 磷酸鹽種類對L-乳酸產量的影響Fig.8 Effect of phosphate type on L-lactic acid production
比較發酵結束后產酸量(圖8)可知,KH2PO4作為磷酸鹽優于其他幾種磷酸鹽。因此,實驗最終選用KH2PO4作為培養基中的磷酸鹽離子。
2.2.6 KH2PO4質量濃度對L-乳酸產量的影響

圖9 KH2PO4質量濃度對L-乳酸產量的影響Fig.9 Effect of KH2PO4 concentration on L-lactic acid production
分別添加0.1、0.2、0.3、0.4、0.5g/L的KH2PO4進行發酵實驗,考察KH2PO4質量濃度對L-乳酸產量的影響,結果見圖9。
由圖9可知,隨著KH2PO4初始質量濃度增大到0.3g/L,L-乳酸產量都會隨之增大。超過這個磷酸鹽添加量,L-乳酸產量反而會有所降低。因此,確定添加KH2PO4的最佳初始濃度為0.3g/L。
2.2.7 MgSO4·7H2O、ZnSO4·7H2O質量濃度對發酵產L-乳酸的影響
微生物在生長發酵過程中,需要磷、鎂、硫、鐵、鉀、鋅等元素作為酶的激活劑、生理活性物質的組成或生理活性作用的調節劑[19]。分別采用0.1~0.5g/L的MgSO4·7H2O和ZnSO4·7H2O進行搖瓶發酵實驗,研究不同質量濃度的ZnSO4·7H2O、ZnSO4·7H2O對L-乳酸產量的影響,結果見圖10。
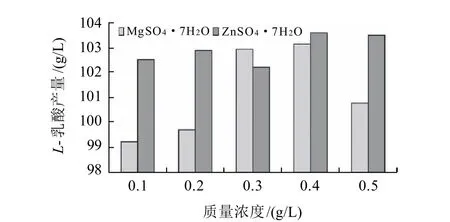
圖10 MgSO4·7H2O、ZnSO4·7H2O質量濃度對L-乳酸產量的影響Fig.10 Effects of MgSO4·7H2O and ZnSO4·7H2O concentrations on L-lactic acid production
由圖10可知,當MgSO4·7H2O和ZnSO4·7H2O質量濃度分別為0.4g/L時,L-乳酸產量達到最大值;而質量濃度大于0.4g/L時,L-乳酸產量開始下降。分析其原因,應該是Mg2+和Zn2+在低質量濃度時,可以激活代謝途徑中某些關鍵酶的活性,對細胞生長和產物合成有促進作用,而高質量濃度時則有抑制作用。考慮到MgSO4·7H2O在質量濃度為0.3~0.4g/L時,L-乳酸的產量相差甚微,從經濟角度出發,最終選取MgSO4·7H2O質量濃度為0.3g/L,ZnSO4·7H2O質量濃度為0.4g/L。
2.3 高產菌株的發酵特性
將經N+注入篩選獲得的利用混合糖發酵L-乳酸的高產菌株N50-7按照以上實驗得到的培養基組分進行發酵培養,每隔6h取樣檢測繪制發酵曲線,其結果見圖11。
乳酸發酵屬于初級代謝過程,由圖11可以看出,隨著生物量的積累,L-乳酸產量迅速增長;葡萄糖從6h開始用于產酸,42h時剩余量已很少,繼而木糖開始被大量利用,產酸量也有明顯的提高。72h達到發酵終點時,L-乳酸的產量為103.81g/L,較培養基初篩前提高了30.71%。

圖11 高產菌株發酵過程曲線Fig.11 Time courses of L-lactic acid production, glucose and xylose residues and cell biomass
3 結 論
本試驗利用N+注入技術對L-乳酸生產菌株——米根霉As3.819進行誘變處理,經不同劑量的N+注入后,菌株的存活率呈典型的“馬鞍型”曲線。在15keV、最佳注入劑量50×2.5×1013ions/cm2下,篩選得到1株具有良好遺傳穩定性的高產突變株N50-7,其利用混合糖發酵L-乳酸的產量為79.42g/L,較出發菌株提高了17.75%。與此同時,對N50-7的發酵培養基進行了初步篩選,實驗結果顯示,在葡萄糖100g/L、木糖50g/L、(NH4)2SO43g/L、KH2PO40.3g/L、MgSO4·7H2O 0.3g/L、ZnSO4·7H2O 0.4g/L的條件下發酵72h,L-乳酸產量達到103.81g/L,較培養基初篩前提高了30.71%。本研究可為今后利用木質纖維原料生產L-乳酸提供參考,具有較好的社會效益及經濟效益。
[1] 楊萍. L-乳酸的生產及其應用研究[J]. 科技信息, 2008(17): 31.
[2] 王立梅, 齊斌. L-乳酸應用及生產技術研究進展[J]. 食品科學, 2007, 28(10): 608-612.
[3] 李宏清, 吳宏偉, 武旭業, 等. 最佳綠色環保塑料: 聚乳酸塑料的發展趨勢[J]. 法制與社會, 2007(11): 922.
[4] 任宗禮. 聚乳酸及其共聚物的應用現狀[J]. 甘肅科技, 2008, 24(7): 68-73.
[5] 侯艷梅, 蔣立文, 江均平, 等. 利用木質纖維素生產L-乳酸的研究[J]. 農產品加工: 學刊, 2007(11): 27-30.
[6] MARTIN C, GALBE M, WAHLBOM C F, et al. Ethanol production from enzymatic hydrolysates of sugarcane bagasse using recombinant xylose-utilising Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2002, 31(3): 274-282.
[7] 宋安東, 王風芹, 杜風光, 等. 戊糖和己糖共發酵生產燃料乙醇條件研究[J]. 生物學雜志, 2007, 24(2): 17-21.
[8] 孔祥莉, 劉波, 趙宗保, 等. 斯達氏油脂酵母利用混合糖發酵產油脂[J]. 生物加工過程, 2007, 5(2): 36-41.
[9] FENG Huiyun, YU Zengliang, CHU P K. Ion implantation of organisms [J]. Materials Science and Engineering, 2006, 54(3/4): 49-120.
[10] SONG Yun, ZHANG Huaiyu, CHANG Zhijian. Progress of mutation breeding with ion beam implantation[J]. Molecular Plant Breeding, 2004, 2(2): 301-305.
[11] 張曉勇, 陳秀霞. 低能離子誘變育種作用機理及生物學效應研究進展[J]. 廣東農業科學, 2008(6): 20-22.
[12] 姜紹通, 鄭志, 朱羽, 等. 無載體固定化米根霉重復間歇發酵生產L-乳酸[J]. 生物工程學報, 2008, 24(10): 1729-1733.
[13] 朱羽. 無載體固定化米根霉發酵L-乳酸的研究[D]. 合肥: 合肥工業大學, 2007.
[14] WYMAN C E, DALE B E, ELANDER R T, et al. Coordinated development of leading biomass pretreatment technologies[J]. Bioresource Technology, 2005, 96(18): 1959-1966.
[15] 宮春波, 劉鷺, 謝麗源, 等. 離子注入微生物誘變育種研究進展[J].生物技術, 2003, 13(2): 47-49.
[16] YU Long, ZHOU Jian, YU Zengliang. Screening of L-lactic acid producing bacteria by low energy ions implantation and preliminary research of fermentation conditions[J]. 激光生物學報, 2005, 14(3): 184-188.
[17] ZHOU Xiaonan,YE Hui, ZHU Suwen, et al. Screening high-yield bacteria Rhizopus chinensis carrying L-lactic acid by low energy ions implantation[J]. 激光生物學報, 2008, 17(3): 408-411.
[18] 錢海倫. 微生物學[M]. 北京: 中國醫藥工業出版社, 1990.
[19] 孫靚, 孫菲菲, 黃艷燕, 等. 木薯淀粉發酵生產L-乳酸的培養條件優化[J]. 中國釀造, 2009(7): 33-37.
Breeding of High-yield L-Lactic Acid Strains for Co-fermentation of Glucose and Xylose by N+Implantation
PANG Rui,PAN Li-jun*,JIANG Shao-tong,WU Xue-feng
(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
In order to increase the production of L-lactic acid by co-fermentation of glucose and xylose, Rhizopus oryzae As3.819 was mutated by low energy N+ implantation. The results showed that the survival rate curve was a typical, , saddle shape , , with a high positive mutation rate at a dose of 50×2.5×1013ions/cm2. Under this implantation dose, strain N50-7 was obtained with high yield and stability. L-lactic acid yield by N50-7 was 79.42 g/L, 17.75% higher than the original strain. The optimal composition of fermentation medium for N50-7 were as follows: glucose 100 g/L, xylose 50 g/L, (NH4)2SO4 3 g/L, KH2PO4 0.3 g/L, MgSO4·7H2O 0.3 g/L and ZnSO4·7H2O 0.4 g/L. The final concentration of L-lactic acid was 103.81g/L after 72 h fermentation, which was 30.71% higher than that before breeding.
ion implantation;Rhizopus oryzae;mutation breeding;mixed sugars;L-lactic acid
Q815
A
1002-6630(2010)21-0248-06
2010-08-12
國家“863”計劃項目(2007AA10Z361);安徽省自然科學基金項目(090411015)
龐銳(1986—),女,碩士研究生,研究方向為食品現代加工理論、方法及工程化技術。E-mail:pangrui2008_happy@126.com
*通信作者:潘麗軍(1955—),女,教授,博士,研究方向為農產品資源綜合利用。E-mail:panlijun1955@163.com

