鹽對甲醇微觀結構的影響
余小春 林 珂 胡乃銀 周曉國 劉世林
(中國科學技術大學化學物理系,合肥微尺度物質科學國家實驗室(籌),合肥 230026)
鹽對甲醇微觀結構的影響
余小春 林 珂 胡乃銀 周曉國 劉世林*
(中國科學技術大學化學物理系,合肥微尺度物質科學國家實驗室(籌),合肥 230026)
利用拉曼光譜研究鹽對甲醇微觀結構的影響.比較了不同鹽/甲醇體系的O—H伸縮譜段和C—O伸縮譜段的超額拉曼光譜,對比給出了陰、陽離子與甲醇的相互作用.O—H伸縮譜段的超額拉曼光譜明顯地顯示了陰離子與甲醇形成弱氫鍵,氫鍵強度排序為CH3OH-CH3OH>Cl--CH3OH>NO-3-CH3OH>ClO-4-CH3OH,在這個波段內,基本觀察不到陽離子與甲醇的相互作用.在C—O伸縮譜段內,陰陽離子均有顯著的體現,且與它們作用的甲醇C—O伸縮振動頻率有如下的關系:CH3—OH(陰離子)<CH3—OH(體相)<CH3—OH(陽離子).根據C—O伸縮譜段的超額拉曼光譜,擬合了該譜段的拉曼光譜,由分解的譜峰強度得到陰、陽離子第一溶劑化層中甲醇分子的數目,結果顯示在該濃度(~0.005)下離子對第一溶劑化層以外的甲醇氫鍵網絡結構沒有明顯影響.
拉曼光譜; 陰離子; 陽離子; 甲醇; 第一溶劑化層
鹽溶液在科學和技術領域有著重要的作用[1-2],其中非水介質的溶液由于在電池等領域有著很好的應用前景,它們的溶劑化結構和性質引起了化學家廣泛的興趣.理解鹽溶液的微觀結構可以幫助理解其宏觀性質,也可以幫助合理地利用鹽溶液.對于各種非水溶液中的宏觀性質、微觀相互作用、微觀結構及它們的聯系,前人有大量的研究.在非水溶劑中,醇由于其獨特的氫鍵網絡結構,備受人們關注[3-9].
有大量的技術被用于研究鹽溶液結構,例如紅外/拉曼光譜、X射線衍射、中子衍射、分子模擬、從頭計算等方法.其中很多的工作都是利用拉曼光譜,因拉曼光譜可以研究陰離子對醇氫鍵網絡結構的影響[3-8],例如Yamauchi等測量了LiCl/乙醇溶液[3]和LiX(X=Cl-、Br-、I-)/甲醇溶液的拉曼光譜[4],認為Cl-與乙醇形成氫鍵時,其O—H伸縮頻率為3373 cm-1, Cl-與甲醇形成氫鍵時其 O—H伸縮頻率為3385 cm-1,該甲醇分子同時與Li+結合時其O—H伸縮頻率為3300 cm-1.Kanno等[5]利用LiX/甲醇的拉曼光譜提出鹵代鋰破壞甲醇氫鍵結構程度的順序為: LiCl<LiBr<LiI.Honshoh等[6]研究了Cl-與一系列醇的相互作用,他們發現與Cl-形成氫鍵的醇的O—H伸縮頻率會隨著醇的烷基基團增大而向低波數移動,并認為這種移動是由烷基的質量而不是氫鍵強度引起的.除了這些鹵素陰離子,還有其它的陰離子也有討論,例如Kanno等[7]提到了ClO-4能破壞醇的氫鍵網絡結構,同時在ClO-4離子周邊形成新的氫鍵網絡結構.Hidaka等[8]進一步利用拉曼光譜比較了幾種陰離子對甲醇、乙醇微觀結構的破壞程度,認為該破壞程度的順序為:CH3COO-<Cl-<Br-<I-<ClO-4.他們都沒有利用拉曼光譜給出這些陰離子第一溶劑化層中醇分子的數目,而這個數目是大家尤為關心的內容.
相對陰離子而言,陽離子對氫鍵網絡結構的影響很難使用拉曼光譜研究,所以常利用其它技術討論陽離子與醇的相互作用.例如Symons等[10]通過紅外(IR)和核磁共振(NMR)的關系提出Li+、Na+、Mg2+周圍結合甲醇分子的數目分別為4、(5±1)、6. Mochizuki等[11]通過飛行時間(TOF)質譜提出Li+周圍結合1-3個甲醇分子,并認為當加入相反電荷的離子時,Li+周圍的甲醇分子數會減少.除了這些實驗方法,理論計算也被用于討論陽離子與醇的相互作用.Jorgensen等[12]利用蒙特卡羅模擬提出每個Na+結合6個甲醇分子.ImPey[13]和Pagliai[14]等利用分子動力學模擬方法確定了Li+周圍結合甲醇分子的數目是4.Torii[15]利用從頭量子化學計算的方法也認為Li+結合甲醇分子的數目是4.
拉曼光譜作為無破壞性的技術手段,被廣泛用于討論各種液體的微觀結構.最近我們組[16]利用拉曼光譜研究了甲醇的微觀結構,認為3-5個甲醇分子通過氫鍵締合形成鏈狀或者環狀結構構成液體甲醇.在本文中,我們同樣利用拉曼光譜來研究陰、陽離子對甲醇微觀結構的影響.由于甲醇O—H伸縮譜段的拉曼光譜主要反映陰離子與甲醇的相互作用[3-4],因此我們還利用甲醇的C—O伸縮譜段來討論陽離子與甲醇的相互作用,這段光譜同樣也被廣泛地用于討論甲醇的氫鍵結構[17-19].這里我們主要關心離子與甲醇的相互作用,所以必須排除溶液中離子與離子的相互作用,在較高濃度的溶液中才有各種離子對[20-21],如溶劑分隔的離子對,直接接觸的離子對,離子對的多聚體,所以溶液的濃度必須足夠小,但是濃度很低時,測得的信號主要反映的是體相甲醇,較少體現離子與甲醇的相互作用,這樣就很難通過直接分析拉曼光譜來了解離子對甲醇微觀結構的影響.這里采用了超額光譜[22-25]這一手段來分析測量的拉曼光譜.通過超額光譜分析了離子與甲醇的相互作用,并利用C—O伸縮譜段的拉曼光譜得到了陰、陽離子第一溶劑化層中甲醇分子的數目.
1 實驗方法
甲醇(>99.8%,上海振興化學公司)沒有進一步純化直接使用.無水LiClO4(>99%,Sigma Aldrich)、NaClO4(>98%,Sigma Aldrich)、Mg(ClO4)2·6H2O(>99%,SigmaAldrich)、LiNO3(>98%,上海恒信化工廠)、LiCl(>97%,嘉善巨楓化工廠)、NaCl(>99.5%,國藥集團化學試劑有限公司),這些鹽在使用前(除了LiClO4),均在真空干燥箱內加熱24 h,溫度恒定為373.15-393.15 K,以去除鹽中少量的水分,而后儲存在干燥箱中備用.
研究的鹽溶液是 LiClO4、NaClO4、Mg(ClO4)2、LiCl、NaCl、LiNO3的甲醇溶液.為了避免溶液中形成離子對,鹽的摩爾分數均約為0.005.對于Mg(ClO4)2的甲醇溶液,為了保持其陰離子濃度與其它鹽溶液一致,其摩爾分數約為0.0025.
拉曼光譜測量采用背向散射,實驗具體細節詳見文獻[16,26-27],以半導體固體激光器(Coherent, VerdI-5W,USA)產生的532 nm連續激光為光源,其偏振方向由格蘭棱鏡和λ/2波片調整為垂直于散射平面,并由焦距f=5 cm的石英透鏡聚焦于比色皿內的樣品.拉曼散射光經由焦距f=5 cm和f=20 cm的石英透鏡組收集、退偏器退偏并成像會聚于三級聯動單色儀(Princeton Instruments,Acton TriplePro,USA),最后由液氮冷卻的電荷耦合元件(CCD)(PrincetonInstruments,Spec-10:100B,USA)記錄數據.拉曼光譜位移均經汞原子的標準線校準.比色皿置于恒溫槽中,且保持溫度為25(±1)℃.我們測量了這些溶液的O—H伸縮譜段(3000-3700 cm-1)和C—O伸縮譜段(980-1100 cm-1)的拉曼光譜.
2 結果與討論
2.1 實驗光譜
我們測量了純甲醇和鹽/甲醇溶液的O—H和C—O伸縮譜段的拉曼光譜.圖1給出了純甲醇及LiClO4/甲醇溶液的拉曼光譜.由于鹽的濃度非常小,所以鹽/甲醇溶液的光譜和純甲醇的光譜非常相似,但是也可以看出一些差別,例如LiClO4/甲醇溶液的O—H伸縮振動譜峰在低波數(~3300 cm-1)的強度比純甲醇的要略弱(圖1(a)),這意味著由于離子與甲醇的相互作用,使得LiClO4/甲醇溶液中體相甲醇會減少,而在高波數(~3540 cm-1)LiClO4/甲醇溶液的光譜強度比純甲醇的要略強,這表明了LiClO4/甲醇溶液中有某些成分增加,體現了離子與甲醇的相互作用.在C—O伸縮譜段的拉曼光譜(圖1(b))中,主要體現了甲醇信號的減弱,這也是由于離子與甲醇的相互作用使得體相甲醇減少.這些譜圖的差別都很小,所以很難從譜圖中直接看出與離子直接相互作用的甲醇信號.之前,利用拉曼光譜討論離子與醇的相互作用時其鹽/醇溶液的濃度都比較高[3-8],所以他們測量的光譜信號中體現了大量的離子與醇的相互作用,可以直接使用測量的譜圖來討論相互作用,但是濃度較高時會出現各種離子對,這會對研究離子與醇的相互作用帶來影響,所以我們這里采用的濃度非常小(~0.005),此時不能直接利用測量的拉曼光譜來討論離子與甲醇的相互作用,下面我們將使用超額拉曼光譜的分析手段來討論離子與甲醇的相互作用.
2.2 超額拉曼光譜
圖1表明很難直接使用拉曼光譜來討論離子對甲醇結構的影響,所以必須使用特殊的方法來處理實驗譜圖.Yu等[22-25]首次提出了超額光譜來處理他們的紅外光譜,并且指出超額光譜有著很多的優點,例如超額光譜能有效地提高光譜分辨率.這里我們將類似地使用超額光譜處理我們的拉曼光譜.超額拉曼光譜是指實際測量所得的拉曼光譜與把混合物當作理想混合時應該具有的理想拉曼光譜的差別:

其中IE(ν)是超額拉曼光譜強度,Ireal(ν)是直接測量所得的拉曼光譜強度,Iideal(ν)是把溶液當成理想混合時的拉曼光譜強度,即:

其中An是溶液中成分n的系數,In,pure是成分n為純凈物時的拉曼光譜強度.
由于拉曼光譜強度正比于物質的量(Nn)和其相應振動的拉曼散射截面(σn):

其中k是比例系數,與物質無關.
所以理想混溶時的拉曼光譜強度可以表達為:


圖1 甲醇和鹽/甲醇溶液的拉曼光譜Fig.1 Raman spectra of pure methanol and salt/methanol solution(a)Raman spectra in the O—H stretching region of pure methanol(solid line)and LiClO4/CH3OH(dashed line);(b)Raman spectra in the C—O stretching region of pure methanol(solid line)and LiClO4/CH3OH(dashed line).The mole fraction of LiClO4is~0.005.
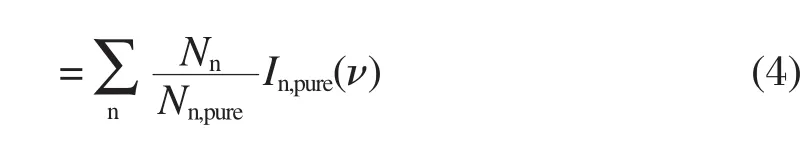
這里的Nn和Nn,pure是在相同體積下物質的量.故計算理想混溶時的拉曼光譜的系數An為:

由溶液的摩爾分數(χn)和密度(ρ)可以計算出Nn:

其中V是溶液的體積,M是物質的摩爾質量,χ是物質的摩爾分數 由式(5)和(6)可以計算得到理想拉曼光譜的系數,對于兩物質組成的混合溶液的理想拉曼光譜為:

在本實驗中,由于鹽在甲醇的C—O伸縮譜段和O—H伸縮譜段都沒有貢獻,故超額拉曼光譜可以表示為:
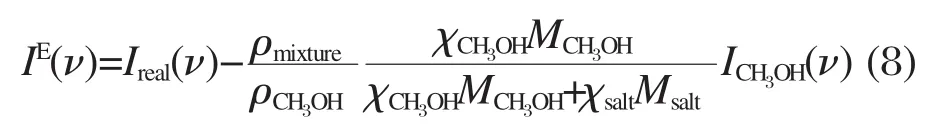
這里ρmixture是鹽/甲醇溶液的密度,我們使用的密度取自于文獻[28-32].超額拉曼光譜中會出現正峰和負峰,正峰表示實際體系相對理想體系增加的成分,在這里代表與離子相互作用的甲醇,而負峰則是實際體系相對理想體系減少的成分,在這里表示由于離子和甲醇相互作用而減少的體相甲醇.
2.3 陰、陽離子對甲醇O—H伸縮振動的影響
對于氫鍵體系,最常利用的振動譜段是O—H伸縮振動譜段,這里我們先討論這個區間的拉曼光譜.圖2展示了NaCl、NaClO4、LiNO3、LiClO4甲醇溶液(χ~0.005)的O—H伸縮譜段的超額拉曼光譜,其中有著明顯的正峰和負峰.負峰表示減少的體相甲醇,因為在這些鹽的甲醇溶液中存在離子與甲醇的相互作用,這些相互作用會使得體相甲醇減少,而正峰表示與離子相互作用的甲醇.為了判斷正峰是陽離子還是陰離子周圍的甲醇,我們做了下面的對比實驗.首先保證溶液中的陽離子都是Na+,而陰離子分別是Cl-和ClO-4(圖2(a)),很自然的,在超額拉曼光譜中它們不一樣的地方就表示了陰離子周圍甲醇的貢獻,由圖2(a)可以看出正峰的面積和位置明顯不一樣,所以我們可以判定正峰是與陰離子相互作用的甲醇,陰離子與甲醇通過氫鍵結合在一起,并且它們的氫鍵強度要弱于體相甲醇之間的氫鍵強度,這就導致了陰離子周圍的甲醇O—H伸縮振動位于高波數.通過超額拉曼光譜我們可以給出陰離子周圍甲醇的O—H伸縮振動頻率,例如與Cl-相互作用的甲醇O—H伸縮振動位于~3400 cm-1(圖2(a)),這與Yamauchi等[4]的結果是相似的,他們認為甲醇與Cl-形成氫鍵時O—H伸縮振動頻率為3385 cm-1,這里的超額拉曼光譜指出與ClO-4形成氫鍵的甲醇O—H伸縮振動位于~3540 cm-1,這和Kanno等[7]的結果是一致的,他們在研究LiClO4/甲醇玻璃態的拉曼光譜時提到ClO-4與甲醇形成氫鍵時O—H伸縮振動頻率是~3530 cm-1.我們還對比了LiClO4和LiNO3甲醇溶液的超額拉曼光譜(圖2(b)),很明顯地看出與NO-3相互作用的甲醇O—H伸縮振動位于~3480 cm-1.由這些甲醇的O—H振動頻率可以看出陰離子與甲醇的相互作用強度有下面的順序: CH3OH-CH3OH>Cl--CH3OH>NO-3-CH3OH>ClO-4-CH3OH,這與Hidaka等[8]的結論是一致的,他們同樣觀察到了類似的頻率關系,他們認為與ClO-4相互作用的甲醇O—H伸縮振動偏離體相甲醇的O—H伸縮振動最遠,所以他們提出了ClO-4破壞甲醇氫鍵結構的程度最大.

圖2 不同鹽/甲醇溶液O—H伸縮譜段的超額拉曼光譜Fig.2 Excess Raman spectra in the O—H stretching region of different salt/CH3OH solutions(a)comparison between the spectra of NaCl/CH3OH(solid line)and NaClO4/CH3OH(dashed line);(b)comparison between the spectra of LiNO3/CH3OH(solid line)and LiClO4/CH3OH(dashed line).The mole fraction of salt is~0.005.

圖3 LiClO4/甲醇(實線)和NaClO4/甲醇(虛線)的O—H伸縮譜段超額拉曼光譜的對比Fig.3 Comparison between the excess Raman spectra in the O—H stretching region of LiClO4/ CH3OH(solid line)and NaClO4/CH3OH(dashed line)The mole fraction of salts is~0.005.
我們也試圖利用O—H伸縮譜段的光譜來了解陽離子與甲醇的相互作用,固定陰離子為ClO-4,改變陽離子分別為Li+和Na+(圖3),這里正峰完全重合,也就是說這個正峰完全代表與ClO-4相互作用的甲醇,而我們知道溶液中一定存在陽離子與甲醇的相互作用,也就是說應當還有一個表示陽離子附近甲醇的正峰,但是在超額拉曼光譜中并沒有看到這樣的正峰,所以這個譜段的光譜并不利于研究陽離子與甲醇的相互作用.我們沒有觀察到不同的正峰,相反觀察到負峰的強度有很大的差異,負峰體現了體相甲醇的減少,這里之所以不同,我們認為是與陽離子相互作用的甲醇的正峰也位于負峰的位置附近,正、負譜峰疊加非常嚴重,這就導致了沒有觀察到代表陽離子附近甲醇的正峰,而是強度不一致的負峰.
由上面的超額拉曼光譜可以明顯地看出,利用O—H伸縮譜段可以很直接地了解陰離子與甲醇的相互作用,這是因為陰離子和甲醇可以通過氫鍵直接結合起來(圖4(a)),所以O—H伸縮振動受到陰離子的影響很大,但是陽離子和甲醇的相互作用則與之不同,該相互作用主要是電荷與偶極間的作用(圖4(b)),對O—H鍵的極化作用影響很小,不足以改變O—H的伸縮振動頻率,而與陽離子作用的甲醇又通過OH和別的甲醇分子相互作用,這就導致了與陽離子相互作用的甲醇O—H伸縮振動不能明顯地和體相甲醇O—H伸縮振動區分開來,所以陽離子與甲醇的相互作用不能直接利用這段光譜來研究.這與Stygar等[33]的結果不一致,他們在討論堿金屬陽離子溶解在聚乙二醇單甲醚中時,提出陽離子使得O—H伸縮譜峰的最大值向低波數移動,且陽離子的半徑越大往低波數移動得越大.而一些不含氫鍵的有機溶劑的鹽溶液中,有機溶劑主要與陽離子相互作用,所以在拉曼光譜中常常體現了陽離子與有機溶劑的相互作用.例如Wang等[34]在LiClO4/二甲基亞砜(DMSO)體系中,指出ClO-4與DMSO的相互作用太弱,以致觀察不到;Markarian等[35]利用紅外和拉曼光譜研究了LiClO4/二乙基亞砜(DESO),從S═O伸縮的拉曼光譜中分析得到Li+與DESO存在相互作用,且這種作用破壞了部分DESO自我締合的結構.
2.4 陰、陽離子對甲醇C—O伸縮振動的影響

圖4 離子與甲醇分子的相互作用示意圖Fig.4 Schematic diagram for the interactions between ions and methanol molecules(a)anionsinteractwithmethanolmoleculesthroughhydrogenbond,(b)cationsinteractwithmethanolmoleculesthroughcharge-dipoleinteraction
由于很難利用O—H伸縮譜段的拉曼光譜討論陽離子與甲醇的相互作用,所以需要在其它譜段尋找陽離子與甲醇相互作用的證據.C—O伸縮振動和O—H伸縮振動一樣對氫鍵網絡結構敏感[17-19],因此為了解陽離子與甲醇的相互作用,我們也測量了甲醇C—O伸縮譜段的拉曼光譜(圖1b).和O—H伸縮譜段的光譜類似,由于濃度很小,很難直接利用C—O伸縮譜段的拉曼光譜討論鹽與甲醇的相互作用,所以這里也通過超額拉曼光譜的手段來分析在甲醇中加入鹽后C—O伸縮振動的變化.這里比較了LiClO4、LiCl、Mg(ClO4)2、NaClO4的甲醇溶液,其超額拉曼光譜見圖5.這個譜段的超額拉曼光譜和O—H伸縮譜段的不一致,在O—H伸縮譜段中只有一個負峰和一個正峰(圖2,3),而在C—O伸縮譜段的超額拉曼光譜中除了一個負峰外還有兩個正峰,這兩個正峰必然代表了與陰、陽離子相互作用的甲醇分子,也就是說我們可以利用C—O伸縮振動區分開陰、陽離子附近的甲醇分子.為了進一步區別這兩個正峰,我們對比了LiClO4和LiCl甲醇溶液的超額拉曼光譜(圖5(a)),其中高波數(~1048 cm-1)的正峰基本一致,但低波數(~1020 cm-1)的正峰有很大的差別,因此我們可以判定低波數的正峰是與陰離子相互作用的甲醇C—O伸縮振動,高波數的正峰是與陽離子相互作用的甲醇C—O伸縮振動,并且可以明顯地看出LiCl溶液中低波數的正峰強度要小于LiClO4溶液中低波數的正峰強度,也就是說相對ClO-4而言,Cl-附近的甲醇比較少.
為了進一步確定高波數的正峰是與陽離子相互作用的甲醇C—O伸縮振動,測量了LiClO4、NaClO4、 Mg(ClO4)2的甲醇溶液,其超額光譜見圖5(b).同樣的,所有溶液的超額光譜均有兩個正峰,一個負峰.從圖中可以看到所有溶液的正峰都基本一致,反而觀察到負峰不一致.沒有觀察到高波數的正峰不一致,這可能是因為不同陽離子周圍的甲醇C—O伸縮振動頻率都大致一樣,而與之相互作用的甲醇數目略有差異,這就導致了減少的純甲醇不一致,即負峰不一致.陽離子附近的甲醇越多,高波數的正峰和負峰應該越大,這兩個譜峰的疊加導致了高波數的正峰沒有明顯變化,而負峰有明顯的差別.由超額光譜可以知道與陰、陽離子相互作用的甲醇C—O伸縮振動頻率順序為:CH3—OH(陰離子)<CH3—OH(體相)<CH3—OH(陽離子).這和O—H伸縮譜段有明顯區別,在C—O伸縮譜段陰、陽離子與甲醇的相互作用可以區分開來,下面利用這個區分開的C—O伸縮振動去討論陰、陽離子是如何影響純甲醇的微觀結構.
2.5 陰、陽離子第一溶劑化層中的甲醇數目
我們可以通過擬合C—O振動的拉曼譜峰分解出與陰、陽離子相互作用的甲醇和體相甲醇這三個拉曼光譜成分,利用分解出的拉曼光譜譜峰強度就可以得到它們大致的數目比例.但是在溶液濃度很小時,與陰、陽離子相互作用的甲醇在溶液中的總含量很少,所以相應的拉曼光譜很弱,實驗測得的光譜主要是體相甲醇的貢獻,這樣一來直接擬合C—O振動的拉曼譜峰會帶入很大的誤差,但是如果我們能夠先確定三個成分的譜峰位置和寬度,那么擬合光譜所得的譜峰強度可信度就會提高.
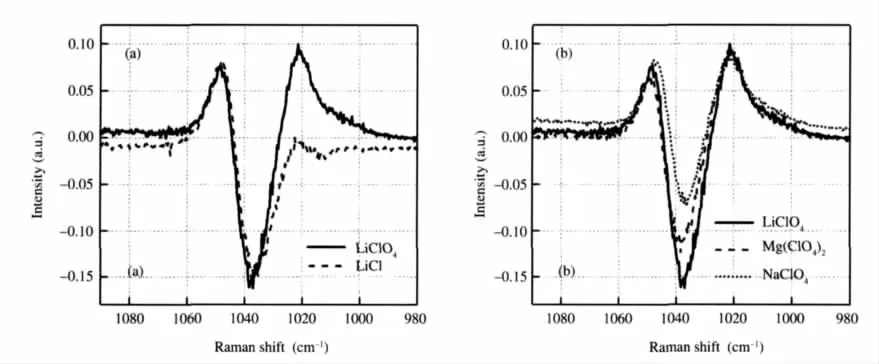
圖5 不同鹽/甲醇溶液C—O伸縮譜段的超額拉曼光譜Fig.5 Excess Raman spectra in the C—O stretching region of different salt/CH3OH solutions(a)comparison between the spectra of LiClO4/CH3OH(solid line)and LiCl/CH3OH(dashed line);(b)comparison among the spectra of LiClO4/ CH3OH(solid line),Mg(ClO4)2/CH3OH(dashed line)and NaClO4/CH3OH(dotted line).The mole fraction of Mg(ClO4)2is~0.0025,and the mole fraction of all the other salts is~0.005.
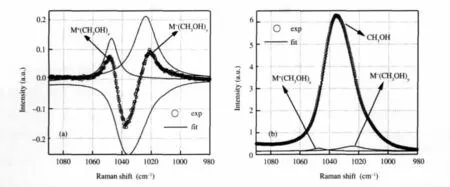
圖6 C—O伸縮譜段的超額拉曼光譜和拉曼光譜的譜峰分解Fig.6 Decomposition of excess Raman spectra and Raman spectra in the C—O stretching region(a)excess Raman spectra of LiClO4/CH3OH(cycle)and decomposed peaks(solid line);(b)Raman spectra of LiClO4/CH3OH(cycle)and decomposed peaks(solid line).
根據圖5的超額光譜,可以先確定與陰、陽離子相互作用的甲醇C—O伸縮振動譜峰的位置和寬度.在擬合時首先固定負峰的位置、寬度為純甲醇C—O伸縮振動拉曼譜峰的位置和寬度,這樣就能非常準確地確定與陰、陽離子相互作用的甲醇C—O伸縮振動的拉曼光譜(圖6(a)),擬合結果見表1.在擬合超額拉曼光譜時,分解得到的譜峰強度要比超額拉曼光譜的強度要大,這是因為正、負譜峰互相疊加的緣故.利用擬合超額拉曼光譜得到的結果進一步擬合C—O伸縮振動的拉曼光譜就可以較為準確地得到三個譜峰的強度信息,見圖6(b).我們知道譜峰強度正比于拉曼散射截面和分子數目的乘積,為了了解分子數目,這里我們近似認為所有的甲醇C—O伸縮振動散射截面都一致,那么譜峰強度就正比于甲醇的分子數目.利用該分子數目就可以知道和每個離子相互作用的甲醇數目,n±=r±/χ±,其中n±是與陽、陰離子相互作用的甲醇分子平均數目,r±是陰、陽離子相應譜峰的強度在總強度中的比例,χ±是陽、陰離子的摩爾分數.也就是說通過擬合超額拉曼光譜和原始的拉曼光譜就可以得到與陰、陽離子相互作用的平均甲醇分子數目.
我們的結果顯示每個Li+、Na+、Mg2+分別與(2.0± 0.3)-(2.8±0.3)、3.4±0.3、2.8±0.3個甲醇分子相互作用,每個Cl-、ClO-4分別與2.9±0.5、(4.9±0.6)-(6.0±0.6)個甲醇分子相互作用(表2).與各種陰、陽離子相互作用的甲醇分子數目都非常少,所以我們認為這里得到的甲醇數目主要反映第一溶劑化層中甲醇分子數目,這是因為只有在第一溶劑化層中甲醇才與陰、陽離子直接結合,而第一溶劑化層之外的甲醇主要還是通過甲醇分子間的氫鍵締合在一起,它們的C—O伸縮振動和體相甲醇的C—O伸縮振動沒有顯著的差異,其拉曼光譜幾乎還是體相甲醇的拉曼光譜,所以這里通過光譜擬合得到的結果反映了第一溶劑化層中甲醇分子的平均數目.也就是陰陽離子幾乎不影響第一溶劑化層以外的甲醇微觀結構,這與前人得到陰、陽離子幾乎不影響水的氫鍵網絡結構的結論是相似的;例如,Soper[39]和Smith[40]等研究鹽對水的結構影響時,也提出陰、陽離子對水結構的擾動大部分是在第一水合層;Omta等[41]通過飛秒泵浦探測光譜得到陰離子降低了第一水合層的水分子振動和轉動時間,而對第一水合層以外的水的結構沒有影響,因此認為陰、陽離子既沒有增強也沒有減弱水的氫鍵網絡結構.我們獲得的第一溶劑化層中甲醇的數目與其它的結果略有不同(表2),這可能是我們忽略了拉曼散射截面的原因.

表1 陰、陽離子周圍甲醇C—O伸縮振動譜峰的位置和半高全寬Table 1 Position and full width at the half maximum(FWHM)of C—O stretching band of methanol around cations and anions

表2 陰、陽離子第一溶劑化層中甲醇分子的數目Table 2 Number of methanol molecules in the first solvation shell of cations and anions
3 結 論
通過比較不同鹽/甲醇溶液的超額拉曼光譜來研究陰、陽離子對甲醇微觀結構的影響.利用O—H伸縮譜段的超額拉曼光譜,可以了解陰離子與甲醇的相互作用,超額拉曼光譜顯示了陰離子與甲醇的相互作用要弱于甲醇間的相互作用,且有下面的關系: CH3OH-CH3OH>Cl--CH3OH>NO-3-CH3OH>ClO-4-CH3OH,但是這段光譜不能明顯地反映陽離子與甲醇的相互作用.超額拉曼光譜表明C—O伸縮譜段的拉曼光譜可以同時反映陰、陽離子與甲醇的相互作用,且與陰、陽離子相互作用的甲醇C—O伸縮振動頻率有如下的關系:CH3—OH(陰離子)<CH3—OH (體相)<CH3—OH(陽離子).通過擬合C—O伸縮譜段的超額拉曼光譜和原始拉曼光譜,確定了陰、陽離子第一溶劑化層中甲醇分子的平均數目,結果顯示Li+、Na+、Mg2+第一溶劑化層中分別含有(2.0±0.3)-(2.8±0.3)、3.4±0.3、2.8±0.3個甲醇分子,Cl-、ClO-4第一溶劑化層中分別含有2.9±0.5、(4.9±0.6)-(6.0±0.6)個甲醇分子,這些離子幾乎不會影響第一溶劑化層之外的甲醇微觀結構.
1 Smedley,S.I.Interpretation of ionic conductivity in liquids.New York:Plenum,1980
2 Marcus,Y.Ion solvation.Chichester,U.K.:Wiley,1986
3 Yamauchi,S.;Kanno,H.Chem.Phys.Lett.,1989,154(3):248
4 Yamauchi,S.;Kanno,H.J.Phys.Chem.,1990,94(17):6594
5 Kanno,H.;Yamauchi,S.J.Raman Spectrosc.,1993,24(7):403
6 Honshoh,M.;Kanno,H.;Ueda,T.J.Raman Spectrosc.,1995,26 (4):289
7 Kanno,H.;Honsho,M.;Yamauchi,S.Z.Naturforsch.,1995,50a: 257
8 Hidaka,F.;Yoshimura,Y.;Kanno,H.J.Solution Chem.,2003,32 (3):239
9 Abe,N.;Ito,M.J.Raman Spectrosc.,1978,7(3):161
10 Symons,M.C.R.J.Chem.Soc.Faraday Trans.,1983,79:1273
11 Mochizuki,S.;Wakisaka,A.J.Phys.Chem.A,2002,106(20): 5095
12 Jorgensen,W.L.;Bigot,B.;Chandrasekhar,J.J.Am.Chem.Soc., 1982,104(17):4584
13 Impey,R.W.;Sprik,M.;Klein,M.L.J.Am.Chem.Soc.,1987, 109(20):5900
14 Pagliai,M.;Cardini,G.;Schettino,V.J.Phys.Chem.B,2005,109 (15):7475
15 Torii,H.J.Phys.Chem.A,1999,103(15):2843
16 Lin,K.;Zhou,X.G.;Luo,Y.;Liu,S.L.J.Phys.Chem.B,2010, 114(10):3567
17 Dixit,S.;Poon,W.C.K.;Crain,J.J.Phys.-Condes.Matter,2000, 12(21):L323
18 Musso,M.;Torii,H.;Ottaviani,P.;Asenbaum,A.;Giorgini,M.G. J.Phys.Chem.A,2002,106(43):10152
19 Max,J.J.;Chapados,C.J.Chem.Phys.,2009,130(12):124513
20 Miller,A.G.;MacKlin,J.W.J.Phys.Chem.,1985,89(7):1193
21 Marcus,Y.;Hefter,G.Chem.Rev.,2006,106(11):4585
22 Li,Q.Z.;Wu,G.S.;Yu,Z.W.J.Am.Chem.Soc.,2006,128(5): 1438
23 Li,Q.Z.;Wang,N.N.;Zhou,Q.;Sun,S.Q.;Yu,Z.W.Appl. Spectrosc.,2008,62(2):166
24 Wang,N.N.;Jia,Q.;Li,Q.Z.;Yu,Z.W.J.Mol.Struct.,2008, 883-884:55
25 Zhang,Q.G.;Wang,N.N.;Yu,Z.W.J.Phys.Chem.B,2010, 114(14):4747
26 Yu,Y.Q.;Lin,K.;Zhou,X.G.;Wang,H.;Liu,S.L.;Ma,X.X. J.Raman Spectrosc.,2007,38(9):1206
27 Yu,Y.Q.;Lin,K.;Zhou,X.G.;Wang,H.;Liu,S.L.;Ma,X.X. J.Phys.Chem.C,2007,111(25):8971
28 Barthel,J.;Neueder,R.;Poepke,H.;Wittmann,H.J.Solution Chem.,1998,27(12):1055
29 Wahab,A.;Mahiuddin,S.Can.J.Chem.,2002,80(2):175
30 Ihmels,E.C.;Safarov,J.T.J.Chem.Thermodyn.,2006,38(11): 1443
31 Wawer,J.;Krakowiak,J.;Grzybkowski,W.J.Chem.Thermodyn., 2008,40(8):1193
32 Wahab,A.;Mahiuddin,S.J.Chem.Eng.Data,2009,54(2):436
33 Stygar,J.;Zukowska,G.;Wieczorek,W.Solid State Ionics,2005, 176(35-36):2645
34 Wang,Z.X.;Huang,B.Y.;Wang,S.M.;Xue,R.J.;Huang,X.J.; Chen,L.Q.Electrochim.Acta,1997,42(17):2611
35 Markarian,S.A.;Gabrielian,L.S.;Zatikyan,A.L.;Bonora,S.; Trinchero,A.Vib.Spectro.,2005,39(2):220
36 Ozutsumi,K.;Ohtaki,H.Pure Appl.Chem.,2004,76(1):91
37 Yamagami,M.;Wakita,H.;Yamaguchi,T.J.Chem.Phys.,1995, 103(18):8174
38 Megyes,T.;Grosz,T.;Radnai,T.;Bako,I.;Palinkas,G.J.Phys. Chem.A,2004,108(35):7261
39 Soper,A.K.;Weckstr?m,K.Biophys.Chem.,2006,124(3):180
40 Smith,J.D.;Saykally,R.J.;Geissler,P.L.J.Am.Chem.Soc., 2007,129(45):13847
41 Omta,A.W.;Kropman,M.F.;Woutersen,S.;Bakker,H.J. J.Chem.Phys.,2003,119(23):12457
Effects of Salts on the Microstructure of Methanol
YU Xiao-Chun LIN Ke HU Nai-Yin ZHOU Xiao-Guo LIU Shi-Lin*
(Hefei National Laboratory for Physical Sciences at the Microscale,Department of Chemical Physics, University of Science and Technology of China,Hefei 230026,P.R.China)
We studied the effects of salts on the microstructure of liquid methanol using the Raman spectra.We compared the excess Raman spectra of different methanolic salt solutions in the O—H and C—O stretching regions. These regions reflect the interactions between anions(cations)and methanol molecules.In the O—H stretching region, the excess spectra show that the anions interact with methanol molecules by weak hydrogen bonding and the strength of the hydrogen bonds decrease according to the order:CH3OH-CH3OH>Cl--CH3OH>NO-3-CH3OH>ClO-4-CH3OH. Additionally,no interactions between cations and methanol molecules are apparent,as determined after analysis of this region.In the C—O stretching region,the excess Raman spectra show the interactions between anions(cations)and methanol molecules.The C—O stretching vibration frequencies of methanol that interact with the anions and cations increase according to the order:CH3—OH(anions)<CH3—OH(bulk)<CH3—OH(cations).According to the excess Raman spectra in the C—O stretching region,we fitted the Raman spectra and used the fitting results to determine the solvation numbers in the first solvation shell of the ions.The Raman spectra show that the ions do not affect the microstructure of liquid methanol beyond the first solvation shell at this concentration(~0.005).
Raman spectrum;Anion;Cation;Methanol;First solvation shell
O645
Received:May 25,2010;Revised:June 8,2010;Published on Web:July 15,2010.
*Corresponding author.Email:slliu@ustc.edu.cn;Tel:+86-551-3602323.
The project was supported by the National Natural Science Foundation of China(20873131,20928002)and National Key Basic Research Program of China(973)(2007CB815204).
國家自然科學基金(20873131,20928002)和國家重點基礎研究發展規劃項目(973)(2007CB815204)資助
?Editorial office of Acta Physico-Chimica Sinica

