美國FDA醫(yī)療器械和放射健康中心(CDRH)醫(yī)療器械監(jiān)管模式概述
沈 翀 編譯
(本刊編輯部,北京 100022)
美國FDA醫(yī)療器械和放射健康中心(CDRH)醫(yī)療器械監(jiān)管模式概述
沈 翀 編譯
(本刊編輯部,北京 100022)
編者按:確保醫(yī)療器械的安全性和有效性是監(jiān)督管理部門應(yīng)履行的職責(zé)。近年,醫(yī)療器械臨床研究數(shù)量呈現(xiàn)出逐年增長的勢頭,中國越來越重視醫(yī)療器械的臨床研究,醫(yī)療器械監(jiān)管部門對醫(yī)療器械臨床試驗的監(jiān)管更加嚴(yán)格,出臺多個規(guī)范性文件以保護(hù)受試者權(quán)益,同時保證臨床資料的科學(xué)性。本文編譯了美國食品藥品監(jiān)督管理局(FDA)器械和放射健康中心(CDRH)對醫(yī)療器械監(jiān)管的主要內(nèi)容,重點介紹了上市前審批、上市后監(jiān)測的要點,以及CDRH 2010年的戰(zhàn)略重點,希望能為加強(qiáng)我國醫(yī)療器械監(jiān)管,建立規(guī)范化、系統(tǒng)化的監(jiān)管模式提供借鑒。
醫(yī)療器械法規(guī)的目標(biāo)是通過關(guān)注醫(yī)療器械的安全性和有效性來促進(jìn)和保護(hù)公眾健康。醫(yī)療器械在設(shè)計和功能方面具有多樣性,因此需要依據(jù)其復(fù)雜性和風(fēng)險特征采取不同的監(jiān)管方法。以FDA醫(yī)療器械風(fēng)險管理的過程模式為指南,CDRH通過上市前審批計劃,確保新的、高風(fēng)險的、復(fù)雜的醫(yī)療器械安全有效;通過上市后監(jiān)測計劃、科學(xué)研究、法律約束和教育計劃等,最大限度地確保上市后醫(yī)療器械的安全有效。正是由于CDRH這些計劃的相互作用,使醫(yī)療器械從設(shè)計、上市使用,到更新?lián)Q代,組成了一個維護(hù)公眾健康安全的統(tǒng)一體。
1 上市前審批
1976年FDA頒布的《醫(yī)療器械修正案》將醫(yī)療器械分為三類,其分類標(biāo)準(zhǔn)是基于醫(yī)療器械的復(fù)雜性和風(fēng)險特征,其中以Ⅲ類產(chǎn)品最為復(fù)雜,風(fēng)險性最高。FDA對Ⅰ類產(chǎn)品(占47%左右)實行的是一般控制,絕大部分產(chǎn)品只需進(jìn)行注冊、列名和實施GMP規(guī)范,即可進(jìn)入美國市場(其中極少數(shù)產(chǎn)品連GMP也豁免,極少數(shù)保留產(chǎn)品則需向FDA遞交510(k)申請,即上市前通知(Premarket Notification,PMN));對Ⅱ類產(chǎn)品(占46%左右)實行的是特殊控制,企業(yè)在進(jìn)行注冊和列名后,還需實施GMP并遞交510(k)申請(極少數(shù)產(chǎn)可豁免510(k));對Ⅲ類產(chǎn)品(占7%左右),實施的是上市前許可(Pre-market Approval,PMA),企業(yè)在進(jìn)行注冊和列名后,須實施GMP并向FDA遞交PMA申請。
1.1 上市前通知(PMN)
510(k)文件即FDA對PMN所需的文件,因其對應(yīng)在《食品、藥品和化妝品法》第510章節(jié),故通常稱510(k)文件。FDA規(guī)定醫(yī)療器械生產(chǎn)企業(yè)在產(chǎn)品上市前90天內(nèi)必須提交510(k)文件,它要求企業(yè)呈報的信息能夠說明準(zhǔn)備上市的醫(yī)療器械與已合法上市的其它產(chǎn)品在安全性和有效性上是否實質(zhì)等同(Substantially Equivalent, SE)。對 510(k)文件所必須包含的信息,F(xiàn)DA有具體的內(nèi)容要求,傳統(tǒng)510(k)文件包括申請函、資料清單、真實性保證聲明、產(chǎn)品描述、注冊號碼、產(chǎn)品安全性及有效性證明、器械依據(jù)的標(biāo)準(zhǔn)和制造資料等。10%~15%的產(chǎn)品還需提供臨床數(shù)據(jù),這取決于受試器械與合法上市器械之間的差異,以及通過實驗室試驗和動物試驗解答問題的能力。圖1為FDA于1998年發(fā)布的510(k)審批流程圖。

圖1 510(k)審批流程圖
FDA為企業(yè)申請510(k)提供了兩種主要途徑:“特殊510(k):器械修改”和“簡化510(k)”,“特殊510(k):器械修改”以質(zhì)量體系中的設(shè)計控制部分為基礎(chǔ);“簡化510(k)”以指南文件、特殊控制和已認(rèn)可的標(biāo)準(zhǔn)為基礎(chǔ)。在沒有指南文件、特殊控制和已認(rèn)可的標(biāo)準(zhǔn)的情況下,企業(yè)只能提交傳統(tǒng)510(k)。簡化510(k)申請文件主要資料包含產(chǎn)品描述、產(chǎn)品適用范圍、標(biāo)貼、如何降低風(fēng)險的說明及支持?jǐn)?shù)據(jù)、產(chǎn)品執(zhí)行標(biāo)準(zhǔn)及一致性聲明、產(chǎn)品附件等。除此之外,以指南文件或特殊控制為基礎(chǔ)的簡化510(k)申請文件還應(yīng)當(dāng)著重說明與指南文件或特殊控制有偏離的地方;以已認(rèn)可標(biāo)準(zhǔn)為基礎(chǔ)的簡化510(k)申請文件還應(yīng)提交與已認(rèn)可標(biāo)準(zhǔn)一致性的聲明,著重指出與已認(rèn)可標(biāo)準(zhǔn)有偏離的地方。
1.2 上市前許可(PMA)
《食品、藥品和化妝品法》第515條規(guī)定,所有Ⅲ類醫(yī)療器械均需得到上市前認(rèn)證許可,否則不允許進(jìn)入市場。FDA對PMA的批準(zhǔn)程序至少為180天。而法令修訂前的產(chǎn)品、法令修訂后的產(chǎn)品以及過渡期的Ⅲ類產(chǎn)品PMA審批程序也有所區(qū)別。
法令修訂前產(chǎn)品是指1976年5月28日《醫(yī)療器械修正案》頒布前就已上市的產(chǎn)品。該類器械直至最終分類標(biāo)準(zhǔn)頒布30個月后,或要求提交PMA申請的最終法規(guī)頒布90天之后,才需要提交PMA申請。
法令修訂后產(chǎn)品是指1976年5月28日《醫(yī)療器械修正案》頒布后第一次上市的產(chǎn)品。若該類產(chǎn)品與法令修改前的醫(yī)療器械實質(zhì)相同,該產(chǎn)品適合申請510(k)。在檢查完510(k)申請報告后,F(xiàn)DA可以決定該產(chǎn)品是否與法令修訂前的醫(yī)療器械實質(zhì)相同。
過渡期Ⅲ類醫(yī)療器械是指1976年5月28日前按藥品管理的醫(yī)療器械。如:隱形眼睛及其護(hù)理產(chǎn)品、醫(yī)用輔料等。
經(jīng)FDA判斷與法令修改前的醫(yī)療器械或法令修改后、分類為Ⅰ類或Ⅱ類的醫(yī)療器械不實質(zhì)等同的產(chǎn)品被認(rèn)為是 “新”的醫(yī)療器械,自動進(jìn)入Ⅲ類管理。在這類醫(yī)療器械上市之前,它們可以申請PMA也可以通過重新分類程序降為Ⅰ類或Ⅱ類管理。
2 上市后監(jiān)測
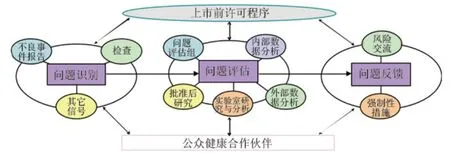
圖2 CDRH上市后安全監(jiān)測流程
CDRH上市后的安全監(jiān)測流程見圖2。CDRH的上市后安全性監(jiān)測通過上市后安全性問題的識別、評估和反饋進(jìn)行運作。
2.1 上市后安全性問題的識別
上市后安全性問題識別主要是用于識別非預(yù)期的公眾健康問題,提高上市后醫(yī)療器械潛在風(fēng)險信息的數(shù)量和質(zhì)量。安全性問題識別不僅包括基本的監(jiān)測信息(不良事件報告和補充信息),還包括了企業(yè)核查和召回工作中產(chǎn)生的數(shù)據(jù)和信息。
2.2 上市后安全性問題的評估
上市后安全性問題的評估分為五類,包括內(nèi)部數(shù)據(jù)分析、補充數(shù)據(jù)分析、實驗研究、問題評估、上市后監(jiān)測研究。主要用以評價潛在風(fēng)險因素和與器械使用有關(guān)的不良事件,包括數(shù)據(jù)收集與分析、確認(rèn)醫(yī)療器械故障的原因、評價使用方面的問題、評估標(biāo)簽信息是否完善等。
2.3 上市后安全性問題的反饋
CDRH上市后安全性問題反饋用于上市后風(fēng)險管理和交流,分為兩個關(guān)鍵性步驟——風(fēng)險交流和強(qiáng)制性措施。風(fēng)險交流是通過與公眾和器械使用者互動交流來解決問題,目的是使公眾了解可能的健康危害、需關(guān)注的安全性問題,以及為使用者提供關(guān)于器械的培訓(xùn)和使用建議。
2.4 CDRH上市后監(jiān)測的主要目標(biāo)
(1) 收集廣泛的、精確的、及時的統(tǒng)計學(xué)和流行病學(xué)的監(jiān)測數(shù)據(jù),衡量上市醫(yī)療器械的安全性和有效性,對潛在風(fēng)險信號進(jìn)行警示;
(2) 通過醫(yī)療器械有關(guān)機(jī)構(gòu)與公眾和企業(yè)建立伙伴關(guān)系和聯(lián)盟,確保交流的持續(xù)性和信息的對稱性;
(3) 通過醫(yī)療器械生產(chǎn)者協(xié)會維持強(qiáng)制性核查與評估,完善質(zhì)量標(biāo)準(zhǔn),在公眾健康受到影響之前發(fā)現(xiàn)和說明問題;
(4) 以及時有效的方式,用通俗易懂的語言與聽眾交流每一條醫(yī)療器械風(fēng)險信息;
(5) 把上市后的監(jiān)測結(jié)果與上市前的器械審評相結(jié)合;(6) 發(fā)現(xiàn)和交流企業(yè)在法規(guī)實踐中的優(yōu)秀范例;
(7) 建立和維護(hù)支持法規(guī)和公眾健康責(zé)任的信息與知識系統(tǒng);
(8) 不斷開發(fā)人力資源,培養(yǎng)器械安全性問題的技能和知識。
3 CDRH 2010年戰(zhàn)略重點
3.1 全面落實產(chǎn)品全生命周期監(jiān)管措施
監(jiān)管部門對醫(yī)療器械的監(jiān)管責(zé)任跨越了產(chǎn)品的全生命周期,從早期的產(chǎn)品開發(fā)、生產(chǎn),直至進(jìn)入市場流通。產(chǎn)品生命周期的任何階段,均需對其制定正確的監(jiān)管措施,考慮一切有價值的信息。為了全面落實醫(yī)療器械全生命周期監(jiān)管,CDRH將會采取如下措施:① 加強(qiáng)和整合上市前的審評及上市后的監(jiān)管,加強(qiáng)各部門的職能意識,以應(yīng)對現(xiàn)有的和預(yù)期的挑戰(zhàn)。具體而言,CDRH將加強(qiáng)上市前審查,優(yōu)化科技資源的使用,從而提高科學(xué)決策的質(zhì)量和一貫性;加強(qiáng)收集、分析以及共享有價值的信息;制定措施以更好地整合和利用組織架構(gòu);建立機(jī)制,將最新的科學(xué)信息納入我們的決策制定中,從而應(yīng)對與全球化相關(guān)的挑戰(zhàn)。② 改善對發(fā)展策略的指導(dǎo)和調(diào)控,及時、準(zhǔn)確地向境外機(jī)構(gòu)傳達(dá)目前的預(yù)期和要求。
3.2 加強(qiáng)溝通和監(jiān)管透明度
加強(qiáng)與各國監(jiān)管部門的溝通,提高監(jiān)管透明度,使公眾健康最大程度受益。提高公眾及有關(guān)機(jī)構(gòu)對CDRH的信任度,使其更好地與CDRH合作。為此,CDRH將采取如下措施:① 制定與公眾溝通的戰(zhàn)略措施,向境外企業(yè)提供及時、有價值的信息,并使其有機(jī)會參與與FDA的對話。② 加強(qiáng)內(nèi)部溝通,鼓勵思想交流。③ 提高決策制定的透明度,使得公眾了解CDRH的工作,并了解決策制定的原因。
3.3 提高員工技能,創(chuàng)造高效的工作環(huán)境
技能優(yōu)異的員工以及高效的工作環(huán)境能夠提高CDRH應(yīng)對挑戰(zhàn)的能力,以及保護(hù)、提升公眾健康水平的效率。為了提高員工技能,創(chuàng)造高效的工作環(huán)境,CDRH將采取如下措施:① 招募和培養(yǎng)有能力的員工。② 提高員工專業(yè)技能以及專業(yè)知識的深度和廣度。③ 建立解決分歧的途徑,支持CDRH內(nèi)部合作,公平地考慮境內(nèi)外企業(yè)提出的問題。④ 改善內(nèi)部行政程序,提高工作效率。⑤ 使CDRH白橡園區(qū)的工作環(huán)境更加舒適友好,從而保證各項工作的質(zhì)量及效率。
3.4 積極促進(jìn)改革,解決公眾醫(yī)療需求
為了促進(jìn)改革和解決公眾未得到滿足的醫(yī)療需求,CDRH將采取如下措施:① 與聯(lián)邦政府及境外企業(yè)合作,降低貿(mào)易壁壘,促進(jìn)醫(yī)療器械開發(fā)。② 制定個性化的醫(yī)療計劃,加強(qiáng)對診斷器械及治療方法的監(jiān)管能力。

