伴高脂血癥的急性胰腺炎大鼠腸屏障功能的改變
張富春 吳婷 黃胡萍 孫娟
伴高脂血癥的急性胰腺炎大鼠腸屏障功能的改變
張富春 吳婷 黃胡萍 孫娟
近年來高脂血癥與急性胰腺炎(AP)之間的關系越來越受到人們的關注。高脂血癥已成為AP的一個較常見的病因,并能誘發和加重AP的病情進展,但具體機制尚未闡明。由于近年來腸道屏障功能障礙在AP病情進展中所起的作用得到揭示,故本實驗試圖從腸道屏障功能改變方面對高脂血癥與AP之間的關系做一探討。
一、材料和方法
1.實驗動物及分組:清潔級SD大鼠50只,雌雄不分,體重200~220 g,購自福建醫科大學實驗動物中心。按數字表法隨機分為4組,高脂血癥并急性胰腺炎(HAP)組(15只)、AP組(15只)、高脂血癥(HL)組(10只)和對照組(10只)。采用自制脂肪乳劑灌胃(1 ml·100 g-1·d-1,連續2周)的方法制備HL模型。脂肪乳劑配方參照劉明等[1]方法加以改進,配方中各種成分的比例為:20%豬油,10%膽固醇,20%吐溫80,2%膽酸鈉,1%丙基硫氧嘧啶。采用胰膽管逆行注射3.5%牛磺膽酸鈉1 ml/kg體重方法制備AP模型。對照組僅行剖腹術,輕輕牽動十二指腸及胰腺。
2.血清淀粉酶、三酰甘油(TG)、膽固醇(CH)、D-乳酸、內毒素含量測定:制備模型后6 h采血,自動生化儀測定大鼠血清淀粉酶、TG及CH含量;改良分光光度法[2]測定血漿D-乳酸水平;EDS-99細菌內毒素測定系統測定血漿內毒素水平。
3.胰腺、回腸組織病理檢查:取胰腺和回腸組織行常規病理組織學觀察,參照Grewal等[3]的標準對胰腺損害進行評分。
4.回腸末段組織凋亡指數(apoptotic index,AI)及PCNA表達檢測:采用TUNEL檢測試劑盒(德國ROCHE公司)原位檢測回腸黏膜上皮細胞凋亡情況。計數3個視野中每100個上皮細胞中凋亡細胞(棕黃色染色)數,取均值,為AI;采用常規免疫組化法檢測回腸黏膜上皮細胞PCNA的表達,PCNA抗體購自北京中杉金橋生物技術有限公司,以PBS代替PCNA抗體作為陰性對照。細胞核呈棕色者為陽性細胞,計算陽性細胞占總細胞數的百分率。
二、結果
1.模型評估:AP組及HAP組血清淀粉酶值較對照組明顯升高(P﹤0.01),HL組和HAP組血清TG、CH值較對照組均明顯升高(P﹤0.01,表1)。AP組及HAP組胰腺病理評分較對照組明顯升高,對照組及HL組胰腺組織未見改變,各組胰腺組織病理評分見表1。表明兩種模型均制備成功。
2.血D-乳酸和內毒素水平變化:AP組血D-乳酸和內毒素水平較對照組均明顯升高(P﹤0.01),HAP組血D-乳酸及內毒素水平又均較AP組顯著升高(P﹤0.05,表1)。
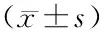
表1 各組血清淀粉酶、TG、CH、D-乳酸和內毒素水平變化及胰腺病理評分
注:與對照組比較,aP﹤0.05,bP﹤0.01;與AP組比較,cP﹤0.05
3.回腸組織病理改變及回腸上皮細胞AI、PCNA表達的變化:各組回腸組織學改變未見明顯區別。對照組、AP組、HAP組的AI分別為5.200±1.121、15.348±1.446、25.915±1.939(圖1); PCNA陽性細胞表達率分別為(79.3±7.0)%、(67.3±5.9)%、(53.8±7.5%)。AP組的AI較對照組顯著增加,而PCNA表達較對照組顯著減少(P值均<0.01);HAP組的AI較AP組進一步增加,PCNA表達較AP組進一步減少(P值均<0.05,圖2)。
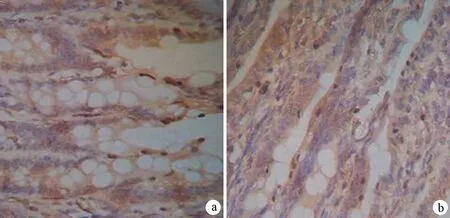
圖1 AP組(a)和HAP組(b)小腸細胞凋亡情況(Tunel ×400)

圖2AP組(a)和HAP組(b)小腸細胞PCNA表達情況(免疫組化×400)
討論高脂血癥與AP之間孰因孰果目前仍存在爭議。當前的多數研究認為高脂血癥可導致或加重AP[4-5],極高的TG可以直接誘發AP。Berger等[6]報道,血清TG水平濃度超過11.3 mmol/L就能引起胰腺炎。高脂血癥引起或加重胰腺炎的具體機制為:(1)HL使血液黏稠度增高,微血栓形成,造成胰腺微循環障礙;(2)血清脂質顆粒聚集栓塞胰腺血管,或胰腺內黃色瘤形成;(3)HL激活血小板,釋放大量具有強烈縮血管作用的血栓素A2,同時損傷胰腺血管內皮細胞,前列腺環素分泌減少,導致兩者失衡,加重胰腺微循環障礙;(4)胰脂酶水解TG產生大量的游離脂肪酸,產生組織毒性。本結果顯示,HAP組大鼠胰腺病變,尤其是胰腺壞死程度較AP組明顯加重,證實HL可加重AP病情的進展。
近年來腸屏障功能障礙在重癥急性胰腺炎(SAP)的發病機制中受到很大關注,SAP時腸屏障功能障礙是加重SAP病情進展的一個重要因素[7-8]。D-乳酸是細菌發酵的代謝產物,可由腸道多種細菌產生。因哺乳動物不具備將其分解的酶系統,腸道細菌產生的大量D-乳酸通過受損腸黏膜進入血,引起外周血中D-乳酸的水平升高,故血中D-乳酸水平可反映腸通透性的變化[9]。內毒素是革蘭陰性菌細胞壁的成分,正常情況下只有少量內毒素進入循環并在肝臟內被滅活,外周循環中檢測不到。在各種原因引起腸道屏障功能減弱時,大量的內毒素即可通過各種途徑進入到循環中,形成內毒素血癥[10]。本實驗結果顯示, HAP組的血D-乳酸和內毒素的水平均較AP組明顯升高,說明HAP大鼠的腸黏膜通透性較AP組增加。實驗結果還顯示, HAP組大鼠回腸黏膜上皮細胞的AI較AP組顯著增加,而PCNA的表達則明顯減少,提示腸黏膜上皮細胞過度凋亡與增殖減弱可能是導致HAP大鼠腸道屏障功能障礙加劇、通透性進一步增加的一個重要機制之一。
[1] 劉明,董超仁,蘇靜怡.一種簡便實用的大鼠高脂血癥模型.中國藥理學通報,1989,5:119-120.
[2] Brandt RB,Siegel SA,Waters MG,et al.Spectrophotometric assay for D-(-)-lactate in plasma.Anal Biochem, 1980,102:39-46.
[3] Grewal HP,Mohey el Din A,Gaber L,et al.Amelioration of the phy-siologic and biochemical changes of acute pancreatitis using an anti-TNF-alpha polyclonal antibody.Am J Surg,1994,167:214-219.
[4] Tsuang W, Navaneethan U, Ruiz L,et al. Hypertriglyceridemic pancreatitis: presentation and management.Am J Gastroenterol,2009,104:984-991.
[5] Fortson MR,Freedman SN,Webster PD 3rd. Clinical assessment of hyperlipidemic pancreatitis.Am J Gastroenterol,1995,90:2134-2139.
[6] Berger Z,Quera R,Poniachik J,et al.Heparin and insulin treatment of acute pancreatitis caused by hypertriglyceridemia.Experiences of 5 cases.Rev Med Chil,2001,129:1373-1378.
[7] Marotta F,Geng TC,Wu CC,et al.Bacterial translocation in the course of acute pancreatitis:beneficial role of nonabsorbable antibiotics and lactitol enemas.Digestion,1996,57:446-452.
[8] Miniello S,Testini M,Amoruso M.Acute pancreatic necrosis complicated by infection and gastro-intestinal translocation:pathogenesis correlation and therapeutic implication.Ann Ital Chir,2002,73:611-617.
[9] 陳秀凱,邱方,程愛國.腸道屏障功能監測方法的現狀及其進展. 中國煤炭工業醫學雜志,2002,5:413-415.
[10] 鄧群,黎沾良,陸連榮,等.急性壞死性胰腺炎腸粘膜屏障改變與腸源性細菌移位及內毒素血癥的關系. 中華實驗外科雜志,2000,17:471.
2009-08-17)
(本文編輯:呂芳萍)
10.3760/cma.j.issn.1674-1935.2010.04.023
350003 福州,福建省老年醫院消化內科(張富春);福建醫科大學附屬第一醫院消化內科(吳婷);福建省立醫院消化內科(黃胡萍);福州市第一醫院消化內科(孫娟)
吳婷,Email:DrWT@medmail.com.cn

