硼氫化鈉水解制氫技術研究進展
張 翔,孫奎斌,周俊波
(1.北京化工大學機電工程學院,北京 100029;2.中冶天工上海十三冶建設有限公司)
硼氫化鈉水解制氫技術研究進展
張 翔1,孫奎斌2,周俊波1
(1.北京化工大學機電工程學院,北京 100029;2.中冶天工上海十三冶建設有限公司)
隨著石化能源的日益枯竭,氫能成為解決當前能源危機的一種新能源。制氫的方式多種多樣,由于金屬氫化物在儲氫容量上具有其他材料無法比擬的優勢,因此,金屬氫化物制氫技術得到了迅速發展。硼氫化鈉就是一種典型的金屬氫化物,硼氫化鈉水解制氫技術作為一種安全、方便的新型制氫技術,已成為當前燃料電池氫源研究中的熱點之一。介紹了硼氫化鈉制氫原理;綜述了硼氫化鈉水解制氫技術的優點、影響產氫速率的因素;對硼氫化鈉制氫技術的裝置進行了舉例說明;指出了目前此技術所存在的問題;概述了此技術的應用與發展前景。
制氫;硼氫化鈉;燃料電池
由于目前所用的石化能源,如石油、天然氣、煤,均屬不可再生資源,并且地球上存量有限,而人類生存又時刻離不開能源,這就迫切需要尋找一種不依賴石化燃料且儲量豐富的新能源,氫正是這樣一種能夠解決當前能源危機的新能源。目前,世界各國正在研究如何能大量而廉價地生產氫。制氫的方式是多種多樣的,既可通過化學方法對化合物進行重整、分解、光解或水解等獲得,也可通過電解水制氫,或是利用產氫微生物進行發酵或光合作用來制得氫氣[1-2]。隨著燃料電池這一環境友好的發電方式在技術上的不斷突破,金屬氫化物制氫技術得到了迅速發展。金屬氫化物在儲氫容量上具有其他材料無法比擬的優勢[3],且通過簡單的水解反應即可放出氫氣。正因如此,金屬氫化物水解作為一種新型供氫技術,近年來受到了極大關注。
1 金屬氫化物制氫基本原理
具有儲氫作用的金屬氫化物按結構可分為3類:儲氫合金、離子氫化物、配位氫化物[1]。硼氫化物即為配位氫化物,而硼氫化鈉 (NaBH4)是最重要的一種硼氫化物,大規模工業化生產技術已相當成熟。
NaBH4水溶液的穩定性可以由溶液溫度和 pH來調節,當加入特定催化劑的時候,硼氫化鈉可以迅速地發生水解反應,釋放出大量高純度的氫氣[4]。在催化劑存在下,硼氫化鈉在堿性水溶液中可水解產生氫氣和水溶性亞硼酸鈉[5]。反應式如下:
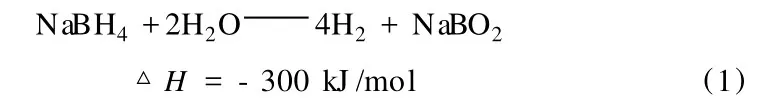
如果沒有催化劑,反應 (1)也能進行,其反應速度與溶液 pH和溫度有關。這一速度可由以下經驗式計算:
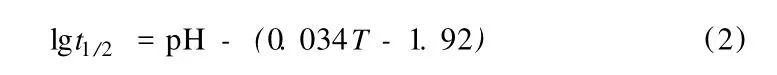
式中:t1/2是 NaBH4半衰期,min;T是絕對溫度,K。pH對反應速度有很大影響,當 pH為 8時,即使在常溫下,NaBH4溶液也會很快水解。因此,為了使 NaBH4制氫能夠得到實際應用,必須將其保持在強堿性溶液中。在 25℃和 pH為 14的情況下,硼氫化鈉溶液的半衰期為 430 d,可滿足實際應用的要求[6]。
利用 NaBH4堿溶液來生產氫氣,必須要有足夠快的反應速度。為了加速反應,使用催化劑是最簡單易行的方法。在早期對 FeCl2,CoCl2,NiCl2,CuCl2等催化劑的研究中發現,CoCl2的催化性能最好,在25℃,10 min內可釋放 97%的氫氣,并且認為真正起催化作用的是鈷的硼化物。研究人員還進一步發現,鉑系金屬鹽類對NaBH4水解有很高的催化活性。其中銠和釕鹽從NaBH4水溶液中釋放氫的速度是最快的,反應幾乎呈爆炸性[3,7]。最近又有研究人員研究了一種新型無定形粉末催化劑 Co-Ni-P-B,并發現其與 Co-Ni-B,Co-B和 Co-P-B相比較,顯示出最高的制氫速率[8]。
2 硼氫化鈉制氫的優點
1)儲氫容量高。硼氫化鈉本身的儲氫量 (質量分數,下同)為 10.6%,其飽和水溶液質量分數可達35%,此時的儲氫量為 7.4%[6,9]。
2)產氫純度高。硼氫化鈉水解產生的氫氣不含 CO及其他雜質,不需要純化;只有少量的水分,不會引起催化劑中毒。
3)反應條件簡單,反應易控制。反應的引發可以在低溫下進行,不需要外部提供額外的能量;通過控制流過催化劑的NaBH4溶液的量或與NaBH4溶液接觸的催化劑 (表面積)的量,就可控制氫氣產生的量和速度。
4)安全、無污染。NaBH4水溶液具有阻燃性,并且在加入穩定劑后能夠穩定存在于空氣中,儲運和使用安全;反應的副產物 NaBO2對環境無污染,并且可以作為合成 NaBH4的原料進行回收再利用。
1884年5月的一天,馬克沁在倫敦舉辦機槍演示,只見他裝了6發子彈后,單膝跪地,兩手握著槍柄,瞄向靶子,旁邊有人喊了聲“射擊”,僅僅2秒鐘,6發子彈就悉數射出,靶子也被打成了蜂窩。很多人沒有看清楚,便請馬克沁再次演示,于是6發、6發,再6發……,人群中發出了驚嘆的掌聲。隨后,英國政府在1887年訂購了3挺馬克沁機槍以作進一步試驗。
3 硼氫化鈉水解反應的影響因素
3.1 溫度的影響
溫度對 NaBH4水解反應的影響十分顯著,反應速度隨溫度的增加而增大。在反應溫度不變的條件下,反應速率并不隨 NaBH4濃度的降低而改變。此外,提高反應溫度還可以增加副產物 NaBO2的溶解度,這不但可以避免反應過程中 NaBO2的析出對催化劑產生不利影響,還可以使用更高濃度的 NaBH4溶液為原料,從而更有利于提高系統的能量密度[9]。
3.2 NaOH濃度的影響
NaOH作為反應的穩定劑,其濃度對反應速度的影響是十分復雜的[10]。有研究者認為產氫率隨NaOH濃度的增加而降低,認為這是由于 OH-容易與水絡合,從而抑制了NaBH4的水解反應;有的研究者發現,在 Ni基催化劑上,穩定劑 NaOH對產氫反應有促進作用;也有研究者發現 NaOH濃度對反應沒有影響。
3.3 硼氫化鈉濃度的影響
對于移動制氫系統來說,NaBH4溶液的濃度越高,系統的能量密度越大,但過高的濃度會導致溶液黏度增加,使產氫率下降。此外,在高 NaBH4濃度下,隨著反應的進行,反應副產物 NaBO2由于溶解度限制會逐漸從溶液中析出晶體,如果 NaBO2結晶在催化劑表面就會影響產氫速率。
3.4 壓力的影響
NaBH4水解反應在常壓下就可以進行,但有研究表明提高反應系統的壓力有利于獲得理想的系統能量密度[11]。
4 幾種 NaBH4水解制氫裝置
國內外對硼氫化鈉催化水解制氫技術的研究已取得很大進展,目前主要有以下幾種制氫裝置。
2)A.Pozio等[13]發明了一種由硼氫化鈉溶液水解制氫的裝置,如圖 1所示。其特點是由兩塊平行的磁性平板圍成反應區域,硼氫化鈉堿性溶液包含在磁場之中。粉末催化劑是由直徑為 10μm的磁性球體組成,并在其表面涂有 Ru的涂層,并使催化劑均勻地分布于磁性容器表面上。這種特殊的催化劑可以保證高動力速率且能提高其化學穩定性。
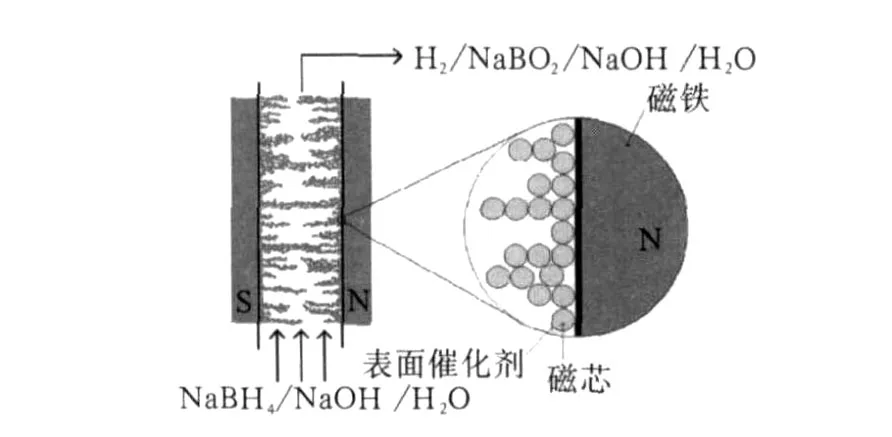
圖 1 磁性容器反應器的設計
3)楊漢西等[14]采用硼化鎳作催化劑,進行了用硼氫化鈉溶液水解制氫的研究。他們將金屬硼氫化物的水溶液與通過化學沉積在多孔載體材料的過渡金屬硼化物催化劑接觸,催化水解產生氫氣。上述制備方法所用裝置見圖 2。
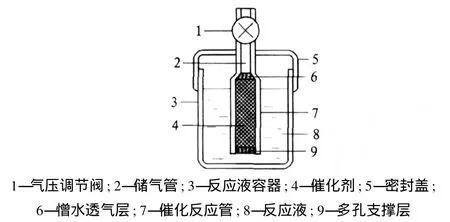
圖 2 硼氫化鈉水解制氫裝置
金屬硼氫化物的水溶液由催化反應管下端進入管內腔,與管中催化劑接觸,催化水解產生氫氣。氫氣經由催化反應管上端流到儲氣管。在儲氣管上端設有壓力閥,當儲氣管內氫氣壓力超過設定值時,管內氣體反向壓縮催化反應管內的反應液使其返回到容器中,導致反應減速或停止。若儲氣管氫氣壓力不足時,反應溶液自動擴散進入催化反應管,使催化水解反應加速。此發明制氫方法簡單、效率高、成本較低;所用裝置結構簡單、體積小。
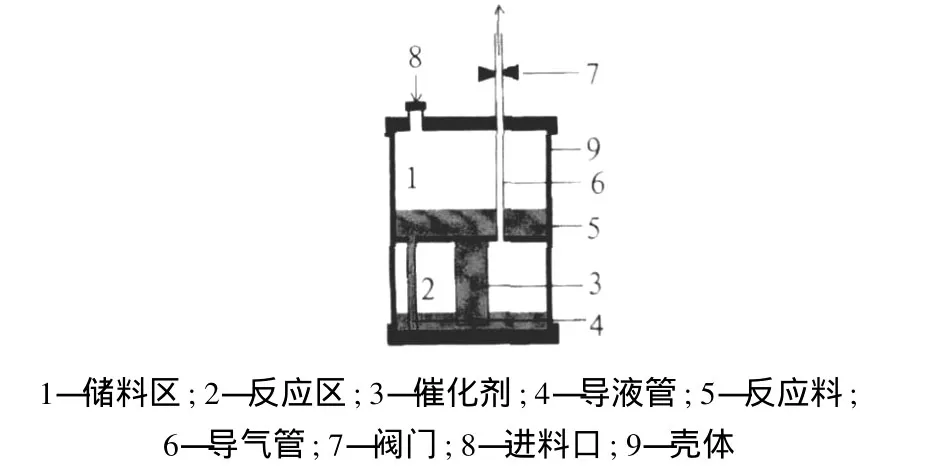
圖 3 硼氫化物水解制氫的即時自控供氫裝置
4)王新東等[15]對硼氫化鈉制氫技術做了相關研究。該方法利用裝置 (見圖 3)內部兩容器間的氫氣壓力差,使反應料在裝置內的兩容器間流動,調節反應料與催化劑的接觸量,從而來控制氫氣的產生速率和氫氣壓力。此發明簡便實用,安全易控,可以根據需求即時自控供氫。
5 硼氫化鈉水解制氫技術的應用與前景
硼氫化鈉制氫在燃料電池汽車上已實現了初步應用。目前,千年電池公司開發的 Hydrogen on Demand T M硼氫化鈉制氫系統已成功應用于福特公司的越野車(SUV,sport utility vehicle)和維多利亞皇冠轎車 (Crown Victoria),此外也成功用于戴姆勒克萊斯勒公司推出的燃料電池“鈉”概念車和法國標致 -雪鐵龍 (Peugeot-Citroen)公司的燃料電池汽車,同時也用作加拿大 Ballard公司 Nexa 1.2 kW燃料電池的備用電源[9]。
硼氫化鈉水解制氫技術在某些場合下也顯示出其優越性,這項技術大大降低了貯運氫的成本,提高了它的效率和安全性,其中用氫作燃料的燃料電池可直接將氫能轉化為電能,是氫能技術應用最重要的方面。人們期待著可以在汽車加油站里,用泵給汽車加注硼氫化鈉燃料,同時回收偏硼酸鈉產物,返送到合成車間進行再循環使用[16]。
6 硼氫化鈉水解制氫技術存在的問題
6.1 硼氫化鈉的生產
目前工業上生產硼氫化鈉的工藝主要有硼酸三甲酯 -氫化鈉法 (亦稱 Schlesinger法)和硼砂 -金屬氫化還原法 (亦稱 Bayer法)[17-18]。反應式如下:
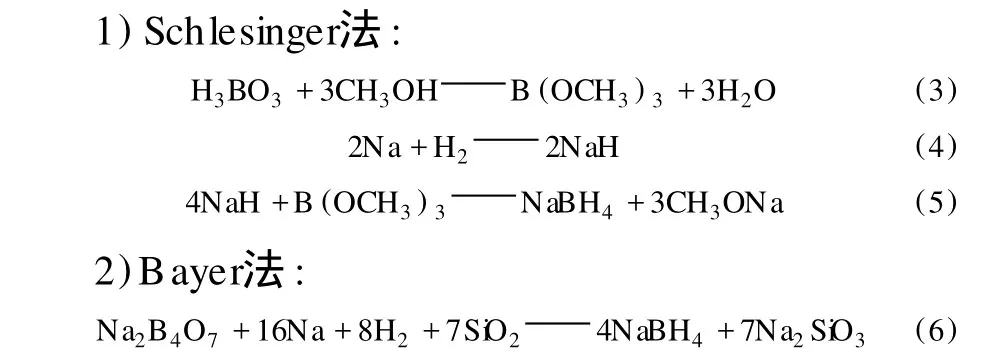
土耳其研究者以 CoCl2為催化劑,采用Schlesinger法合成得到純度為 85.17%的硼氫化鈉[19]。由于 Schlesinger法生產硼氫化鈉的裝置較小,在中國只有少量生產。而且這兩種工藝都需要耗用大量金屬鈉[5],因而成本很高。
6.2 副產物 NaBO2的回收和利用
NaBO2可直接利用,也可轉化為其他用途更廣的無機硼化物[20],因此不會產生環境污染。若能將回收的 NaBO2再合成 NaBH4,則可大大降低成本。KUCEL-MER IT研究組發現氟化的堿金屬氫化物F-MgH2與 NaBO2反應可以以很高的產出率產出NaBH4,反應如下:
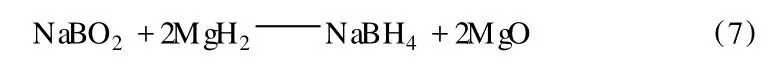
該研究組還開發了用 MgH2和 Na2B4O7通過球磨法合成 NaBH4的工藝[9]。為了補充 Na的不足,他們發現添加 Na2CO3效果最好。反應式如下:
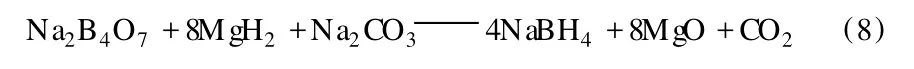
6.3 去除 NaBH4分解產生的 NaBO2膠體的問題
高濃度的硼氫化鈉溶液反應后生成的膠體會毒化催化劑,使得硼氫化鈉分解制氫的可控性大大降低,因而需要快速方便地去除溶液中的膠體。沈培康等[21]在含硼氫化鈉溶液的容器中加入兩個電極,兩電極分置于催化劑的上下方,正極在下方。在直流電場作用下,使硼氫化鈉分解產生的偏硼酸鈉以電泳的方式向正電極方向定向移動而除去。
7 結語
硼氫化鈉水解制氫技術是一種方便、實用、有效的制備高純氫氣的新型制氫技術,與其他制氫技術相比,其優點不言而喻。氫能是適合全球未來可持續發展所需的主要能源,有學者預言,氫經濟將在21世紀到來。但要使硼氫化鈉制氫技術真正達到實用化,尚有大量的難題需要攻克。
[1] 吳川,張華民.化學制氫技術研究進展 [J].化學進展,2005,17(3):423-428.
[2] 周潔,鄭穎平,謝吉虹.制氫技術研究進展及燃料電池中的應用前景[J].化工時刊,2007,21(5):71-75.
[3] 王鳳娥.化學氫化物催化分解供氫技術[J].電源技術,2006,30(1):79-82.
[4] 呂康樂,周海光,黃雋.儲氫方法[J].浙江化工,2003,34(1):7-9.
[5] Liu B H,Li Z P.A review:Hydrogen generation from borohydride hydrolysis reaction[J].Journal of Power Sources,2009,187(2):527-534.
[6] 王恒秀,李莉,李晉魯,等.一種新型制氫技術[J].化工進展,2001,20(7):1-4.
[7] 王濤,張熙貴,李巨峰,等.硼氫化鈉水解制氫的研究[J].燃料化學學報,2004,32(6):723-728.
[8] Fernandes R,Patel N,Miotello A,et al.Efficient catalytic properties of Co-Ni-P-B catalyst powders for hydrogen generation by hydrolysis of alkaline solution of NaBH4[J].International Journal of Hydrogen Energy,2009,34(7):2893-2900.
[9] 潘相敏,馬建新.燃料電池汽車供氫新技術——硼氫化鈉水解制氫[J].天然氣化工,2003,28(5):51-55.
[10] 戎維仁,邱德仁.硼氫化鈉溶液的分解和氫氧化鈉在溶液中的穩定機理[J].復旦學報:自然科學版,1998,37(3):276-278.
[11] Zhang Q,Smith G,Wu Y,et al.Catalytic hydrolysis of sodium borohydride in an auto-thermal fixed-bed reactor[J].International Journal of Hydrogen Energy,2006,31(7):961-965.
[12] Amendola S C,Sharp-Goldman S L,Janjua M S,et al.A safe,portable,hydrogen gas generator using aqueous borohydride solution and Ru catalyst[J].International Journal of Hydrogen Energy,2000,25(10):969-975.
[13] Pozio A,Francesco M D,Monteleone G,et al.Apparatus for the production of hydrogen from sodium borohydride in alkaline solution[J].International Journal of Hydrogen Energy,2008,33(1):51-56.
[14] 楊漢西,董華,艾新平.一種氫氣的制備方法及裝置:中國,1438169[P].2003-08-27.
[15] 王新東,程杰.一種化學硼氫化物水解制氫的即時自控供氫的方法及裝置:中國,101049907[P].2007-10-10.
[16] 毛宗強.氫能離我們還有多遠——我國燃料電池狀況、差距及對策[J].電源技術,2003,27(增刊):16-17.
[17] Schlesinger H I,Brown H C,Finholt A E,et al.Sodium borohydride,its hydrolysis and its use as a reducing agent and in the generation of hydrogen[J].Journal of American Chemical Society,1953,75(1):215-219.
[18] 鄭學家,鄭吉巖.硼氫化鈉的合成工藝及應用[J].遼寧化工,1999,28(1):55-56.
[19] C,etin C,akanylldlrlm,Metin Gürü.Production ofNaBH4and hydrogen release with catalyst[J].Renewable Energy,2009,34(11):2362-2365.
[20] StepanovN,Uvarov V,Popov I.Study of by-product of NaBH4hydrolysis and behavior at a room temperature[J].International Journal of Hydrogen Energy,2008,33(24):7378-7384.
[21] 沈培康,梁劍瑩,李永亮,等.去除硼氫化鈉分解制氫膠體產物的方法:中國,101250740[P].2008-08-27.
Progress in hydrogen production technology from hydrolysis of sodium borohydride
Zhang Xiang1,Sun kuibin2,Zhou Junbo1
(1.School ofM echanical and Electrical Engineering,Beijing University of Chem ical Technology,Beijing100029,China;2.CM TCC Shanghai Shisanye Construction Co.,Ltd.)
W ith the increasing depletion of fossil energy,hydrogen energy has become a new energy source,which can solve the current energy crisis.There are lots ofmethods for producing hydrogen.Because hydrogen storage capacity ofmetal hydride has absolute predominance compared with the othermaterials,the technology of hydrogen production from metal hydride has been developed rapidly,and sodium borohydride is just a typicalmetal hydride.As a safe and convenient way of hydrogen production,sodium borohydride hydrolysis technology of hydrogen production has become one of the hotspots in researching hydrogen sources for current fuel cells.Principles and advantages of this hydrogen supply technology were introduced.Factors that influence the rate of hydrogen production were summarized.Moreover,some examples of the equipment for thismethod were given.Lastly,the problems,application and development prospect of thismethod were pointed out.
hydrogen production;sodium borohydride;fuel cells
TQ116.2
A
1006-4990(2010)01-0009-04
2009-07-30
張翔 (1985— ),女,博士研究生 (在讀),研究方向為氣體分離與凈化工藝及設備研究。
聯 系 人:周俊波
聯系方式:zhogab@163.com

