A1腺苷受體的同源模建及其結構驗證
柯艷蓉 金宏威 劉振明 張亮仁
(北京大學醫學部藥學院,天然藥物及仿生藥物國家重點實驗室,北京 100191)
A1腺苷受體的同源模建及其結構驗證
柯艷蓉 金宏威 劉振明 張亮仁*
(北京大學醫學部藥學院,天然藥物及仿生藥物國家重點實驗室,北京 100191)
采用同源模建的方法構建了A1腺苷受體的三維結構,并與拮抗劑分子DPCPX對接,將得到的復合物結構進行5 ns的分子動力學模擬,以最后2 ns的平均結構和平衡后抽取的11幀構象共12個蛋白結構為研究對象,用包含52個活性分子和1000個誘餌分子的測試庫,分別通過DOCK、VINA和GOLD三種對接軟件進行評價,最終得出合理的蛋白質模型.根據top10%的富集因子(EF)和ROC曲線下面積(AU-ROC)的計算結果,我們認為GOLD是最適合A1腺苷受體的對接軟件,而12個蛋白質結構中F5和Favg的三維結構模型比較合理,可以作為進一步大規模虛擬篩選的模型.
分子動力學模擬;A1腺苷受體; 同源模建;GOLD; 虛擬篩選
腺苷受體是G蛋白偶合受體(GPCR)蛋白受體家族成員,其主要結構特征包括了七次跨膜的疏水螺旋區(transmembrane,TM1-TM7)、N端區、三個胞外LOOP區(extracellular loop,EL1-EL3)、三個胞內LOOP區(intracellular loop,IL1-IL3)和C端區.胞內IL3和C端區與G蛋白偶聯,從而影響環磷酸腺苷酶或磷酸脂酶C的活性,使細胞內產生第二信使,并通過信息傳遞,參與細胞物質代謝的調節和基因轉錄的調控.腺苷受體有四種亞型,分別為A1、A2A、A2B、A3[1],并且通過內源性的腺苷調節多種生理功能.腺苷受體有其獨特的藥理學特征、組織分布和偶聯蛋白,作為藥物靶標,其應用領域相當廣泛,主要可應用于局部缺血性疾病(大腦和心臟)、睡眠功能障礙、免疫功能和炎癥功能紊亂、癌癥等的治療.目前,已經設計合成出一系列的腺苷受體激動劑和拮抗劑,并且有部分化合物已進入臨床研究.
A1受體主要作用于中樞神經系統和外周循環系統,并且對機體有促進免疫的作用.A1受體集中分布在腦和脊髓中,主要是在海馬,小腦,上丘腦,皮質I、IV、VI中大量存在.另外,A1受體也廣泛分布于心臟,在腎臟、肺和膀胱、脂肪等組織細胞中也有表達.A1受體作為潛在的藥物靶標[2-3],吸引了很多的藥物工作者對它的研究.因為,一方面A1受體的拮抗劑主要應用于抗高血壓藥、鉀離子保留的利尿藥、認知功能增強藥、緩和阿爾茲海默綜合癥[4-5],也可用于治療癡呆、緩解焦慮[6],以及治療充血性心率衰竭患者的急性腎功能紊亂[7-8]等;另一方面,A1受體拮抗劑的發展可作為蛋白受體藥理學特征的分子探針.該受體拮抗劑分子設計主要以天然的咖啡因、茶堿為母核結構進行化學修飾,主要有兩種類型:黃嘌呤結構衍生物和非黃嘌呤結構衍生物(多聚雜環衍生物).目前,A1受體的晶體結構尚未解析出來,所以通常采用同源模建的方法構建該受體的模型.目前,已報道A1受體的模型,主要是以牛視紫紅質受體為模板[9-11].2007年,β2-腎上腺素受體晶體結構被解析出來后[12],Yuzlenko等[13]分別以牛視紫紅質受體和β2-腎上腺素受體為模板進行A1受體的同源模建,發現β2-腎上腺素受體更適合于腺苷受體的建模.2008年,Jaakola等[14]解析了A2A受體的晶體結構,給腺苷受體家族其他亞型受體的模建提供了更好的模板.
本文通過同源模建的方法模擬了A1受體的三維結構,將得到的模型與DPCPX拮抗劑進行分子對接,得到受體-配體復合物結構.將該復合物置于磷脂雙分子層中進行分子動力學模擬,使受體模型結構得到優化.將包含52個A1受體拮抗劑的測試庫分別與動力學平衡過程中抽取的11個構象和平均結構進行對接,以活性分子的top10%的富集因子(enrichment factor,EF)和ROC曲線下面積(AU-ROC)大小作為結果的評價依據,以便為進行大規模虛擬篩選提供合理的受體結構.
1 計算方法
A2A受體(分辨率0.26 nm,PDB編號3EML)結構數據來源于PDB蛋白晶體結構數據庫[15].A1受體的氨基酸序列來源于SWISS-PROT數據庫(登記號為P30542)[16].所有蛋白模建、模型優化、分子對接、動力學模擬計算均在DELL PowerEdge 2950(Xeon E5410-2.33G×2,內存8.0G)計算機工作站完成,所用程序為Sybyl 6.9(Tripos公司)和Discovery Studio (DS)2.1(Accelrys公司)分子設計軟件包[17-18],計算中選用的各項參數除特別說明外均使用缺省值.
1.1 同源模建
A1受體由326個氨基酸殘基組成.序列比對采用DS 2.1中的Align123程序,并根據A型G蛋白偶聯受體家族中高度保守的氨基酸殘基位置對結果進行手動調整.采用DS 2.1中的MODELER程序對A1受體模型進行搭建,使用BLOSUM矩陣,多序列斷點罰分(gap open penalty)為5.0,多序列斷點伸展罰分(gap extension penalty)為0.05.由程序自動生成10個模型,選取概率密度函數(probability density functions,PDF)對蛋白質幾何性質打分最高的模型,用Procheck程序進行合理性評價.
1.2 分子對接
首先使用SYBYL 6.9軟件對小分子和蛋白進行處理.A1受體拮抗劑DPCPX分子的初始結構使用sketch模塊構建,如圖1所示,并對小分子加氫和加Gasteige-Hückel電荷.對所構建的初始結構依次進行1000步最陡下降法和1000步共軛梯度法優化.使用Biopolymer模塊對蛋白模型加極性氫和賦予AMBER7 FF99電荷.分子對接使用GOLD 3.0.1程序[19],將DPCPX分子置入受體的活性位點.我們根據文獻報道的突變數據[20-21]來定義A1受體的活性位點,即以Ser94和His278兩個關鍵殘基的中心坐標為中心,半徑為2.5 nm的球形空間為活性口袋.該口袋包含的關鍵殘基有Leu88、Thr91、Gln92、Ser94、His251和His278[22].采用遺傳算法(GA)進行蛋白-配體對接,對接時考慮配體柔性和蛋白部分柔性.采用Goldscore打分函數,選擇打分值最高的小分子結合構象進行動力學研究.

圖1 DPCPX化學結構Fig.1 Chemical structure of DPCPX
1.3 分子動力學模擬
對于DPCPX分子使用Gaussian 03程序[23],用HF方法,在6-31G*基組水平下計算該分子的靜電勢.然后用AMBER 8.0軟件包中的Antechamber程序,用RESP方法計算DPCPX的部分原子電荷[24],得到小分子力場文件.MD模擬使用Gromacs 3.2.1程序包[25-26],用‘genbox’命令將對接得到的復合物置入DPPC256膜中.膜中心56個磷脂分子被自動刪除避免與蛋白產生碰撞.然后,對整個體系添加SPC水模型,添加13個氯離子,使體系保持電中性.模擬體系共有58147個原子,其中3078個蛋白質原子,200個磷脂膜分子,15011個水分子,13個氯離子.
采用Gromacs 96[27]力場,將蛋白質復合物-膜-水體系分別用最陡下降法和共軛梯度各進行1000步的能量優化,以避免模擬時原子間的不合理碰撞;然后,束縛蛋白和小分子,對膜-水體系進行200 ps的動力學模擬;再束縛蛋白主鏈和小分子,對蛋白側鏈-膜-水體系進行200 ps的動力學模擬;最后對整個體系進行5 ns的恒溫恒壓分子動力學模擬計算.動力學過程中,步長設為2 fs;使用Berendsen等[28]提出的溫度和壓力耦合方法,使系統溫度保持在310 K,耦合時間0.1 ps;壓力保持在105 Pa,采用0.5 ps耦合時間模擬自由水.模擬水分子的等溫壓縮系數設為 4.5×10-10Pa-1,用 LINCS(linear constraint)算法[29]約束所有原子的鍵長,計算距離小于1 nm的帶電基團之間的靜電相互作用;用PME(particle-mesh Ewald)方法[30]計算長程靜電相互作用,格點寬度設為0.12 nm;Lennard-Jones相互作用的截斷距離設為1 nm.
在最后2 ns模擬時間內,每隔20幀保留一個構象,總共抽取了11個構象,分別命名為F1-F11.再計算得到最后2 ns模擬時間內的平均結構,并對該結構進行真空中的800步最陡下降法和1200步的共軛梯度法的能量優化,獲得最終結構命名為Favg.這12個DPCPX-A1受體的復合物結構將用于進一步模型評價.
1.4 小分子數據庫的制作
從MDDR(Elevier MDL,San Leandro CA)數據庫中,隨機抽取52個A1受體的拮抗劑,與來自薛定諤網站上的1000個分子量為400的decoys,組成一個含有1052個分子的測試庫.使用Concord v 6.1.3程序得到測試庫分子的三維結構用于虛擬篩選評價.
1.5 模型評價
虛擬篩選評價采用VINA、DOCK 4.0、GOLD 3.0.1三種對接軟件.使用DOCK 4.0軟件包[31-32]進行對接時,通過Sphgen程序對蛋白負像進行聚類,以每個復合物結構中的配體分子定義活性位點,格點球半徑為1 nm.對接結果以能量打分進行排序.使用VINA軟件[33]進行對接,受體和小分子先后在MGLTools 1.4.6中打開進行對接前文件處理,對于受體結構,添加極性氫原子,計算電荷.用小分子定義活性位點的中心,并界定2 nm×2 nm×2 nm的對接格點范圍.對接結果進行能量排序.使用GOLD 3.0.1軟件[19]進行對接,以配體小分子定義活性位點,以小分子為中心半徑為2.5 nm的球形空間為活性口袋.采用遺傳算法(GA)進行蛋白-配體對接,對接時考慮配體柔性和蛋白部分柔性.采用Goldscore打分作為打分函數,以GOLD fitness function值進行排序.
2 結果與討論
2.1 同源模型的評價
通過Align123程序的序列比對如圖2所示,結果表明A1和A2A具有較高的序列相似度(similarity:71.6%)和一致性(identity:54.1%),是以其他GPCRs蛋白晶體結構為模板的多序列比對達不到的.而且,模建模型中保留了腺苷受體TM3和EL2二硫鍵(A1:Cys80-Cys169)的特征,且EL3中Cys260-Cys263二硫鍵特征(見圖3)與A2A晶體結構二硫鍵特征相符[14].我們使用Procheck程序對模型結構的立體化學參數進行了評價,該程序可以憑經驗比較給定蛋白質結構與最合理的蛋白質結構之間立體化學性質的差異.評價結果中主要考察所有氨基酸殘基骨架的二面角分布,并通過程序生成的Ramachandran圖來表示(見圖4).我們可以看到模建的蛋白質有93.5%的殘基落入最佳區域(the most favoured regions),5.8%的殘基落入其它許可區(additional allowed regions),0.7%的殘基落入勉強許可區(gener-ously allowed regions),無殘基落入不允許區(disallowed regions).上述結果說明模建得到的A1受體模型氨基酸二面角結構是比較合理的.


2.2 受體抑制狀態模型的構建和分子動力學模擬
DPCPX是黃嘌呤結構的高選擇A1受體的拮抗劑分子,該分子與A1受體的親和力 Ki值為3.9 nmol·L-1,其選擇性表現為該分子與其它亞型受體的親和力 Ki值分別為 A2A:129 nmol·L-1、A2B:56 nmol·L-1、A3:3980 nmol·L-1[34].而且,同位素[3H] DPCPX被廣泛應用于A1和A2B受體放射性結合實驗和突變實驗研究.因此,我們選擇DPCPX分子與A1模型進行分子對接.選擇Goldscore打分最好的構象,進行下一步的動力學模擬.

將A1受體-DPCPX復合物模型置于DPPC膜中進行了5 ns的分子動力學模擬(圖5).在模擬過程中,DPCPX小分子拮抗劑誘導大分子受體構象逐漸變化,最終達到能量平衡.相對于起始結構的均方根偏差(RMSD)計算結果證明了軌跡的穩定性.圖6給出了5 ns模擬時間內蛋白質骨架和小分子的RMSD值隨時間的變化曲線.可以看到,在開始的1.5 ns模擬時間內,蛋白質骨架的RMSD值(黑色曲線)緩慢上升達到0.25 nm,表明了蛋白分子的運動和結構的不斷變化.而在1.5 ns之后,RMSD值趨于穩定,在 0.25-0.3 nm之間上下波動.小分子的RMSD值(紅色曲線)變化不大,一直穩定在0.1 nm范圍內,處于平衡的動力學狀態.從該體系在模擬過程中的勢能變化曲線(圖7)可以看出,體系的勢能在最初的十幾ps時間內迅速降低,然后隨著模擬的進程勢能逐漸降低,并從3 ns開始勢能趨于穩定直到5 ns,說明該體系已經達到平衡.根據分子動力學模擬結果,我們從3 ns起每隔20幀取一個構象,共取得11個構象(F1-F11).再加上3-5 ns時間內的平均結構(Favg),共得到12個結構.

圖5 動力學模擬過程中DPPC256磷脂膜-A1受體-DPCPX體系的初始結構模型Fig.5 Initial model containing DPPC256,A1 receptor,and DPCPX for the molecular dynamics simulation
圖8給出了Favg中,小分子和蛋白的結合模式.我們可以看到,DPCPX分子主要結合區域是TM2、TM3、TM6、TM7,殘基 His278、Val58、Val87和殘基 Leu90、Thr91、Ala54、Asp55分別構成了兩個疏水性口袋,與DPCPX分子的1位和3位的丙基有疏水作用;Leu51、Leu98、Asn284和Leu239殘基也構成了疏水性口袋,與8位的環戊烷有疏水作用.此外,DPCPX的4位羰基與Asn280和Ser281肽鍵上的氨基形成氫鍵(氫鍵鍵長:0.2 nm),7位氨基氮與Ser94的羥基氧具有氫鍵相互作用(氫鍵鍵長:0.3 nm).根據文獻報道,對于A1腺苷受體,突變Ser94和His278這兩個氨基酸殘基,則蛋白完全喪失與拮抗劑的結合.我們的對接結果與突變實驗結果基本符合[20-22].
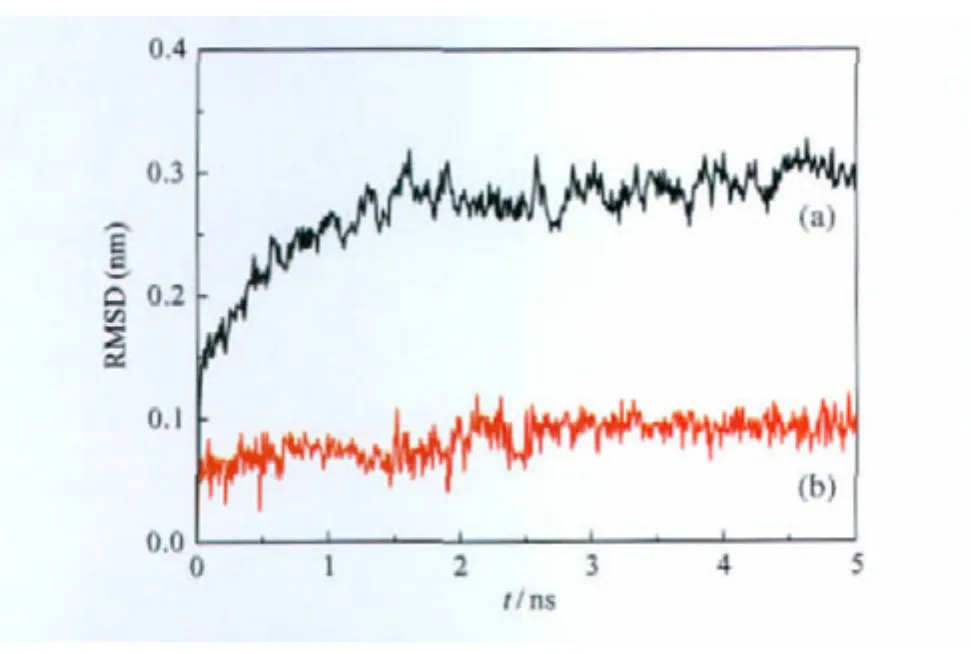
圖6 5 ns動力學模擬過程中蛋白質骨架(a)和小分子拮抗劑DPCPX(b)的均方根偏差(RMSD)與時間的關系曲線Fig.6 Root mean square deviation(RMSD)vs time of the atoms from their initial positions during the 5 ns simulation of protein backbone(a)and DPCPX(b)
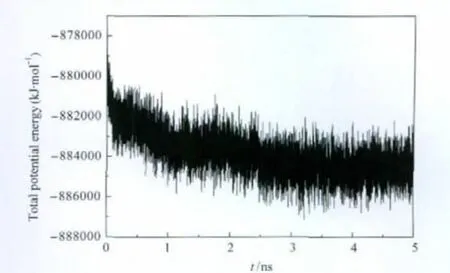
圖7 動力學模擬過程中體系的勢能變化Fig.7 Total potential energy changes of the system during molecular dynamics simulation
2.3 用測試數據庫驗證模型
采用DOCK 4.0、VINA和GOLD 3.0.1對接軟件,將分子動力學模擬得到的12個蛋白質模型與測試庫分子進行對接.用EF和AU-ROC兩個參數來評價蛋白模型是否合理.
EF是評價虛擬篩選好壞的一個重要指標,它是指,在選擇的排名前百分之幾(例如10%)的數據集中活性分子的濃度與初始活性分子濃度的比值.這個指標用于評價篩選中篩選出活性分子的陽性率.富集因子計算公式為[35]:
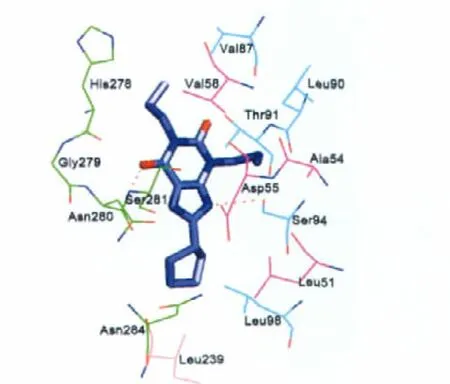
圖8 DPCPX與A1受體結合模式Fig.8 Binding profile of DPCPX and adenosine A1receptorred:the residues in TM2;blue:the residues in TM3; orange:the residues in TM5;green:the residues in TM6
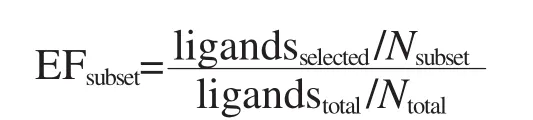
其中,ligandsselected指選擇的排名前10%的分子中活性小分子的數量,Nsubset指選擇的前10%的小分子的數量,ligandstotal指整個測試庫中活性分子的總數,為52,Ntotal指整個測試庫分子的總數,為1052.
ROC(receiver operator characteristic)曲線描繪的是敏感度(sensitivity,Se)和特異性(specificity,Sp)的關系.AU-ROC值指的是ROC曲線下的面積[36-37].這個指標用于測試虛擬篩選策略的優劣,當被評價的篩選策略都篩選出相同比例的誘餌分子時,篩出活性分子的比例越高說明該策略對活性分子的敏感度越高.AU-ROC值是以具體數值表示ROC曲線下的面積,該值的區間是[0,1],1表示篩出0個誘餌分子時篩出所有的活性分子;0表示篩出全部的誘餌分子中不含有活性分子.
因此,我們希望真正有活性的化合物能夠盡可能富集在前百分之十比例(top10%)的篩選結果中,我們也希望AUC曲線下面積能越大越好,這樣有利于評價這12個蛋白結構的優劣性,選擇更合理的蛋白結構和更合適的對接軟件用于進一步大規模虛擬篩選研究和小分子結合模式的研究.將12個蛋白質結構分別通過DOCK 4.0、VINA、GOLD 3.0.1三個對接軟件分別與測試數據庫對接后,對接結果用相應的評分函數打分并進行排序和計算,得到相關的測試庫中52個活性分子的EF和AU-ROC值(表1).從表 1中 EF10和AU-ROC的均值,可看出DOCK、GOLD、VINA三種對接軟件中,最適合A1受體進行虛擬篩選的對接軟件是GOLD.而且,三種對接軟件都可以特異性地選擇某些構象的蛋白結構.對于DOCK軟件更趨向于選擇F8、F3、F4蛋白結構,VINA軟件更趨向于選擇F2、Favg、F6蛋白結構,而GOLD軟件更趨向于選擇F5、Favg、F4蛋白結構.
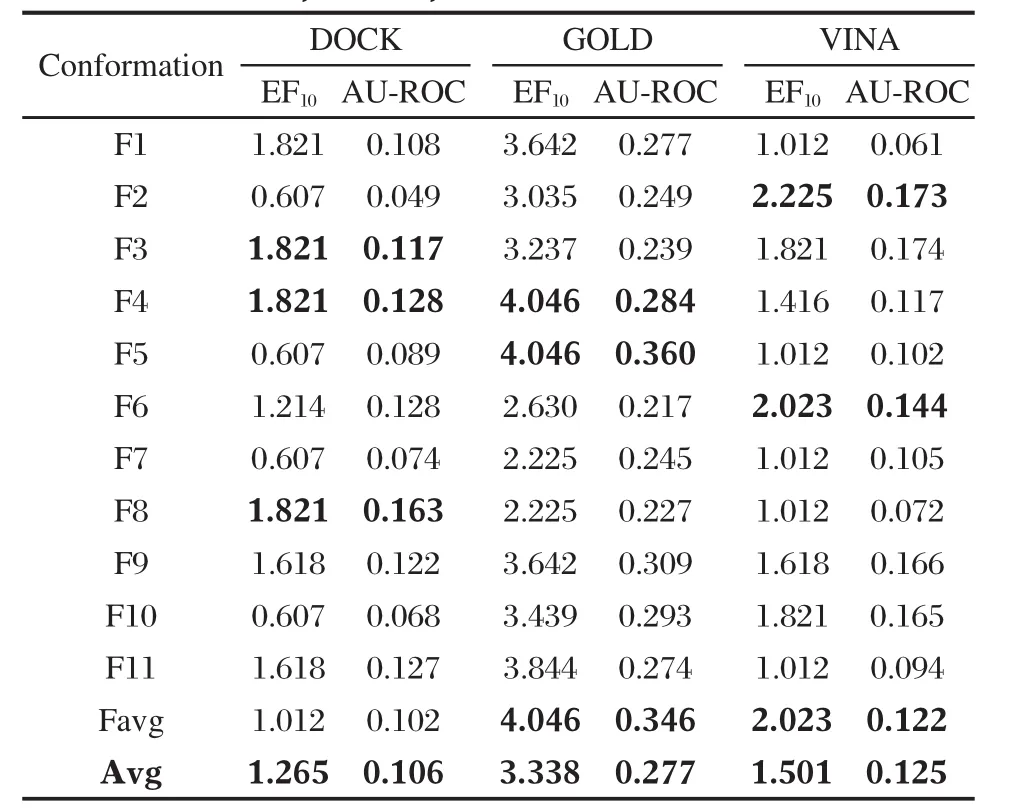
表1 DOCK、GOLD和VINA軟件的對接評價結果Table 1 Evaluations of docking results obtained by DOCK,GOLD,and VINA softwares
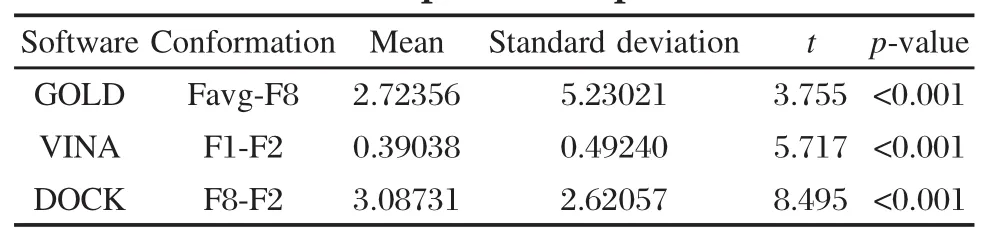
表2 DOCK、GOLD和VINA軟件配對t檢驗的結果Table 2 Results of DOCK,GOLD,and VINA softwares′paired samples test
分別以三個軟件中各自評價最高和評價最低的兩組蛋白模型對接計算中52個活性分子的對接能量值作為樣本數據,利用SPSS軟件進行了配對t檢驗統計學分析,在5%顯著性水平的條件下,自由度為50的t臨界值為3.261.選擇的蛋白模型包括Favg和F8(GOLD)、F2和F1(VINA)以及F8和F2 (DOCK),分析結果見表2.可以看到,對于GOLD(t= 3.775,p<0.001)、VINA(t=5.717,p<0.001)和DOCK (t=8.495,p<0.001)計算所得的t值明顯大于臨界值,說明對接中各自的兩組蛋白的小分子對接能量存在著顯著性差異,即Favg蛋白的虛擬篩選能力比F8蛋白強(GOLD);F1蛋白的虛擬篩選能力比F2蛋白強(VINA);F8蛋白的虛擬篩選能力比F2蛋白強(DOCK).總之,DOCK、GOLD和VINA對接軟件可以特異性地選擇某些構象的蛋白質結構,并可以區分出蛋白模型的優劣.
應用GOLD軟件進行虛擬篩選時,F4、F5和Favg的EF10值均為4.046,說明它們是12個蛋白質模型中比較合理的結構.此外,這三個蛋白質結構的曲線下面積(AU-ROC)分別為0.284、0.360、0.346,說明F5和Favg是兩個不錯的模型,可用于進一步的大規模虛擬篩選和小分子拮抗劑結合模式的研究.
3 結 論
用同源模建的方法對A1受體的三維結構進行構建,經過磷脂雙分子膜中的分子動力學模擬,抽取了動力學平衡中最后2 ns的11個構象(F1-F11)和計算動力學平衡中的平均構象(Favg).用包含52個活性分子的測試庫分別用DOCK、VINA、GOLD三種軟件與12個模型進行對接以驗證模型結構,從EF10和AU-ROC平均值結果分析表明GOLD軟件是這三個軟件中最適合A1受體虛擬篩選.而且,這三種軟件都具有篩選出最優構象模型的能力,最優構象與最劣構象的小分子對接能量存在著顯著性差異.從GOLD軟件對12個蛋白模型的選擇中,我們可知F5和Favg是最合理的蛋白結構模型,可進一步用于大規模虛擬篩選和小分子拮抗劑結合模式的研究.
1 Ralevic,V.;Burnstock,G.Pharmacol.Rev.,1998,50:413
2 Müller,C.E.;Stein,B.Curr.Pharm.Design,1996,2:501
3 Poulsen,S.A.;Quinn,R.J.Bioorg.Med.Chem.,1998,6:619
4 Müller,C.E.Expert.Opin.Ther.Pat.,1997,7:419
5 Hess,S.Expert.Opin.Ther.Pat.,2001,11:1533
6 Maemoto,T.J.Pharmacol.Sci.,2004,96:42
7 Wilcox,C.S.;Welch,W.J.;Schreiner,G.F.;Belardinelli,L. J.Am.Soc.Nephrol.,1999,10:714
8 Gottlieb,S.S.Circulation,2002,105:1348
9 Giordanetto,F.;Fossa,P.;Menozzi,G.;Schenone,S.;Bondavalli, F.;Ranise,A.;Mosti,L.J.Comput.Aided Mol.Des.,2003,17:39
10 Gutiérrez-de-terán,H.;Centeno,N.B.;Pastor,M.;Sanz,F. Proteins,2004,54:705
11 Tuccinardi,T.;Ortore,G.;Manera,C.;Saccomanni,G.;Martinelli, M.Euro.J.Med.Chem.,2006,41:321
12 Cherezov,V.Science,2007,318:1258
13 Yuzlenko,O.;Kiec-Kononowicz,K.J.Comput.Chem.,2009,30: 14
14 Jaakola,V.P.Science,2008,322:1211
15 http://www.gpcr.org
16 http://expasy.org/sprot/
17 SYBYL software.Version 6.9.St.Louis:Tripos.Associates.Inc.
18 Discovery Studio software.Version 2.1.San Diego:Accelrys.Inc.
19 Jones,G.;Willett,P.;Glen,R.C.;Leach,A.R.;Taylor,R.J.Mol. Biol.,1997,267:727
20 Barbhaiya,H.;McClain,R.;Ijzerman,A.;Rivkees,S.Mol. Pharmacol.,1996,50:1635
21 Olah,M.E.;Ren,H.;Ostrowski,J.;Jacobson,K.A.;Stiles,G.L. J.Biol.Chem.,1992,267:10764
22 Martinelli,A.;Tuccinardi,T.Mol.Res.Rev.,2008,28:247
23 Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 03. Revision B.03.Wallingford,CT:Gaussian Inc.,2003
24 Bayly,C.I.;Cieplak,P.;Cornell,W.D.;Kollman,P.A.J.Phys. Chem.,1993,97:10269
25 Berendsen,H.J.C.;van der Spoel,D.;van Drunen,R.Comp.Phys. Commun.,1995,91:43
26 Lindahl,E.;Hess,B.;van der Spoel,D.J.Mol.Model.,2001,7: 306
27 van der Spoel,D.;Buuren,A.R.V.;Tieleman,D.P.;Berendsen, H.J.J.Biomol.NMR,1996,8:229
28 Berendsen,H.J.C.;Postma,J.P.M.;van Gunsteren,W.F.; Dinola,A.;Haak,J.R.J.Chem.Phys.,1984,81:3684
29 Hess,B.;Bekker,H.;Berendsen,H.J.C.;Fraaije,J.G.E.M. J.Comput.Chem.,1997,18:463
30 Darden,T.;York,D.;Pedersen,L.J.Chem.Phys.,1993,98: 10089
31 Kuntz,I.D.;Blaney,J.M.;Oatley,S.J.;Langridge,R.;Ferrin,T. E.J.Mol.Biol.,1982,161:269
32 Ewing,T.J.A.;Kuntz,I.D.J.Comput.Chem.,1997,18:1175
33 Trott,O.;Arthur,J.O.J.Comput.Chem.,2010,31:455
34 Moro,S.;Gao,Z.G.;Jacobson,K.A.;Spalluto,G.Med.Res.Rev., 2006,26:131
35 Wei,B.Q.;Baase,W.A.;Weaver,L.H.;Mattews,B.W.; Shoichet,B.K.J.Mol.Biol.,2002,322:339
36 Hevener,K.E.;Zhao,W.;Ball,D.M.;Babaoglu,K.;Qi,J.J.; White,S.W.;Lee,R.E.J.Chem.Inf.Model.,2009,49:444
37 Truchon,J.F.;Bayly,C.I.J.Chem.Inf.Model.,2007,47:488
May 19,2010;Revised:June 7,2010;Published on Web:July 14,2010.
Homology Modeling and Structure Validation of the Adenosine A1Receptor
KE Yan-Rong JIN Hong-Wei LIU Zhen-Ming ZHANG Liang-Ren*
(State Key Laboratory of Natural and Biomimetic Drugs,School of Pharmaceutical Sciences,Health Science Center, Peking University,Beijing 100191,P.R.China)
A three dimensional structure model of the adenosine A1receptor was built using homology modeling. The antagonist DPCPX was docked into the model protein to form a receptor-ligand complex.A molecular dynamics simulation over 5 ns was performed for this complex.We selected 12 protein structures,including the average structure obtained from the last 2 ns of the simulation and 11 frames extracted after equilibration for the study.A database comprising 52 active antagonists and 1000 decoys was then docked into the 12 protein models using DOCK,VINA, and GOLD software packages and these molecules were ranked by their docking scores.The best model protein with the highest enrichment factor(EF)and the largest area under the ROC(AU-ROC)was chosen for further study.The results from the enrichment factor at 10%of the ranked database(EF10)and AU-ROC calculations indicate that GOLD is the best virtual screening software for the adenosine A1receptor.GOLD docking results suggest that optimized adenosine A1receptor protein structures,Favg and F5,can be used for virtual screening and for novel design to discover more potent antagonists.
Molecular dynamics simulation;Adenosine A1receptor;Homology modeling;GOLD; Virtual screening
O641
*Corresponding author.Email:liangren@bjmu.edu.cn;Tel:+86-10-82802567.
The project was supported by the National S&T Major Project Foundation,China(2009ZX09501-002).
國家科技重大專項關鍵技術基金(2009ZX09501-002)資助項目

