板栗殼棕色素抗氧化性研究與紅外光譜分析*
李莉,顧欣,崔潔,孟阿會,侯亞坤,王建中
隨著現代食品工業的發展,人們逐漸認識到天然色素具有諸多優點,開發并研究新的天然色素成為研究熱點。板栗殼棕色素是從廢棄的板栗殼中提取出來的一種天然棕色素,此棕色素含量高,穩定性較強,耐熱,經高溫處理后,顏色無明顯變化且抑菌效果不發生明顯的改變,可用于高溫操作中;耐光,在日光,燈光及紫外光等照射下無明顯顏色變化;耐酸堿,在pH=4~14內色調穩定[1],不僅可以用于食品著色,還可用于紡織品著色等工業領域[2]。多數研究表明,板栗殼棕色素的主要活性成分為黃酮類化合物,而黃酮類化合物一般都具有抗氧化活性,因此板栗殼棕色素相關性質的研究具有十分重要的意義。本文用磷鉬試劑、清除 DPPH自由基、清除羥基自由基和清除超氧陰離子 4種評價方式,分析比較了質量分數1%的 NaOH溶液和體積分數 40%的乙醇溶液提取的板栗殼棕色素的抗氧化性能,并比較堿提栗殼棕色素和醇提栗殼棕色素的紅外光譜圖,以期對板栗殼棕色素的進一步利用提供依據。
1 材料與方法
1.1 試驗材料與試劑
成熟的遷西板栗,250℃烘烤 10 min后剝殼,板栗殼磨粉備用。
1,1-二 苯 基 -2-苦 肼 基 (1,1-dipheny1-2-picrylhydrazyl,DPPH),Sigma公司 ;VC,2,6-二叔丁基 -4-甲基苯酚(BHT)、鄰苯三酚、鉬酸銨、三羥甲基氨基甲烷 (Tris)、磷酸鈉、溴化鉀、硫酸亞鐵、雙氧水、水楊酸、氫氧化鈉,天津市津科精細化工研究所;分析純試劑 98%濃硫酸、無水乙醇、鹽酸,北京化工廠;分析純試劑試驗用水為蒸餾水。
1.2 試驗儀器
752 SPECTROPHOTOMETER紫外分光光度計,上海美譜達儀器有限公司;冷凍離心機,美國 Ther mo Fisher Scientific公司;冷凍干燥機 (LL1500),美國Thermo Fisher Scientific公司;Nesus670紅外光譜儀,美國 Nicolet公司。
1.3 試驗方法
1.3.1 堿提板粟殼色素
用 1%的 NaOH溶液浸泡粉碎的板栗殼,在 50℃的水浴中提取 5h,然后抽濾取清液,用 0.1 mol/L HCl調成中性,分別用石油醚和乙酸乙酯各洗滌 3次,以除去脂溶性成分,旋轉蒸發至 1/10體積后冷凍干燥,得堿提板栗殼棕色素Ⅰ,稱重,計算堿提栗殼棕色素提取得率,色素備用[1]。
1.3.2 醇提板粟殼色素
用 40%的乙醇溶液浸泡粉碎的板栗殼,在 50℃水浴中提取 5 h,然后抽濾取清液,旋轉蒸發至 1/10體積后冷凍干燥,得醇提板栗殼棕色素Ⅱ,稱重,計算醇提栗殼棕色素提取得率,色素備用。
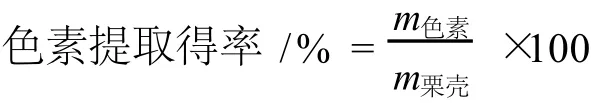
式中:m色素,冷凍干燥后得到色素的質量;m栗殼,用于提取色素的栗殼的質量。
用蒸餾水分別溶解堿提栗殼棕色素、醇提栗殼棕色素和VC并配制成以下所需的各個濃度,備用;用無水乙醇溶解 BHT并配制成以下所需的各個濃度,備用。
1.3.3 磷鉬絡合物法測定板栗殼棕色素總抗氧化活性
磷鉬絡合物法測定總抗氧化活性的原理是Mo(V I)被抗氧化物質還原能夠生成綠色的Mo(V)絡合物,在波長 695 nm處有最大吸收波長,而且抗氧化物質活性越強,測定的吸光度值越大[3-4]。
磷鉬試劑的配制:0.6 mmol/L硫酸,28 mmol/L磷酸鈉和 4 mmol/L鉬酸銨。
在 15 mL具塞試管中分別加入 4 mL磷鉬試劑,再加入 0.4 mL濃度分別為 0.1,0.5,1.0,1.5,2.0 mg/mL的堿提栗殼棕色素、醇提栗殼棕色素、BHT和VC,95℃反應 90 min,自然晾涼至室溫,695 nm測吸光度值A,對應物質的抗氧化性越強,則測定的吸光度值A越大,用ΔA來反映物質的總抗氧化活性。
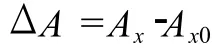
式中:Ax,加樣品后的吸光度值;Ax0,空白吸光度值
1.3.4 清除DPPH自由基的方法測定板栗殼棕色素抗氧化活性
1,1-二苯基苦基苯肼 (DPPH)是一種穩定的有機自由基,溶于乙醇呈紫色,在可見光區的 517 nm處存在最大吸收峰,且其濃度與吸光度呈線性關系,通過被測物質對DPPH自由基的清除能力可以表示其抗氧化性的強弱。
稱取 0.003 8 g DPPH用無水乙醇溶解,定容至50 mL,搖勻得到濃度為 2×10-4mol/L的 DPPH溶液,放在冰箱中備用。在 15 mL具塞試管中分別加入2 mL濃度分別為 0.02、0.06、0.10、0.14、0.18、0.20 mg/mL的醇提栗殼棕色素、堿提栗殼棕色素、BHT和VC。再分別加入 2mL DPPH溶液,避光反應 30 min后在 517 nm處測定吸光度。以 2 mL樣品溶液加入2 mL無水乙醇作為對照,以 2 mL DPPH溶液加入 2 mL蒸餾水作為空白,計算對 DPPH自由基的清除率[5-9]。
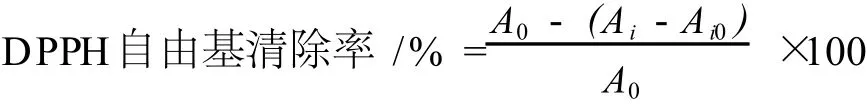
Ai:2 mLDPPH溶液 +2 mL樣品溶液;Ai0:2 mL樣品溶液 +2 mL無水乙醇;A0:2 mLDPPH+2 mL蒸餾水。以無水乙醇溶液作為參比。
1.3.5 清除羥基自由基 (·OH)的方法測定板栗殼棕色素抗氧化活性
Fenton反應是以 H2O2為氧化劑,以 Fe2+為催化體系的氧化反應,在反應中生成羥基自由基 (·OH),分析·OH對水楊酸-乙醇體系的氧化情況,確定待測樣品的存在是否對·OH有清除作用。與此同時,Fe2+被氧化成 Fe3+可能產生混凝沉淀。
稱取 0.083 4 g FeSO4·7H2O溶于少量蒸餾水中,然后轉移到 50 mL容量瓶中準確定容,得到 6 mmol/L FeSO4溶液;稱取 0.041 4 g水楊酸溶于少量無水乙醇中,然后轉移到 50 mL容量瓶中用無水乙醇準確定容,得到 6 mmol/L的水楊酸-乙醇體系;用微量移液器量取 166.7μL 30%的雙氧水用蒸餾水定容至 50 mL容量瓶中,得到 0.1%的 HO[10-11]。22
在 15 mL的具塞試管中分別加入 1 mL 6 mmol/LFeSO4溶液,1 mL 6 mmol/L的水楊酸-乙醇溶液,再分別加入 1 mL濃度分別為 0.5、1.0、1.5、2.0、2.5 mg/mL樣品溶液,最后加入 1 mLH2O2啟動反應,37℃水浴反應 30 min后,以 8 000 r/min速度離心 5 min,取上清液在 510nm處測定吸光度,以蒸餾水代替 H2O2作為對照組,以蒸餾水代替樣品作為空白。
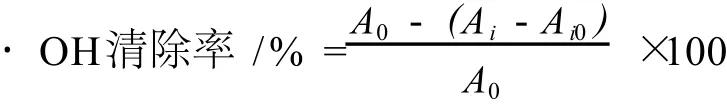
Ai:為樣品組;Ai0:以蒸餾水代替 H2O2的對照組;A0:以蒸餾水代替樣品的空白。
采用鄰苯三酚自氧化的方法,稱取三羥甲基氨基甲烷 (Tris)12.11g,用蒸餾水溶解定容至 1 000 mL,得到 0.1 mol/L Tris溶液;取 50 mL 0.1 mol/L Tris溶液與 22.9 mL 0.1 mol/L鹽酸混勻并稀釋至 100 mL,調整 pH值為 8.2,得到 50 mmol/LTris-HCl緩沖溶液;稱取 0.037 8 g鄰苯三酚用 10 mmol/L HCl解定容至 100 mL,得到 3 mmol/L鄰苯三酚,棕色瓶,避光保存。
取 50 mmol/L Tris-Hcl緩沖溶液 (pH=8.2)2.25 mL,加入 2 mL濃度分別為 0.2、0.4、0.6、0.8、1.0mg/mL的待測樣品 (對照加蒸餾水),混勻后 25℃水浴保溫 20 min,然后加入 3 mmol/L的鄰苯三酚 0.3 mL,反應 2 min后,在 325 nm處測吸光度,每 30 s測定一次,共測定 5 min(10個數據)。以反應時間為橫坐標,對應吸光度A值為縱坐標,計算斜率,以斜率反映鄰苯三酚的自氧化速率,以蒸餾水作為對照,計算樣品對·的清除率[12-13]。
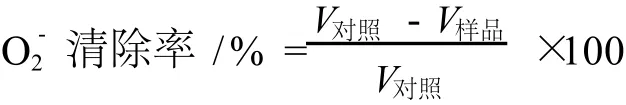
V樣品:加入樣品后鄰苯三酚自氧化速率;V對照:加入蒸餾水后鄰苯三酚自氧化速率。
1.3.8 板栗殼棕色素的紅外光譜分析
稱取堿提板栗殼棕色素和醇提板栗殼棕色素各2 g,稱取 2 000 g的溴化鉀粉末 2份,將板栗殼棕色素分別與溴化鉀粉末在瑪瑙研缽中研成細粉并混勻,灌注于模具中進行壓片,置于紅外光譜儀中進行測定。掃描范圍為 4 000~400 cm-1;分辨率 8 cm-1,掃描次數 32次。
2 結果與分析
2.1 堿提醇提板栗殼色素的得率
采用 1%的 NaOH溶液提取板栗殼棕色素的得率為 25.3%,用 40%的乙醇溶液提取板栗殼棕色素的得率為 27.1%,提取得率很接近。
2.2 板栗殼棕色素抗氧化效果檢驗
2.2.1 總抗氧化性測定結果
從圖1中可以看出,堿提栗殼棕色素、醇提栗殼棕色素、BHT和VC的抗氧化能力都隨樣品濃度的增加而增強,VC的總抗氧化能力最強,其次是醇提栗殼棕色素,濃度在 0~1.60 mg/mL時,BHT的總抗氧化能力略強于堿提栗殼棕色素,濃度高于 1.60 mg/mL以后,堿提栗殼棕色素的總抗氧化能力強于BHT。
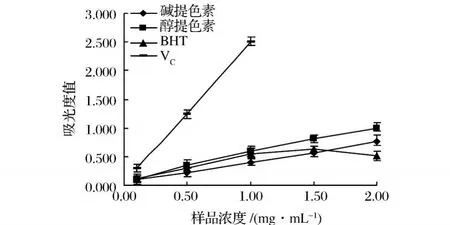
圖1 不同樣品的總抗氧化能力比較
2.2.2 對 DPPH自由基的清除效果
從圖2中可以看出,堿提栗殼棕色素、醇提栗殼棕色素、BHT和 VC對 DPPH自由基都具有清除作用,VC的清除作用最強,然后依次是醇提栗殼棕色素、堿提栗殼棕色素和 BHT,隨著樣品濃度的升高,對DPPH的清除作用都逐漸增強。VC在較低濃度0.02 mg/mL時,對 DPPH的清除率就可以達到87.9%;醇提栗殼棕色素在濃度為 0.20 mg/mL時,清除率可以達到 85%左右,此時與 VC的效果比較接近。醇提栗殼棕色素的 IC50值約為 0.02 mg/mL,堿提栗殼棕色素的 I C50值約為 0.09 mg/mL。
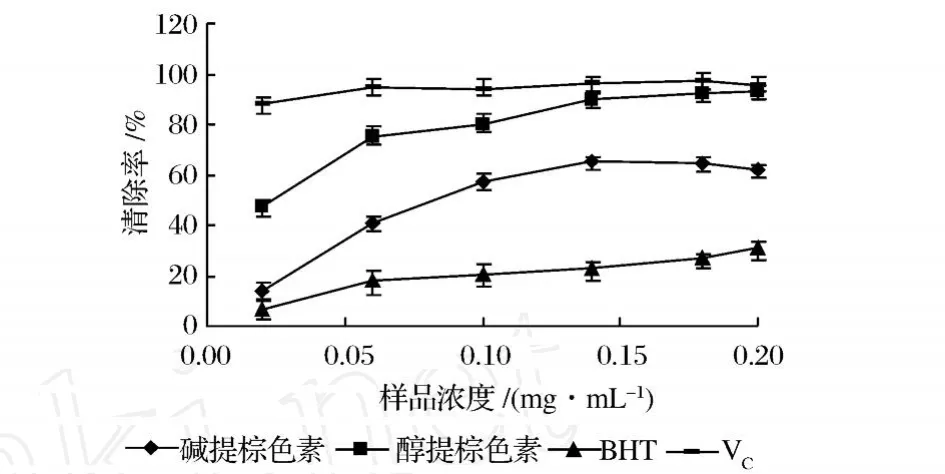
圖2 不同濃度樣品清除DPPH自由基能力比較
2.2.3 對羥基自由基 (·OH)的清除效果
從圖3中可以看到,堿提栗殼棕色素、醇提栗殼棕色素、BHT和 VC都對·OH具有清除作用,且都隨著樣品濃度增大清除作用增強,在低濃度 0.50~1.00 mg/mL時,BHT>醇提栗殼棕色素 >堿提栗殼棕色素 >VC,在 1.20~2.00 mg/mL內,堿提栗殼棕色素 >VC>醇提栗殼棕色素 >BHT;較大濃度 2.10~2.50 mg/mL內,VC>堿提栗殼棕色素 >醇提栗殼棕色素 >BHT。VC的 IC50值約為 1.57 mg/mL,堿提栗殼棕色素的 IC50值約為 1.62 mg/mL,對·OH的清除效果相當于 VC的 96.91%,醇提栗殼棕色素的I C50值約為 1.90 mg/mL,對·OH的清除效果相當于VC的 82.63%,均比 BHT清除效果強。
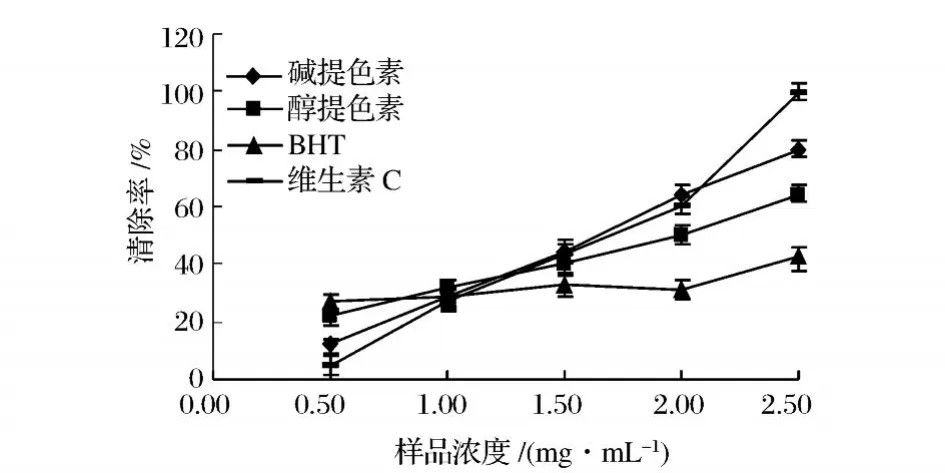
圖3 不同濃度樣品清除羥基自由基的能力
從圖4中可以看出,堿提栗殼棕色素、醇提栗殼棕色素、BHT和 VC對都具有清除作用,但 VC和BHT對清除效果明顯強于 2種栗殼棕色素,堿提栗殼棕色素和醇提栗殼棕色素隨著濃度增大對清除效果逐漸增強,濃度高于 0.95 mg/mL時,堿提栗殼棕色素清除的效果強于等濃度的BHT。堿提栗殼棕色素的 IC50值約為 0.71 mg/mL,醇提栗殼棕色素的 IC50值約為 0.83 mg/mL,濃度低于 0.42 mg/mL時,醇提栗殼棕色素清除的效果強于堿提栗殼棕色素;濃度高于 0.42 mg/mL時,堿提栗殼棕色素清除效果強于醇提色素。

圖4 不同濃度樣品清除超氧陰離子的能力
2.3 堿提栗殼棕色素和醇提栗殼棕色素的紅外光譜分析[14-15]
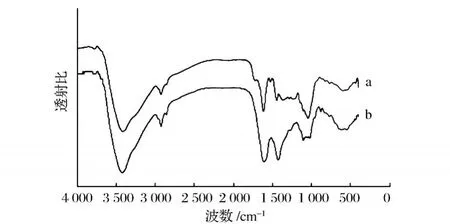
圖5 醇提栗殼棕色素 (a)和堿提栗殼棕色素 (b)的紅外光譜圖
堿提栗殼棕色素的紅外光譜和醇提栗殼棕色素的紅外光譜均在 3 300~3 500 cm-1內出現較強的吸收峰,此為 O—H鍵的伸縮振動峰;在 2 924 cm-1出現吸收峰,此處是甲基與亞甲基的 C—H伸縮振動峰,在 1 600 cm-1附近出現吸收峰,堿提栗殼棕色素在 1 607.24 cm-1處,醇提栗殼棕色素在 1 613.48 cm-1處為芳香環的伸縮振動。
在 1 500~500 cm-1內 2種栗殼棕色素的吸收峰有所差異,譜圖顯示 (圖5)醇提栗殼棕色素的吸收峰略多于堿提栗殼棕色素。
堿提栗殼棕色素在 1 427.50、1 102.13、621.70 cm-1有強弱不等的吸收峰。醇提栗殼棕色素在1 525.50、1 445.98、1 355.07、1 045.80、596.65 cm-1處有強弱不等的吸收峰。
3 結論
研究表明,1%的 NaOH溶液和 40%的乙醇溶液提取的板栗殼棕色素都具有一定的抗氧化性,但是評價方法不同相應反映出的抗氧化能力也不同。堿提栗殼棕色素,醇提栗殼棕色素和 BHT的總抗氧化能力比較接近,但弱于 VC;磷鉬試劑法反映出總抗氧化能力都隨著樣品濃度的增大而增強;清除 DPPH自由基時,VC清除效果最強,然后依次是醇提栗殼棕色素,堿提栗殼棕色素和 BHT,VC在較低濃度 0.02 mg/mL時,對 DPPH的清除率就可以達到 87.9%,醇提栗殼棕色素在濃度為 0.20 mg/mL時,清除率可以達到 85%左右,醇提栗殼棕色素的 IC50值約為 0.02 mg/mL,堿提栗殼棕色素的 IC50值約為 0.09 mg/mL;清除羥基自由基 (·OH)時,隨著色素濃度增大對·OH的清除作用增強,堿提栗殼棕色素,醇提栗殼棕色素,BHT和 VC的抗氧化效果接近,VC的 IC50值約為 1.57 mg/mL,堿提栗殼棕色素的 IC50值約為 1.62 mg/mL,對·OH的清除效果相當于 VC的 96.91%,醇提栗殼棕色素的 IC50值約為 1.90 mg/mL,對·OH的清除效果相當于 VC的 82.63%,均比 BHT清除效果強很多;清除超氧陰離子 (·)時,堿提栗殼棕色素的 IC50值約為 0.71 mg/mL,醇提棕色素的 IC50值約為 0.83 mg/mL,2種溶液提取的栗殼棕色素清除效果比較接近,但弱于 BHT和 VC。醇提栗殼棕色素和堿提栗殼棕色素的紅外光譜圖在吸收峰上存在一定的差異性。
[1] 李永祥,詹少華,蔡永萍,等 .板栗殼色素的提取、純化及穩定性[J].農業工程學報,2008,24(9):298-301.
[2] Wang Lijuan,Li Jian,Feng Hao.Dyeing of flax fabric with natural dye from chestnut shells[J].Pigment&Resin Technology,2009,38(6):347-352.
[3] 馮雪,姜子濤 ,李榮 .調味香料草果揮發油的抗氧化性能及清除自由基能力[J].中國調味品,2010,35(3):48-54.
[4] 黃海蘭,趙祖亮,王斌貴 .磷鉬絡合物法與β-胡蘿卜素-亞油酸法測定海藻脂類成分抗氧化活性的比較[J].中國油脂,2005,30(3):32-35.
[5] 肖凱軍,熊璞,王靜 .金櫻子棕色素的提取及其抗氧化活性研究[J].中國食品添加劑,2010(1):87-92.
[6] 張海德,黃玉林,范燕忠 .檳榔提取物對 DPPH自由基的清除作用研究[J].食品科學,2008,29(8):74-77.
[7] 段靜雨,李巖,王健慧,等 .DPPH法測定金絲梅體外抗氧化活性 [J].徐州醫學院學報,2009,29(9):618-620.
[8] Vijay Kothari,Sriram Seshadri.Antioxidant activity of seed extracts ofAnnona squam osaandCarica papaya[J].Nutrition&Food Science,2010,40(4):403-408.
[9] Umezuruike Linus Opara,Majeed R,Al-Ani.Antioxidant properties of selected non-leafy vegetables[J].Nutrition&Food Science.2009,39(2):176-180.
[10] 吳艷兵,吳大付,顏振敏,等 .柳樹乙醇提取物體外抗氧化活性[J].資源與市場開發,2010,26(2):100-101.
[11] 曾凡梅,殷紅軍 .萵苣葉多酚類物質的提取及清除超氧陰離子與羥基自由基能力評價[J].農產食品科技,2007,1(4):25-29.
[12] 郭雪峰,岳永德,湯鋒等 .用清除超氧陰離子自由基法評價竹葉提取物抗氧化能力[J].光譜學與光譜分析,2008,28(8):1 823-1 826.
[13] 周達,羅城,魯曉翔 .玫瑰花總黃酮微波輔助提取及其抗氧化研究[J].食品工業科技,2010,31(4):269-272.
[14] 李永祥,詹少華,樊洪泓,等 .板栗殼色素化學性質及結構的初步研究[J].食品科學,2008,29(12):51-54.
[15] Vázquez G,Fontenla E,Santos J,FreireM S,et al.Antioxidant activity and phenolic content of chestnut(Castanea sativa)shell and eucalyptus(Eucalyptus globulus)bark extracts[J].Industrial crops and products,2008,28:279-285.

