不同殺菌工藝對泥鰍多肽抗氧化活性的影響*
鄭淋,游麗君,趙謀明
(華南理工大學輕工與食品學院,廣東廣州,510640)
不同殺菌工藝對泥鰍多肽抗氧化活性的影響*
鄭淋,游麗君,趙謀明
(華南理工大學輕工與食品學院,廣東廣州,510640)
研究了巴氏殺菌、煮沸滅菌和高壓蒸汽滅菌 3種殺菌工藝對泥鰍多肽抗氧化活性的影響。結果表明,泥鰍多肽經 100℃/20 min煮沸滅菌和 121℃/15 min高壓蒸汽滅菌后,在 420 nm處吸光值顯著增大,且在此條件下能保持較高的氧自由基吸收能力 (ORAC值);3種殺菌工藝均使泥鰍多肽清除 DPPH自由基能力及還原力有所下降,其中高壓蒸汽滅菌對其影響最小;而巴氏殺菌及高壓蒸汽滅菌卻使泥鰍多肽螯合 Cu2+的能力有所提高。綜合這 4個指標可以得出:泥鰍多肽具有良好的耐熱性,經高壓蒸汽滅菌后能保持較強的抗氧化活性,這可能與其發生了美拉德反應有關。
泥鰍多肽,抗氧化活性,熱殺菌,美拉德反應
對于抗氧化肽來說,目前的研究主要集中于肽類物質自身的抗氧化能力,關于有效成分在加工過程中的穩定性卻很少有報道。殺菌處理是肽類物質在加工過程中的關鍵環節,恰當的殺菌工藝不僅能殺滅微生物、鈍化酶的活性,還能生成一些特殊的活性物質。例如高溫下還原性糖類與氨基化合物 (氨基酸、蛋白質、肽類)發生美拉德反應的產物 (MRPs)中的類黑精、還原酮及一些含氮、硫的雜環化合物具有較強的抗氧化活性,某些物質的抗氧化能力甚至與常用的食品抗氧化劑相當[1-3]。Sonia等人研究發現對牛奶進行 80℃、100℃及 120℃的熱處理后,抗氧化活性有所提高,且 120℃熱處理使其抗氧化活性增加的幅度最大,他們認為這不僅僅是由于抗氧化物質發生降解,還可能是因為美拉德反應初級階段生成的一些產物導致的[4]。而 Taylor等人則認為,牛奶經熱處理后抗氧化活性有所提高,是由于在高溫下牛奶中的蛋白質展開,暴露出巰基,提供了供氫體[5]。因此目前許多學者主張制備MRPs加入食品體系中或者應用熱處理工藝使體系生成具有更強抗氧化活性的MRPs,從而提高產品抗氧化穩定性[6]。但不恰當的殺菌處理則會對肽類物質的品質產生一定的負面影響,例如加熱帶來的美拉德反應和蛋白質降解可能會導致一些營養成分的損失和破壞以及活性的下降[7]。
本課題組之前研究發現,經過木瓜蛋白酶水解得到的泥鰍多肽具有很強的抗氧化活性,并研究了加工和貯藏條件對泥鰍多肽抗氧化活性的影響[8-9],但還未系統地分析不同殺菌工藝對泥鰍多肽抗氧化活性的影響。本文采用了 DPPH自由基清除能力、ORAC值、還原力及螯合 Cu2+能力 4個評價指標,考察了不同熱殺菌工藝對泥鰍多肽抗氧化活性的影響。
1 材料與方法
1.1 材料
鮮活泥鰍,購于市場,蛋白質含量為 17%;木瓜蛋白酶,活力為 6×105U/g,江門拜奧生物科技有限公司;Trolox,FL及 AAPH,Sigma-Aldrich公司;其他試劑均為分析純。
1.2 儀器與設備
PHS-3C精密 pH計,上海雷磁儀器廠;高壓滅菌鍋,山東新華醫療器械廠;MM12型絞肉機,廣東省韶關市食品機械廠;UV-754分光光度計,上海精密科學儀器有限公司;KDN-2C型定氮儀,上海纖檢儀器有限公司;GL-21M高速冷凍離心機,長沙湘儀離心機儀器有限公司;微型漩渦混合儀,滬西分析儀器廠。
1.3 實驗方法
1.3.1 泥鰍多肽的制備
鮮活泥鰍→絞成肉糜→冷凍備用→解凍→加水攪打均勻 [液料比為 2∶1(w/w)]→酶解 [加酶量為0.3%(w/w)、溫度 55 ±1 ℃、時間 4.5 h]→滅酶 (沸水浴,10 min)→冷卻→離心 (8 000 r/min、15 min)→收集上清液→泥鰍多肽
1.3.2 泥鰍多肽的熱殺菌處理
將制備得到的泥鰍多肽進行 3種不同的熱殺菌處理:63℃、30 min巴氏滅菌;100℃、20 min煮沸滅菌;121℃、0.1 MPa、20 min高壓蒸汽滅菌。
1.3.3 美拉德反應褐變程度的測定
美拉德反應往往伴隨著褐變現象,產生的一類物質稱為類黑精,隨著美拉德反應程度的增加,產物顏色也越來越深,通過在 420 nm測定不同熱處理的泥鰍多肽吸光值來反映美拉德反應的褐變程度,以探討泥鰍多肽發生美拉德反應與抗氧化活性之間的關系。
1.3.4 氧自由基吸收能力 ( ORAC)的測定
參照 B lanca等并加以改進[10-11]。FL(熒光素鈉鹽)、AAPH(自由基產生劑)、標準抗氧化物質 Trolox(VE水溶性類似物)以及待測樣品均用 7 5 mmol/L磷酸鹽緩沖液溶解和稀釋。具體操作為:在 96孔板各微孔中分別加入待測樣品 2 0μL后添加緩沖溶液 20 μL及 FL(70 nmol/L)20μL,在 37℃下預置 15 min后,用多道移液器迅速在各孔中加入 AAPH(12.8 mmol/L)140μL啟動反應,并將微孔板置于熒光分析儀中在 3 7℃下以激發波長 485 nm,發射波長 528 nm進行連續測定,每 2 min測定 1 次各孔熒光強度,測定 1 08 min,熒光強度分別記為 f0,f1,f2…f54。將記錄的各微孔不同時間點的絕對熒光強度數據 fi與初始熒光強度相比,折算成相對熒光強度,并根據公式AUC=1+,統計熒光熄滅曲線下面積(AUCsample)值,然后根據公式 n e tAUC=AUCsample-AUCblank,分別計算不同濃度 Trolox和泥鰍多肽的 net AUC值,其中 A UCblank為沒有抗氧化劑存在時自由基作用對照的 A UC值。netAUC值與 Trolox的不同濃度建立的直線回歸方程為:y=4.865 8x-8.000 7(R2=0.999 1)。根據回歸方程及經過不同熱殺菌處理后泥鰍多肽的 netAUC值,計算得出泥鰍多肽的ORAC值,ORAC值以μmol Trolox當量 ( TE)/g表達。
1.3.5 DPPH自由基清除率的測定
加入不同濃度的待測樣品 100μL和 0.2 mmol DPPH乙醇溶液 100μL于 96孔板中,振蕩 30 s,在37℃下保溫 3 0 min后,在 5 17 nm波長下測定其吸光值(As);同時測定不加 DPPH的樣品空白吸光值(Ao)和加 D PPH但不加樣品 ( 以 1 00μL乙醇代替樣品)的吸光值 A c。
1.3.6 還原力的測定方法
還原力的測定參照 A li等人的方法進行[12]。
1.3.7 螯合 C u2+能力的評價方法
參照 A nn等人的方法進行[13]。
1.4 數據統計與分析
每個實驗重復 3次,結果表示為 M eans±SD,采用 SPSS 13.0軟件進行 One-way ANOVA分析。LSD檢驗用來確定數據間的差異,顯著水平為 P<0.05。
2 結果與分析
2.1 美拉德反應褐變程度的測定
泥鰍多肽經不同熱殺菌方式處理后在 420 nm下的吸光值如圖 1所示。從圖 1看出,泥鰍多肽經 100℃/20 min煮沸滅菌和 121℃/15 min高壓蒸汽滅菌后,吸光值與對照樣品相比均有顯著性提高 (P<0.05),說明泥鰍多肽發生了美拉德反應;而經 63℃/30 min巴氏滅菌后,吸光值顯著下降 (P<0.05),顏色較透明;此外,泥鰍多肽經 121℃/15 min高壓蒸汽滅菌后,含有少量的絮狀沉淀,這可能是因為蛋白質與肽類物質在高溫下發生美拉德反應或者蛋白質及多肽部分變性生成不溶的物質。
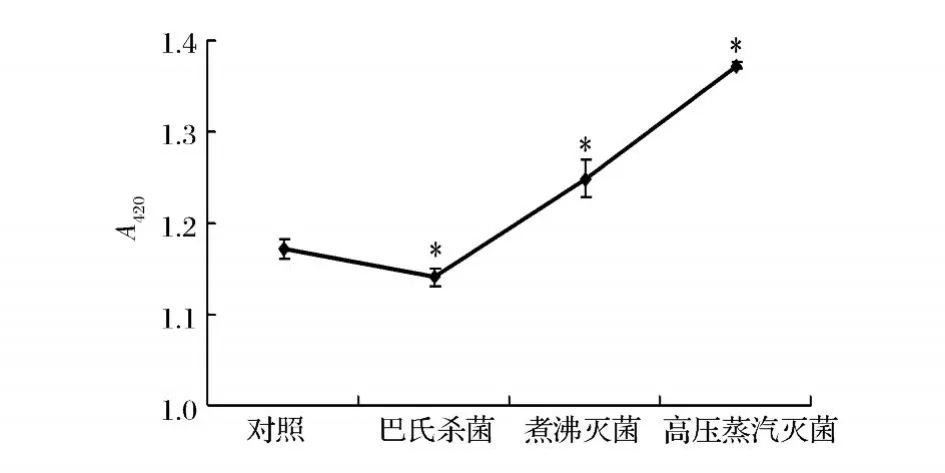
圖 1 不同殺菌工藝對泥鰍多肽在420 nm下吸光值的影響
2.2 不同殺菌工藝對泥鰍多肽抗氧化能力指數(ORAC)的影響
經過不同殺菌工藝處理后泥鰍多肽的 ORAC值如圖 2所示。從圖 2可以看出,與對照組相比,63℃/30 min巴氏殺菌使泥鰍多肽的 ORAC值顯著下降 (P<0.05);而 100℃/20 min煮沸滅菌使泥鰍多肽的ORAC值有顯著性提高 (P<0.05);121℃/15 min高壓蒸汽滅菌對泥鰍多肽的 ORAC值無顯著性影響 (P>0.05)。由此可知泥鰍多肽經過 100℃/20 min煮沸滅菌及 121℃/15 min高壓蒸汽滅菌均能保持較高的 ORAC值,且在 121℃/15 min高壓蒸汽滅菌后最穩定。
2.3 不同殺菌工藝對泥鰍多肽清除 DPPH自由基活性的影響
泥鰍多肽經不同熱殺菌方式處理后對 DPPH自由基的清除結果如圖 3所示。從圖 3可以看出,與未殺菌的泥鰍多肽相比,經 3種殺菌方式處理后泥鰍多肽清除 DPPH自由基的 I C50值均有所升高,說明清除DPPH自由基能力均有所下降,以 63℃/30 min巴氏殺菌和 100℃/20 min煮沸滅菌變化最多,對照組的IC50值為 1.11 mg/mL,而這兩組的 I C50值分別增加至1.65 mg/mL和 1.66 mg/mL,這可能是熱處理破壞了泥鰍多肽的結構,發生了變性,導致活性下降;而 121℃/15 min高壓蒸汽滅菌對泥鰍多肽清除 DPPH自由基影響較小,可能是泥鰍多肽自身雖發生變性,活性下降,但在 121℃高溫條件下發生美拉德反應生成了具有一定抗氧化活性的物質,因而活性相對于另外兩種殺菌方式有所提高。Sumaya-Martinez等人研究也發現美拉德反應產物對 DPPH自由基的清除能力隨著反應溫度的升高而增強[14]。

圖 2 不同殺菌工藝對泥鰍多肽 ORAC的影響
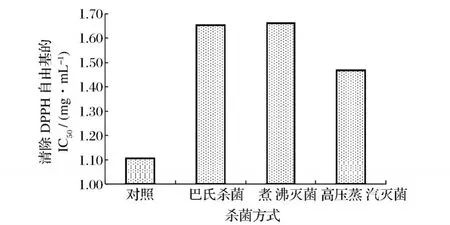
圖 3 不同殺菌工藝對泥鰍多肽清除DPPH自由基的影響
2.4 不同殺菌工藝對泥鰍多肽還原力的影響
不同殺菌工藝對泥鰍多肽還原力的影響結果如圖 4所示,從圖 4可以看出,泥鰍多肽在 2~10 mg/mL,其濃度與其還原力之間有良好的線性關系,其回歸方程及相關系數如表 1所示。結合表 1及圖 4可以發現,泥鰍多肽經熱殺菌處理后,還原力均有所下降,且與 DPPH自由基清除率的測定結果一致,63℃/30 min巴氏殺菌和 100℃/20 min煮沸滅菌對其影響較大,而 121℃/15 min高壓蒸汽滅菌對其影響較小。這可能由于還原力大的樣品,是良好的電子及氫供應者,可以與自由基反應,使自由基成為較穩定的物質,從而中斷自由基的連鎖反應,這就為清除自由基發揮抗氧化作用提供了可能。

表1 泥鰍多肽濃度與還原力之間的線性關系
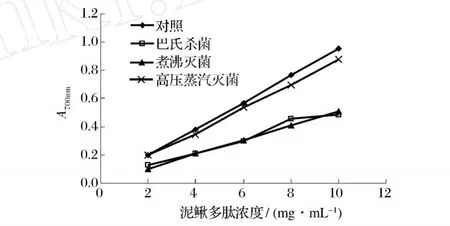
圖 4 不同殺菌工藝對泥鰍多肽還原力的影響
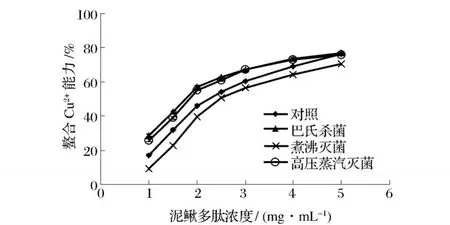
圖 5 不同殺菌工藝對泥鰍多肽螯合 Cu2+能力的影響
2.5 不同殺菌工藝對泥鰍多肽螯合 Cu2+能力的影響
不同殺菌工藝對泥鰍多肽螯合 Cu2+能力的影響如圖 5所示。從圖 5可以看出,泥鰍多肽對 Cu2+具有一定的螯合能力,在 1.0~5.0 mg/mL,隨著泥鰍多肽濃度的增大,經過熱殺菌處理后的泥鰍多肽螯合Cu2+能力均呈先迅速增加后趨于平緩的趨勢;與對照組相比,泥鰍多肽經過 63℃/30 min巴氏殺菌和121℃/15 min高壓蒸汽滅菌后,螯合 Cu2+能力有所增加;而經 100℃/20 min煮沸滅菌后,螯合 Cu2+能力略有下降。這與清除 DPPH自由基及還原力的測定結果不一致,主要是由于多肽的抗氧化機制不一樣。抗氧化肽能夠螯合 Cu2+主要是因為肽鏈上的某些殘基上含有能螯合金屬離子的基團,而發揮清除自由基功效以及具有還原能力是由于肽鏈上具有供氫體或未配對的電子。但從這個指標也可以看出,高壓蒸汽滅菌有利于泥鰍多肽螯合 Cu2+。
3 結論
泥鰍多肽經 100℃/20 min煮沸滅菌和 121℃/15 min高壓蒸汽滅菌后,在 420 nm處吸光值顯著增大,說明發生美拉德褐變程度較大,且這兩種殺菌方式能使泥鰍多肽保持較高的 ORAC值,其中 100℃/20 min煮沸滅菌甚至較對照組有顯著性的提高 (P<0.05);3種殺菌方式均使泥鰍多肽的 DPPH自由基清除能力及還原力有所下降,以 121℃/15 min高壓蒸汽滅菌對其影響最小;而 63℃/30 min巴氏殺菌和121℃/15 min高壓蒸汽滅菌卻使泥鰍多肽螯合 Cu2+能力有所提高,100℃/20 min煮沸滅菌使其下降。綜合這 4個抗氧化指標可以得出:121℃/15 min高壓蒸汽滅菌對泥鰍多肽活性的影響最小,可能與其自身發生的美拉德反應有關,因此在今后的加工中可選用這種殺菌方式。
[1] Osada Y,Shibamoto T.Antioxidative activity of volatile extracts from Maillard model systems[J].Food Chemistry,2006,98(3):522-528.
[2] Wagner K-H,Derkits S,HerrM,et al.Antioxidative potential of melanoidins isolated from a roasted glucose-glycine model[J].Food Chemistry,2002,78(3):375-382.
[3] 項惠丹,許時嬰,王璋 .蛋白質與還原糖美拉德反應產物的抗氧化活性[J].食品科學,2008,29(7):52-57.
[4] Sonia Calligaris,Lara Manzocco,Monica Anese,et al.Effect of heat-treatment on the antioxidant and pro-oxidant activity ofmilk[J].InternationalDairy Journal,2004,14(5):421-427.
[5] Taylor M J,Richardson T.Antioxidant activity of skim milk:Effect of heat and resultant sulfhydryl groups[J].Journal ofDairy Science,1980,63(11):1 783-1 795.
[6] Francisco J Morales.Assessing the non-specific hydroxyl radical scavenging properties of melanoidins in a Fentontype reaction system[J].Analytica Chimica Acta,2005,534(1):171-176.
[7] Wang K,Maga J A,Bechtel P J Bechtel.StabilityofBeefyMeaty Peptide to Pasteurization and Sterilization Temperatures[J].Lebensmittel-W issenschaft und-Technologie,1995,28(5):539-542.
[8] You Lijun,Zhao Mouming,Joe M.Regenstein.et al.In vitroantioxidant activity andin vivoanti-fatigue effect of loach(M isgurnus anguillicaudatus)peptides prepared by papain digestion[J].Food Chemistry,2011,124(1):188-194.
[9] 游麗君,趙謀明,Regenstein Joe等 .加工和貯藏條件對泥鰍多肽抗氧化活性的影響 [J].江蘇大學學報,2009,30(6):549-553.
[10] Blanca Hernndez-Ledes ma,Lourdes Amigo,Isidra Recio,et al.ACE-Inhibitory and radical-scavenging activity of peptides derived fromβ-Lactoglobulin f(19-25)Interactionswith ascorbic acid[J].Journal of Agricultural and Food Chemistry,2007,55(9):3 392-3 397.
[11] HuangWu-Yang,KaustavMajumder,Wu Jian-ping.Oxygen radical absorbance capacity of peptides from egg white protein ovotransferrin and their interaction with phytochemicals[J].Food Chemistry,2010,123(3):635-641.
[12] AliBougatef,Mohamed Hajji,Rafik Balti,et al.Antioxidant and free radical-scavenging activities of s mooth hound(M ustelus m ustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J].Food Chemistry,2009,114(4):1 198-1 205.
[13] Ann E Theodore,Sivakumar Raghavan,Hordur G.Kristinsson.Antioxidative activity of protein hydrolysatesprepared from alkaline-aided channel catfish protein Isolates[J].Journal ofAgricultural and Food Chemistry,2008,56(16):7459-7466.
[14] M T Sumaya-Martinez,S Thomas,B Linard,et al.Effect ofmaillard reaction conditions on browning and antiradical activity of sugar-tuna stomach hydrolysate model system[J].Food Research International,2005,38(8):1 045-1 050.
Effect of Sterilization on the Antioxidant Activity of Loach Peptide
Zheng Lin,You Li-jun,Zhao Mou-ming
(College ofLight Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China)
The effect of pasteurization,boiling sterilization and high-pressure steam sterilization on the antioxidant activity of loach peptide were investigated.The results showed that the absorbance of loach peptide at 420 nm increased significantly,which was treated by boiling sterilization or high-pressure steam sterilization.Under this condition,the loach peptide couldmaintain a highORAC value.Both theDPPH free radical scavenging activity and the reducing power of loach peptide decreased after thermal sterilization treatment,while high-pressure steam sterilization had the least influence on it.Pasteurization and high-pressure steam sterilization could enhance the Cu(Ⅱ)ion chelating activity of loach peptide.Based on the above results,we can conclude that loach peptide had good heat resistance and it could maintain stronger antioxidant activity by high-pressure steam sterilization,which may be related to theMaillard reaction.
loach peptide,antioxidant activity,thermal sterilization,Maillard reaction
碩士研究生 (游麗君教授為通訊作者)。
*國家“十一五”科技支撐計劃項目(2006BAD27B03,2006BAD27B04)
2010-10-08,改回日期:2010-12-01

