2型豬鏈球菌層粘連蛋白結合蛋白的原核表達及免疫原性檢測*
潘秀珍,邵珠卿,李先富,劉文靜,王長軍,唐家祺
2型豬鏈球菌層粘連蛋白結合蛋白的原核表達及免疫原性檢測*
潘秀珍1,2,邵珠卿1,2,李先富1,劉文靜1,2,王長軍1,唐家祺1
目的 表達2型豬鏈球菌(Streptococcus suis 2,S.suis 2)層粘連蛋白結合蛋白(Lmb)并檢測其免疫原性。方法PCR檢測lmb基因在不同血清型S.suis中的分布。將 S.suis 2中國強毒株05ZYH33的 lmb基因克隆至表達載體p ET32a,轉化大腸桿菌 E.coli BL21,IPTG誘導表達,His親和層析柱純化重組蛋白。Western blot檢測Lmb的免疫原性。結果lmb基因存在于大多數S.suis血清型中。誘導表達并純化后獲得較高純度的重組蛋白。重組Lmb能夠和感染05ZYH33全菌的豬恢復期血清反應。結論lmb基因在S.suis不同血清型中廣泛分布,Lmb在細菌感染宿主過程中表達,可以作為疫苗開發的候選分子。
2型豬鏈球菌;層粘連蛋白結合蛋白;疫苗候選分子
豬鏈球菌(Streptococcus suis,S.suis)是一種 重要的人獸共患病病原菌,可感染豬或人并導致多種嚴重疾病[1]。根據其莢膜多糖抗原的不同,可將S.suis分為35個血清型[2]。其中,S.suis 1/2型、1型、2型、7型、9型及 14型都可致豬病,但以 S.suis 2分布最廣,致病力最強[3]。1998年在江蘇和2005年在四川相繼暴發的 S.suis疫情,導致了嚴重的公共衛生事件[1,4],引起了世界范圍內對 S.suis感染的關注。本課題組對 S.suis 2型兩個強致病菌株全基因組測序的完成[5],使得在基因組水平篩選致病性相關的表面和分泌蛋白作為亞單位疫苗候選分子成為可能。
微生物表面的脂蛋白具有良好的免疫原性,能夠同時刺激宿主的體液免疫和細胞免疫,引發宿主強烈的免疫防御機制[6]。鏈球菌層粘連蛋白結合蛋白(laminin binding protein,Lm b)是一種鋅離子吸收相關表面受體,屬于脂蛋白受體Ⅰ家族。Lmb與細菌的粘附相關,并在細菌的離子平衡和毒力中發揮功能[7-8],已有的研究證實,多種鏈球菌Lmb具有較好的免疫原性,能夠在小鼠模型中發揮顯著性的免疫保護性[9-10]。我們通過對S.suis 2型中國強毒株05ZYH 33的全基因組分析,發現了 lmb基因。序列分析發現該基因編碼的蛋白具有脂蛋白受體Ⅰ家族的所有特征:①蛋白的氨基酸殘基總數在300-330之間;②具有17-23個前導序列;③在前導序列的C末端具有一個(L/I/V)-(S/A)-(A/G)-C保守序列,作為信號肽酶Ⅱ的識別位點;④具有β1-α-β2組成的三級結構模型;⑤N末端有可以被脂類修飾的序列。本研究表達并純化了S.suis 2編碼的Lmb蛋白、鑒定了其免疫原性,并檢測了該基因在不同鏈球菌中的分布,為進一步研究其作為疫苗候選分子的可能性奠定了基礎。
1 材料和方法
1.1 材料和試劑
1.1.1 菌株 S.suis共35株。其中 S.suis 2 05ZYH 33來自中國;S.suis血清型標準參考株34株,由加拿大M arecelo Gottschalk教授惠贈。
1.1.2 試劑 引物由南京賽百勝生物公司合成。感染05ZYH33全菌的豬恢復期血清為本實驗室保存,HRP標記兔抗豬IgG為Sigma公司產品,Ex Taq polymerase、dN TP、T4 DNA 連接酶、限制性內切酶 Eco RⅤ、XhoⅠ均購自大連寶生物工程公司,DNA Marker和蛋白M arker購自Fermentas公司,PCR回收試劑盒購自Promega公司,IPTG、PVDF膜購自南京生興生物公司。其它所有試劑均為分析純試劑。
1.2 方法
1.2.1 S.suis中lmb基因的生物信息學分析 用Blast軟件從完成全基因組測序的S.suis 2全基因組序列中篩選Lmb編碼基因,并與 GenBank中的鏈球菌Lmb序列進行同源性分析。利用ClustalW軟件將不同細菌編碼的Lm b氨基酸序列進行序列比對。
1.2.2 PCR檢測 lmb在S.suis不同血清型的分布 根據序列比對結果,在 lmb的保守區設計引物,分別以多種 S.suis血清型菌株的基因組為模板,PCR擴增 lmb目的基因。1%瓊脂糖凝膠電泳檢測是否有lmb目的片段。
1.2.3 PCR擴增 S.suis 2 05ZYH33的 lmb基因
根據篩選所得序列設計合成引物,進行PCR擴增Lmb截去跨膜信號肽編碼區的基因片段。上游引物 為 5’- GA TA TCGAAGCGAGTCAAGTACAGCCAG-3’,劃線部分為 Eco RⅤ酶切位點;下游引 物 為 5’-CTCGAGCGGTCGA TAGAA TTCGGCCTTTTA-3’,劃線部分為 XhoⅠ酶切位點。PCR程序為95℃5 min;95℃30 s;58℃30 s;72℃1 min,共25個循環,最后72℃延伸10 m in。
1.2.4 目的片段的克隆測序 PCR產物經1%瓊脂糖凝膠電泳,用膠回收試劑盒回收目的片段。將此目的片段與p EASY-T1連接,轉化至DH5α感受態細菌,菌液經PCR檢測為陽性者用試劑盒提取質粒,酶切,電泳鑒定。
1.2.5 重組表達載體p ET32a::lmb的構建和鑒定質粒p EASY-T1::lmb和p ET32a載體分別用EcoR V/Xhol I雙酶切,并用膠回收試劑盒回收。T4 DNA連接酶連接后轉化DH5α感受態,菌液經PCR檢測為陽性者用試劑盒提取質粒,酶切,電泳鑒定。結果為陽性者送往上海英俊生物技術有限公司進行測序,對測定結果進行分析。
1.2.6 Lmb的表達及其產物的純化 將重組表達載體轉化 E.coli BL 21(DE3),加入1mmol/L IPTG(異丙基-β-D-半乳糖苷)誘導表達,收集菌體超聲破碎。離心后取上清進行SDS-PA GE電泳,明確是否有目的蛋白的表達。將重組菌擴大培養并經IPTG誘導表達,超聲裂解,離心后的上清用Ni2+親和層析柱純化融合蛋白,12%SDS-PAGE電泳鑒定目的蛋白的分子量。
1.2.7 Lmb的免疫原性分析 將提取的蛋白樣品經12%SDS-PAGE電泳后,采用電轉印法將蛋白轉移至硝酸纖維素膜上,5%脫脂奶37℃封閉1h,加感染S.suis 2 05ZYH33的豬恢復期血清(1∶100稀釋),4℃孵育過夜,二抗為 HRP標記的兔抗豬IgG(1∶1 000稀釋),37℃孵育1h,DAB顯色。
2 結 果
2.1 lmb基因具有高度的保守性 通過與 Gen-
Bank中已知的蛋白序列進行同源性分析發現,S.suis 2四川分離株05ZYH33全基因組中的開放閱讀框CDS SSU 0330編碼 lmb基因。序列比對發現05ZYH33與 GenBank上的肺炎鏈球菌(Strep tococcus pneum oniae)、無乳鏈球菌 (Streptococcus agalactiae)、化膿鏈球菌(Strep tococcus pyogenes)、停乳鏈球菌(Streptococcus dysgalactiae)氨基酸序列相似性分別為 75%、70%、69%、67%。同時,該蛋白在S.suis 2不同分離株表現出極為保守的特征,中國強毒株05ZYH33編碼的Lmb與中國強毒株98HA H33、歐洲分離株 P1/7、北美分離株 89/1591的Lmb的氨基酸序列相似性均達到97%。
2.2 lmb基因在S.suis不同血清型中廣泛分布根據序列比對結果,在 lmb基因的保守區設計一對引物,對不同的 S.suis菌株進行 PCR擴增,發現在所有檢測的 S.suis血清型中的30個血清型中有lmb存在。

表1 PCR檢測lmb基因在各菌株中的分布Table 1 The distribution of lmb in different S.suis serotypes
2.3 目的基因的克隆 以提取的05ZYH33的基因組DNA為模板,對目的基因(lmb)進行 PCR擴增,產物進行瓊脂糖凝膠電泳檢測(圖1)。結果顯示,PCR擴增產物分子量約為900bp,大小與lmb基因的大小(867bp)相符。
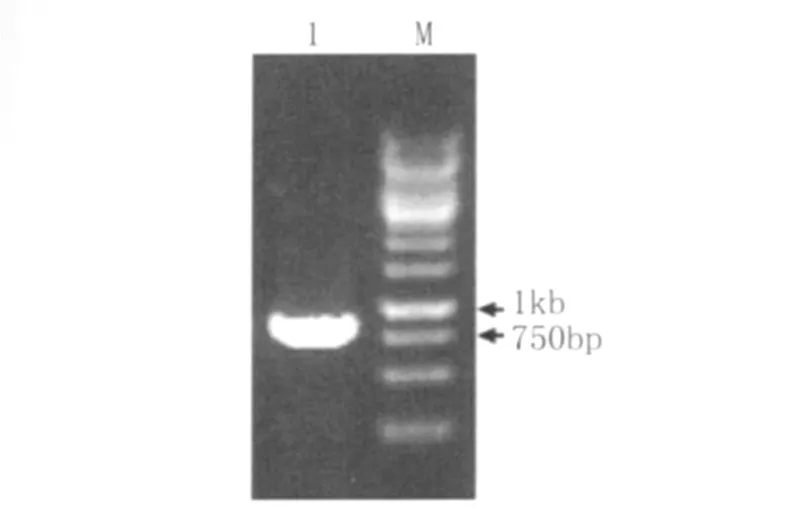
圖1 PCR擴增結果Fig.1 Agarose gel electrophoresis of PCR 1:The products of PCR;2:1kb DNA marker
2.4 重組表達載體p ET32a::lmb的鑒定 將構建好的重組表達載體p ET32a::lmb用Eco R V+Xho l I雙酶切后,進行1%瓊脂糖電泳,結果顯示 lmb片段的長度約900bp,序列測定顯示該片段全長867 bp,編碼289個氨基酸(圖2)。
2.5 重組蛋白的表達及純化 構建好的重組表達質粒 p ET32a::lmb轉化大腸桿菌 BL21后,經IPTG誘導,SDS-PAGE分析表明在約50kD處有一明顯的新生蛋白條帶(圖3),分子量大小與預期一致。利用 His-Resin對表達產物進行了純化,純化后的表達產物只有一條特異的條帶,獲得了較純的Lmb重組蛋白(圖3)。2.6 Lmb的免疫原性 Western blot的結果顯示,Lmb可以與感染05ZYH33的豬恢復期血清反應,在特定位置處有明顯的條帶(圖4)。
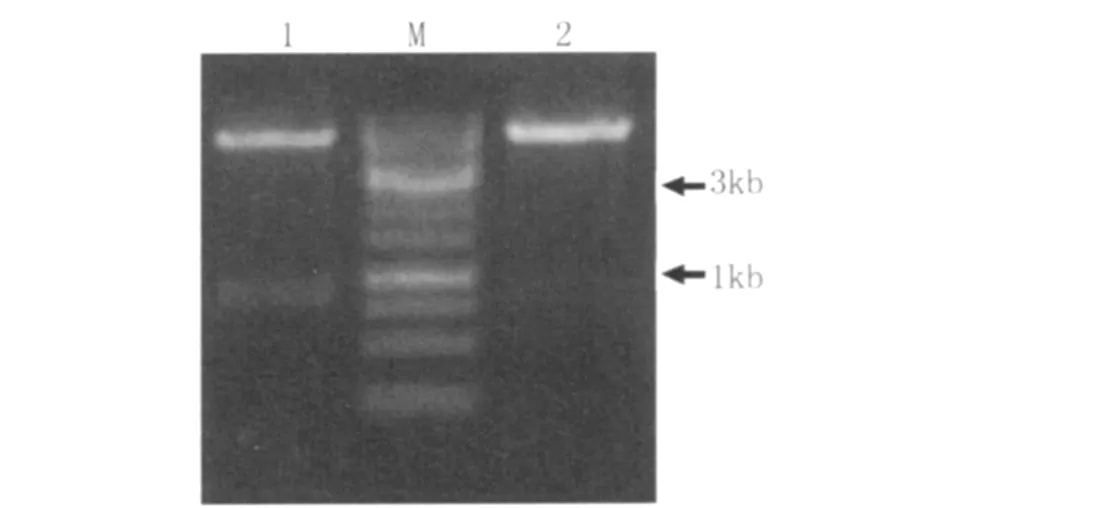
圖2 重組質粒pET32a::lmb的酶切鑒定1:Eco RⅤ和 XhoⅠ雙酶切 p ET32a::lmb;M.1kb DNA分子量標準;2:Eco RⅤ單酶切p ET32a::lmbFig.2 Identif ication of the recombinant plasm id pET32a::lmb by double restriction enzymes digestion.1:p ET32a::lmb/Eco RⅤ+XhoⅠ;M:1kb DNA marker;2:p ET32a::lmb/Eco RⅤ
3 討 論


脂蛋白受體抗原Ⅰ(lipoprotein recep to r antigenⅠ,L raⅠ)家族是一類鏈球菌表面蛋白,其家族成員在血液鏈球菌(Streptococcus sanguis)粘附到唾液腺表皮、副血鏈球菌(Streptococcus parasanguis)同血小板基質的結合以及肺炎鏈球菌(Streptococcus pneumoniae)粘附到肺Ⅱ型上皮細胞過程中發揮重要作用[11-13]。Lm b是一種分子量在35kd左右的L raⅠ家族成員,在多種鏈球菌中廣泛存在。Lmb不僅在鏈球菌中發揮鋅離子吸收的功能,提高細菌在宿主中鋅離子限制條件下的生存能力[14];還可以與宿主細胞的層粘連蛋白結合,參與細菌的黏附過程[7];還能促進細菌穿透人血腦屏障,與細菌的毒力相關[15]。
近年來,大規模爆發人感染S.suis 2的嚴重公共衛生事件,并出現“中毒性休克綜合征”等嚴重的臨床癥狀,顯示對S.suis 2感染的預防和控制亟待加強。因此對S.suis 2疫苗的研究顯得十分重要。在S.suis 2致病機制尚不明確的條件下,表面蛋白、分泌蛋白和毒力相關因子成為有潛力的亞單位疫苗的候選分子[16]。Lmb作為一個在鏈球菌中廣泛存在的表面蛋白,與細菌的黏附和毒力相關。已有研究發現其對多種鏈球菌編碼的Lmb具有較好的免疫保護性,能夠在小鼠模型中發揮較強的保護作用[8,9],但是關于 S.suis的Lm b的研究尚未見諸報道。本研究通過原核表達系統p ET32a::BL21獲得了含有標簽為20kD左右的融合蛋白,Western blot表明該重組蛋白具有較好的免疫原性。本研究結果顯示Lmb在不同地域分離的菌株中具有高度的保守性。除此之外,lmb基因在S.suis的35個血清型中的30個血清型中廣泛分布。Lm b較好的免疫原性、高度的保守性和基因分布的廣泛性顯示該蛋白是一個理想的疫苗候選分子。
[1]Tang J Q,Wang C J,Feng Y J,et al.Strep tococcal toxic shock syndrome caused by Streptococcus suis serotype 2[J].PLoS Medicine,2006;3(5):e151.
[2]Staats JJ,Feder I,Okw umabua O,et al.Streptococcus suis:past and p resent[J].Vet Res Commun,1997;21:381-407.
[3]Hill JE,Gottschalk M,Brousseau R,et al.Biochemical analysis,cpn60 and 16S rDNA sequence data indicate that Streptococcus suis serotypes 32 and 34,isolated from pigs,are Streptococcus orisratti[J].Vet Microbiol,2005,107(1-2):63-69.
[4]Yu H,Jing H,Chen Z,et al.Human Strep tococcus suis outbreak,Sichuan,China[J].Emerg Infect Dis,2006,12(6):914-920.
[5]Chen C,Tang J,Dong W,et al.A Glimpse of Streptococcal Toxic Shock Syndrome from Comparative Genomics of S.suis 2 Chinese Isolates[J].PLoSONE,2007,2(3):e3 l 5.
[6]Brightbill HD,Libraty DH,Krutzik SR,et al.Host defense mechanisms triggered by microbial lipoproteins through toll-like recep tors[J].Science,1999,285(5428):732-736.
[7]Elsner A,Kreikemeyer B,Braun-Kiewnick A,et al.Involvement of Lsp,a member of the L ra I-lipoprotein family in Streptococcus pyogenes,in eukaryotic cell adhesion and internalization[J].Infect Immun,2002,70(9):4859-4869.
[8]Loisel E,Jacquamet L,Serre L,et al.AdcA II,a new pneumococcal Zn-binding protein homologouswith ABC transporters:biochemical and structural analysis[J].JMol Biol,2008,381(3):594-606.
[9]A randa J,Garrido ME,Cortés P,et al.Analysisof the p rotective capacity of three Streptococcus suis proteins induced under divalent-cation-limited conditions[J].Infect Immun,2008,76(4):1590-1598.
[10]A randa J,Garrido M E,Fittipaldi N,et al.Protective capacities of cell surface associated proteins of Streptococcus suis mutants defictent in divalent cation up take regulato rs[J].Microbiology,2009,155(5):1580-1587.
[11]Jenkinson HF.Cell surface protein receptors in oral streptococci[J].FEMSMicrobiol Lett,1994,121(2):133-140.
[12]Viscount HB,M unro CL,Burnette-Curley D,et al.Immunization with Fim A p rotects against Streptococcus parasanguis endocarditis in rats[J].Infect Immun,1997,65(3):994-1002.
[13]Berry AM,Paton JC.Sequence heterogeneity of PsaA,a 37-kilodalton putative adhesin essential for virulence of Streptococcus pneumoniae[J].Infect Immun,1996,64(12):5255-5262.
[14]Weston BF,Brenot A,Caparon M G.The metal homeostasis protein,Lsp,of Streptococcus pyogenes is necessary for acquisition of zinc and virulence[J].Infect Immun,2009,77(7):2840-2848.
[15]Tenenbaum T,Spellerberg B,Adam R,et al.Streptococcus agalactiae invasion of human brain microvascular endothelial cells is promoted by the laminin-binding protein Lmb[J].M icrobes Infect,2007,9(6):714-720.
[16]Baum s CG,Valentin-Weigand P.Surface-associated and secreted facto rs of Strep tococcus suis in epidemiology,pathogenesis and vaccine development[J].Anim Health Res Rev,2009,10(1):65-83.
Expression and immunogen icity identification on lam in in binding protein of Strep tococcus suis 2
PAN Xiu-zhen,SHAO Zhu-qing,L IXian-fu,L IU Wen-jing,WANG Chang-jun,TANG Jia-qi
(Research Institute for M edicine of N anjing Comm and,Nanjing 210002,China)
To detect the distribution of lmb gene in different serotypesof Streptococcussuis(S.suis),bioinformatics analysisof the w hole genome of Streptococcussuis 2(S.suis 2)was carried out to find the lmb gene.The results indicated that the ORF SSU 05-0330 encoded the lm b gene of S.suis 2 virulent strain 05ZYH33.PCR with a pair of primers specific to lmb showed that lmb gene could be found in 30 S.suis sero types.The lmb encoding ORF from the genomic DNA in the virulent strain 05ZYH33 wasamp lified by PCR using a pair of specific primersand subcloned into p ET32a expression vecto rwith double digestion of Eco RⅤand Xho I.Subsequently,the recombinant plasmid was transformed to E.coli BL21(DE3)after the identification of restriction endonuclease digestion and DNA sequencing.After induction with IPTG,E.coli cells expressing HtpS were harvested by centrifugation and lysed by sonication.Follow ing sonication,bacterial lysate was subjected to centrifugation for the removal of the insoluble pellets.The supernatant was filtered with a 0.22μm po re-size filter and purified using a Ni-NTA column.SDS-PAGE demonstrated that E.coli BL21 containing the recombinant plasmid could express a distinct band with a molecularweightof 50 kDa,which was similar to the p redicted band of recombinant Lmb protein.Western blotwas carried out to detect the immunogenicity of Lmb,and sera of convalescent-phase swine collected from SPF-pigs survived from infection by S.suis2 05ZYH33 were used as the first antibody.The result showed that recombinant Lmb could reactwith convalescent-phase sera from pigs infected by S.suis 2,indicating that H tpSwas expressed and exposed in vivo and could be recognized by the immune system and elicit a host response during natural infection of S.suis 2.Taken together,Lmb is an in vivo expressed immunogenic protein,and potential to be a vaccine candidate of S.suis 2.
Strep tococcus suis;laminin binding protein;vaccine candidate
2.南京師范大學生命科學學院,南京 210046
R378.1
A
1002-2694(2011)07-0583-04
*國家自然科學基金(30730081,81071317,30972638);江蘇省自然科學基金資助項目(BK2010113,BK2010114,BK2010025,BK2009042)
潘秀珍,Email:panxiuzhen-2004@163.com
1.南京軍區軍事醫學研究所,南京 210002;
2010-07-30;
2011-02-16

