幽門螺桿菌相關性胃炎患者趨化因子IP-10、Mig的表達*
胡友瑩,趙金紅,汪雪峰,李朝品,王克霞,王 健
幽門螺桿菌(Helicobacter pylori,Hp)相關性胃炎在病理組織學上是以大量中性粒細胞、單核細胞、淋巴細胞等炎癥細胞浸潤為特征[1]。趨化因子(chemokine)是反應炎癥活動的敏感指標,能夠與其受體共同作用趨化、激活中性粒細胞、單核細胞、NK細胞、淋巴細胞等在炎癥部位聚集、活化,參與組織損傷和修復。國內外已有關于Hp相關性胃炎中CXC趨化因子白細胞介素-8(interlukine8,IL-8)、生長相關癌性基因(Growth-regulated onco-gene-α,GRO-α)、CC趨化因子單核細胞趨化蛋白(monocyte chemoattractant protein,MCP-1)、正常T細胞表達和分泌,活化時表達下降的因子(reduced upon activation,normal T expressed and secreted,RANTES)、巨噬細胞炎癥蛋白(macrophage inflammatory protein,MIP)等相關研究報道[2],而關于 Hp相關性胃炎中CXC趨化因子γ干擾素誘生蛋白10(interferon γ-inducible protein 10,IP-10)、γ干擾素誘生的單核因子(monokine inducible by γinterferon,Mig)的表達情況尚未見詳細報道。因此,本文研究28例胃炎患者胃黏膜組織中趨化因子IP-10、Mig的表達水平,以進一步了解Hp導致胃炎的可能機制,現將結果報告如下。
1 材料和方法
1.1 研究對象 28例胃炎病人為2009年1月至2010年6月安徽理工大學附屬東方集團總醫院收治的患者,男10例,女18例,年齡18~60歲,其中Hp陽性胃炎患者16例,Hp陰性胃炎患者12例。另選正常胃粘膜6例為對照組。取5年內無抽煙、飲酒史者,近2個月未服用非甾體抗炎藥、抗生素、質子泵抑制劑、胃粘膜保護劑者。
1.2 標本采集 研究對象進行電子胃鏡檢查,用規格相同的活檢鉗在距幽門口5cm內不同位置(胃大彎、胃小彎、前后壁)鉗取胃粘膜標本,分別用于Hp檢查、趨化因子檢測及病理學檢查。
1.3 H p感染判斷及炎癥活動分級標準 Hp感染由快速尿素酶法及石炭酸染色確定,兩者均陽性為H p感染陽性,兩者均陰性為陰性,兩種結果不一致者排除在本研究以外。再結合HE染色結果,將患者分為正常胃黏膜組、Hp陰性胃炎組、Hp陽性胃炎組。
活動性炎癥的診斷標準為粘膜間質、上皮內及腺腔中可見中性粒細胞(不包括血管內者)浸潤,炎癥活動程度分級標準:一個高倍鏡視野無中性粒細胞為正常,一個高倍鏡視野中性粒細胞<20個為輕度,一個高倍鏡視野中性粒細胞20~50個為中度,一個高倍鏡視野中性粒細胞>50個為重度[3]。
1.4 胃炎患者胃黏膜組織IP-10、Mig的檢測 胃粘膜組織鉗取后,迅速放入裝有1.0mL含胎牛血清的RPMI 1640培養基的24孔培養板中,于37℃、5%CO2、飽和濕度的培養箱中孵育24h后,4℃研磨勻漿,將勻漿液轉移至Eppendorf管中,15 000r/min,4℃離心30min,取上清液-70℃冰箱保存,分別用ELISA方法測定 IP-10、Mig的表達(IP-10、Mig ELISA檢測試劑盒購自美國Sigma公司)。
2 結 果
2.1 胃炎患者胃粘膜內IP-10、Mig的表達 胃炎患者胃粘膜組織中IP-10、Mig的含量升高,與正常對照組相比,差異均具顯著性(分別P<0.05、P<0.01),且Hp陽性胃炎組中,IP-10、Mig的表達均顯著高于 Hp陰性胃炎組,差異均具顯著性(P<0.01),具體結果見表1。
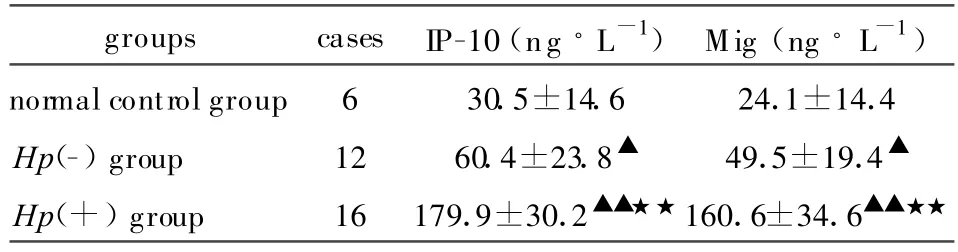
表1 胃炎患者胃粘膜組織IP-10、Mig的表達Tab.1 Expression of IP-10 and Mig in the gastric mucosa in patients with gastritis
2.2 Hp陽性組中IP-10、Mig的表達與粘膜炎癥活動程度的關系 在 Hp陽性胃炎組中,根據其粘膜炎癥活動程度劃分結果為正常組2例、輕度組4例、中度組 4例和重度組 6例。胃粘膜內IP-10、Mig在正常組、輕度組、中度組和重度組的表達水平分別為(32.0±13.8)、(160.9±30.5)、(220.1±58.2)、(307.9±60.5)ng·L-1和(27.3±18.4)、(138.2±28.8)、(201.8±42.5)、(274.9±58.4)ng·L-1,且其表達水平與炎癥活動程度均呈顯著正相關(r=0.9811,P<0.001和 r=0.9938,P<0.001)(圖1,2)。
3 討 論
趨化因子是能使細胞發生趨化作用的細胞因子總稱[4],分為CXC、CC、C、CX3C 四個亞家族(C 代表半胱氨酸,X代表任意氨基酸),以CXC和CC亞家族最為重要。不同趨化因子亞家族趨化不同的淋巴細胞,CC趨化因子主要趨化單核細胞、嗜酸性粒細胞、嗜堿性粒細胞和T細胞。CXC趨化因子按其分子N-端前是否存在谷氨酸-亮氨酸-精氨酸(Glu-Leu-Arg)即ELR結構,進一步分為ELR+CXC和ELR-CXC兩亞族,ELR+CXC主要趨化中性粒細胞,而ELR-CXC趨化因子尤其是 IP-10、Mig均可由IFN-γ誘導單核/巨噬細胞、肝細胞、成纖維細胞、角質形成細胞和內皮細胞等分泌,通過其共同受體CXCR3對表達該受體的活化T細胞、NK細胞、中性粒細胞等趨化和激活,發揮抗感染、抑病毒等多種生物學功能[5-6]。
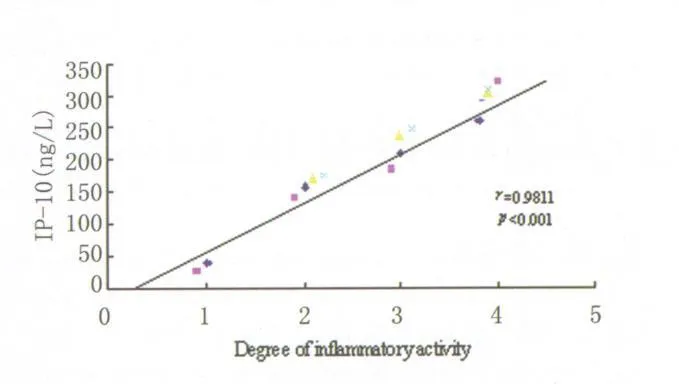
圖1 Hp陽性胃炎組中IP-10與胃粘膜炎癥活動程度的相關性(r=0.9811,P<0.001)Fig.1 Correlation between the level of IP-10 and the degree of gastric mucosa inflammation in patients with gastritis induced by Helicobacter pylori(extreme correlation r=0.9811,P<0.001)
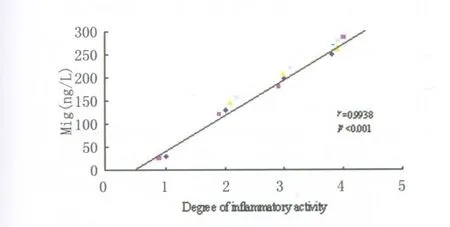
圖2 Hp陽性胃炎組中Mig與胃粘膜炎癥活動程度的相關性(r=0.9938,P<0.001)Fig.2 Correlation between the level of Mig and the degree of gastric mucosa inflammation in patients with gastritis induced by Helicobacter pylori(extreme correlation r=0.9938,P<0.001)
Hp感染與胃炎關系密切,在胃炎中T細胞、DC細胞等炎性細胞的選擇性聚集是由選擇蛋白、免疫球蛋白、趨化因子等誘導的。趨化因子又是反應炎癥活動的敏感指標。林敏娟等[7]證實IL-8在Hp相關性胃炎患者中顯著增高,且其IL-8的升高程度與胃粘膜炎癥活動程度呈正相關。田黎黎等[8]也證實,CCL28和IL-10在Hp胃炎患者中顯著增高。溫國明等[9]證明趨化因子受體 CXCR4和CCR7在胃癌組織中高表達,其表達水平與胃癌的病理分化程度、臨床分期等相關。張影等[10]研究證實RANTES是一種T細胞特異的趨化因子,其在胃粘膜組織中產生增加可能是T細胞浸潤的主要原因。在 H p活菌的刺激下,可以誘導RANTES在MKN45細胞內表達。滅活菌和液體培養上清液則不能誘導RANTES在MKN45細胞內表達,說明上調RANTES mRNA的表達主要依賴于Hp的活性。Koh Tomimori等[11]證明 Hp 通過 NF-κ B途徑能夠誘導CC趨化因子CCL20的表達。
本研究發現胃炎患者胃粘膜組織中IP-10、Mig顯著升高,且H p陽性胃粘膜組IP-10、Mig升高更為顯著,并且在H p陽性胃炎患者胃粘膜組織中IP-10、Mig的表達與胃粘膜炎癥活動程度呈正相關。此與Eck M 等[12]等報道一致,而與Kraft M 等[13]、Lindholm C等[14]報道不一致。Eck M等[12]通過原位雜交和免疫組化技術證實,Hp陽性胃炎患者胃黏膜組織中IP-10的表達與T細胞分布一致,認為IP-10是被 T細胞選擇性聚集的,而Mig的表達與單核細胞和內皮細胞的分布一致。Kraft M等[13]通過ELISA法及RT-PCR法體外培養胃黏膜上皮細胞,證實在 IFN-γ及 TNF-α共同刺激下,胃黏膜上皮細胞分泌IP-10、Mig、I-TAC增多,而在 H p活菌刺激下,胃黏膜上皮細胞分泌IL-8增多,但并未上調IP-10、Mig的表達。Lindholm C等[14]體外培養人胃體組織發現 Hp感染早期,GRO-α、IL-8、IL-6分泌增多,影響胃炎發展,而IP-10并無分泌增多。IP-10、Mig的共同受體是CXCR3,CXCR3主要表達于 Th1細胞,Th1可以產生大量的IFN-γ,IFN-γ又可誘導胃黏膜內皮細胞、活化T細胞等分泌IP-10、Mig增多。因此,本研究結果提示,Hp相關性胃炎患者胃黏膜組織中高表達的IP-10、Mig參與了T細胞、單核細胞的選擇性聚集,在感染局部發揮活化Th細胞及其它免疫細胞作用,同時這些活化細胞又分泌更多趨化因子,進一步介導淋巴細胞在胃炎病變粘膜內聚集,參與 Hp所致的胃炎反應。
綜上所述,H p相關性胃炎患者胃粘膜上皮細胞內IP-10、Mig的表達顯著增高,其增高程度與胃粘膜炎癥活動程度呈正相關,趨化因子參與了 Hp相關性胃炎炎性細胞浸潤,而對于 Hp是否能夠直接誘導趨化因子IP-10、Mig的表達,尚需體外細胞培養實驗進一步證實。
[1]Torres VJ,VanCompernolle SE,Sundrud MS,et al.Helicobacter py lori vacuolating cytotoxin inhibits activation-induced proliferation of human T and B lymphocy te subsets[J].J Immunol,2007,179(8):5433-40.
[2]虞燕萍,陳潔.幽門螺桿菌感染與趨化因子的表達[J].國外醫學兒科學分冊,2002,29(1):43-45.
[3]Jin Z,Lin SR,Shen ZY,et al.Pathological observation of the relation between H.py lori and gastric mucosal inflammation[J].Beijing Yike Daxue Xuebao,2000,32:50-52.
[4]Laing KJ,Secombes CJ.Chemokines[J].Dev Comp Immunol,2004,28(5):443-460.
[5]Pacheco-Rodriguez G,Moss J.T he Role of Chemokines in Mig ration of Metastatic-like Lymphangioleiomyomatosis Cells[J].Crit Rev Immunol,2010,30(4):387-394.
[6]Mǜller M,Carter S,Hofer MJ,et al.Review:The chemokine receptor CXCR3 and its ligands CXCL9,CXCL10 and CXCL11 in neuroimmunity-a tale of conflict and conundrum[J].Neuropathol Appl Neurobiol,2010,36(5):368-387.
[7]林敏娟,陽惠湘.幽門螺桿菌感染患者白介素-8及白介素-1β的變化[J].世界華人消化雜志,2002,10(4):478-480.
[8]田黎黎,師水生.慢性胃炎中黏膜相關上皮趨化因子28與白細胞介素-10的表達及與幽門螺桿菌的關系[J].中國藥物與臨床,2010,10(2):200-202.
[9]溫國明,郭悅青.趨化因子受體CCR7及CXCR4在胃癌中的表達[J].廣東醫學雜志,2006,27(7):968-970.
[10]張影,李雪嶺,姜春萌,等.RANT ES與幽門螺桿菌感染[J].國際消化病雜志,2006,26(4):243-246.
[11]Koh T,Eriko U,Hiromitsu T,et al.Helicobacter py lori Induces CCL20 Expression[J].Infect Immun.,2007,75(11):5223-5232.
[12]Eck M,Schmausser B,Scheller K,et al.CXC chemokines Gro(alpha)/IL-8 and IP-10/MIG in Helicobacter pylori gastritis[J].Clin Exp Immunol,2000,122(2):192-199.
[13]K raft M,Riedel S,Maaser C,et al.IFN-gamma synergizes with TNF-alpha but not with viable H.pylori in up-regulating CXC chemokine secretion in gastric epithelial cells[J].Clin Ex p Immunol,2001,126(3):474-481.
[14]Lindholm C,Quiding-J? rbrink M,L? nroth H,et al.Induction of chemokine and cy tokine responses by Helicobacter py lori in human stomach explants[J].Scand J Gastroenterol,2001,36(10):1022-1029.

