用聚合酶鏈反應技術對粉塵螨和屋塵螨進行鑒別和檢測*
丁 雪,羅曉東,羅潔琳,李小敏,沈浩賢,陳代雄
近幾十年來,各種變態反應性疾病如過敏性鼻炎、皮炎、支氣管哮喘和變應性結膜炎等的流行呈逐年上升趨勢[1],已成為全球性的健康問題[2]。變態反應性疾病是接觸變應原后人體產生的一種免疫病理反應過程[3]。現有資料證明[4],塵螨是引起變態反應性疾病最重要的變應原之一。而塵螨中又以粉塵螨(Dermatophagoidesf arinae)和屋塵螨(Dermatophagoides pteronyssinus)數量最多、分布最廣、危害最大[5-7]。但是一方面屋塵螨和粉塵螨的分布不完全相同,另一方面兩者又常在同一環境中同時存在,因此了解某一地區或環境中塵螨的種類和優勢螨種,對過敏性疾病的診斷、預防和治療是非常重要的。本研究嘗試用聚合酶鏈反應(Polymerase Chain Reaction,PCR)技術對粉塵螨和屋塵螨進行鑒別和檢測。
1 材料和方法
1.1 試劑 粉塵螨原種由中山醫學院提供,在本實驗室進行培養繁殖用于實驗;屋塵螨購自瑞典Al-lergon公司。DNA聚合酶、PCR試劑盒和 DNA Marker從 TAKARA公司購買。其它試劑:如乙醇、酚、氯仿、異戊醇均為分析純。
1.2 儀器 1-15PK離心機為SIGMA公司生產;S1000TMPCR儀由BIORAD公司生產;WS-01恒溫恒濕培養箱由湖北黃石恒豐醫療器械有限公司生產。
1.3 方法
1.3.1 粉塵螨和屋塵螨DNA提取 參照趙亞娥[8]和王繼英[9]等報告的方法進行。
1.3.2 隨機引物PCR擴增 參考陳觀今等[10]的研究報告設計隨機引物,由Invitrogen公司合成。兩條引物分別為 RP1、RP3,序列如下:RP1:5'-GAG GCC AGT-3';RP3:5'-GCA ACG CAA T-3'。分別以粉塵螨和屋塵螨DNA為模板進行PCR擴增,PCR 反應體系 25μL(5×PCR Buffer 5μL,上下游引物各 1μL,dNTP(2.5mmol/L)4μL,模板0.5μL,PrimerSTAR HS DNA聚合酶0.5μL,ddH2O 13μL);反應條件參考趙亞娥[8]、周華云等[11]報告:94℃5min預變性,94℃ 1min、36℃1min、72℃2min反應45個循環,72℃延伸 10min。產物經3%瓊脂糖凝膠電泳后,紫外燈下觀察并拍照。
1.3.3 測序 將隨機引物擴增產物交給TAKARA公司,對所選取的條帶進行DNA測序分析。
1.3.4 PCR引物設計 根據測序結果重新設計可用于粉塵螨或屋塵螨檢測的PCR引物。為使引物符合其設計要求,對引物的個別堿基進行了替換,序列如下:
根據粉塵螨約750bp大小DNA擴增片段設計引物:

根據屋塵螨約500bp大小片段設計引物:

1.3.5 PCR擴增粉塵螨和屋塵螨DNA 用新設計的引物,按照1.3.2的PCR反應條件(退火溫度調整為48℃),分別對粉塵螨和屋塵螨的DNA進行擴增。
1.3.6 PCR反應特異性 用新設計的屋塵螨的引物擴增粉塵螨 DNA;用粉塵螨引物擴增屋塵螨DNA,觀察這些引物的特異性。
1.3.7 PCR反應敏感性 各取粉塵螨和屋塵螨DNA 0.25μL和0.1μL量按1.3.5的PCR 條件進行擴增反應,以初步估計該法的敏感性。
2 結 果
2.1 隨機引物擴增結果 分別以粉塵螨和屋塵螨DNA為模板進行PCR擴增,結果見圖1。粉塵螨在750bp和500bp左右均有明顯條帶;而屋塵螨僅500bp左右條帶較清晰,無大于500bp的擴增產物出現。
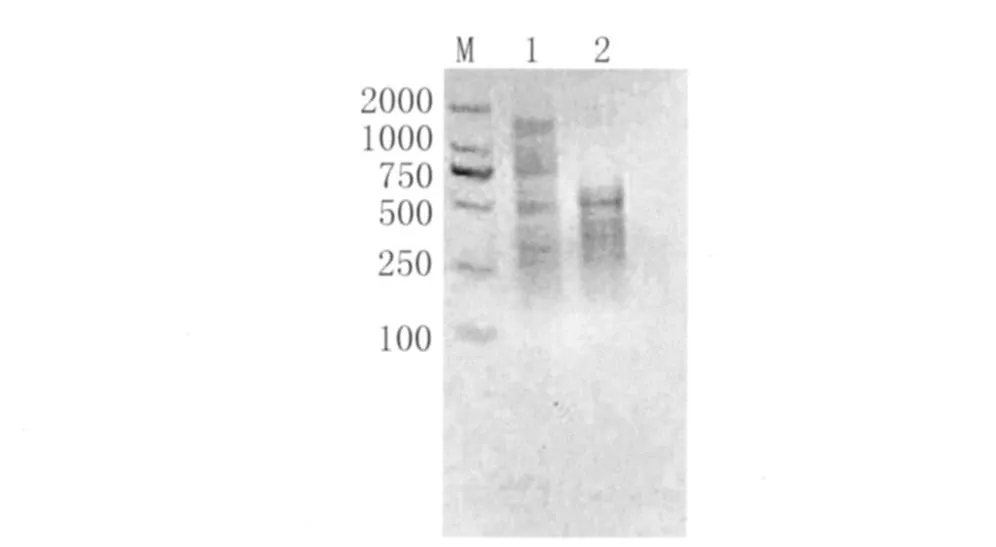
圖1 隨機引物PCR擴增粉塵螨和屋塵螨結果Fig.1 RP-PCR amplification results of D.f and D.p
2.2 測序和同源性分析 對粉塵螨750bp和500bp左右大小的兩個擴增條帶(標記為 df750、df500)與屋塵螨約500bp的一個擴增條帶(標記為dp500)進行回收測序,結果如下。
2.2.1 df750測序和同源性分析結果


片段長度為666bp,劃線部分為設計引物f1,f2所在位置。
同源性分析:未發現與之高度同源序列,與其相似程度最高的基因為Collimonas sp.MPS11E8的3-氧酰基-(酰載體蛋白)合酶,總的相似度為46%。
2.2.2 df500測序和同源性分析結果

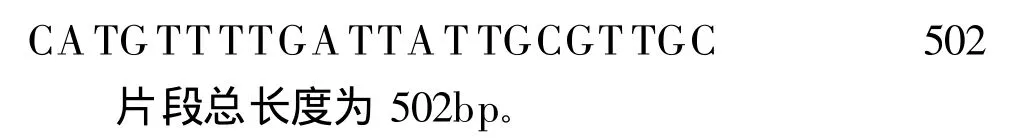
同源性分析:未發現與之高度同源序列。
2.2.3 dp500測序和同源性分析結果

片段總長度為500bp。劃線部分為設計引物p1,p2所在位置。
同源性分析:未發現與之高度同源序列。
2.3 PCR擴增結果 如圖2所示,粉塵螨和屋塵螨的PCR擴增產物大小與預期的一致。
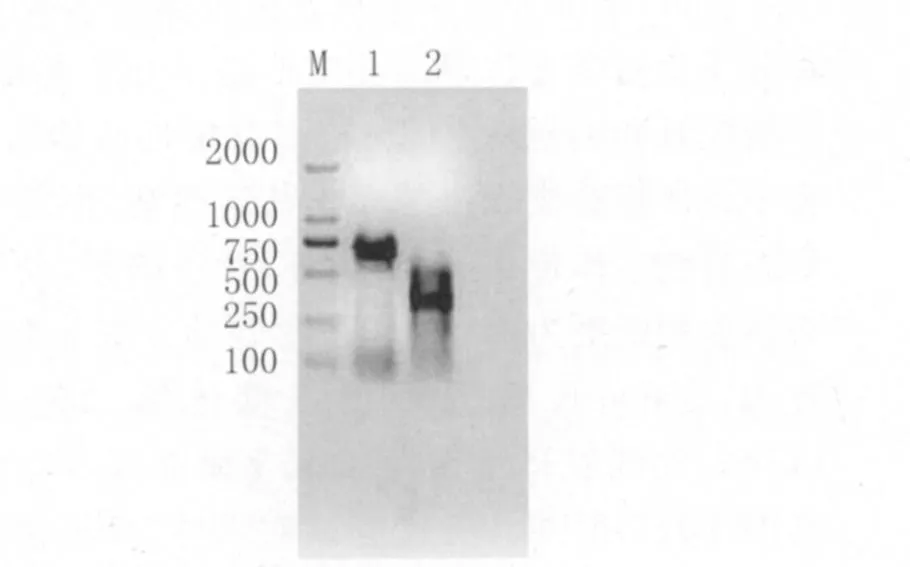
圖2 粉塵螨和屋塵螨PCR擴增結果Fig.2 PCR amplification results of D.f and D.p
2.4 PCR反應特異性 由圖3可看見,無論是粉塵螨還是屋塵螨,均無明顯的目的條帶出現,表明引物具有較好的特異性。
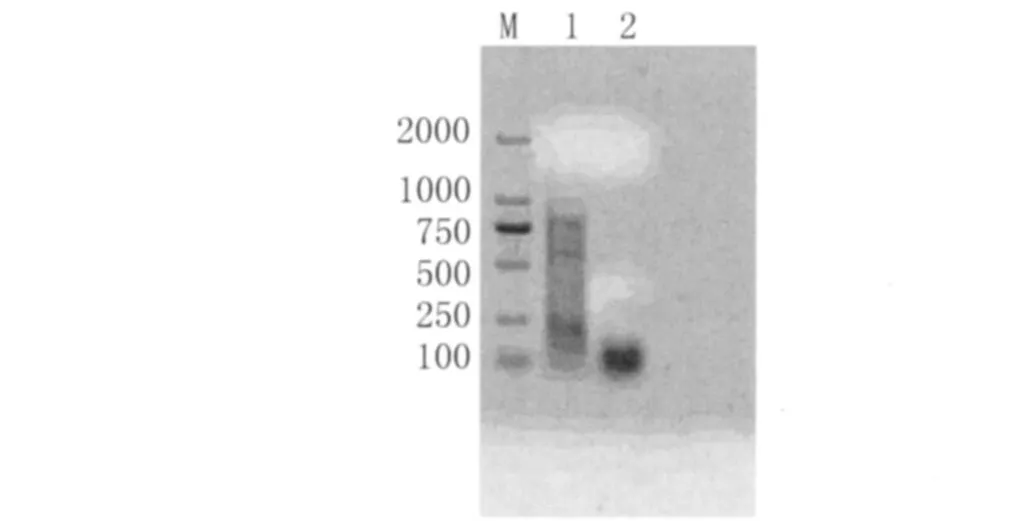
圖3 粉塵螨和屋塵螨PCR反應的特異性結果Fig.3 The specificity of PCR amplification
2.5 PCR反應敏感性 如圖 4。在模板量為0.25μL和0.1μL的條件下,粉塵螨和屋塵螨均可擴增出目的條帶,而0.1μL模板相當于1.5只塵螨的DNA量,表明引物用于塵螨檢測應具有較好的敏感性。
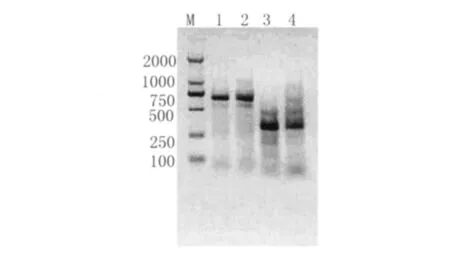
圖4 粉塵螨和屋塵螨PCR反應敏感性結果Fig.4 The sensitivity of PCR amplification
3 討 論
目前,螨的分類和鑒別方法包括形態學方法[12]和分子生物學方法等。其中形態學分類和鑒別,由于粉塵螨和屋塵螨之間形態非常接近;同時,采樣過程中也可能造成螨體的損傷甚至殘缺,而給后續的形態鑒別工作帶來不便;此外,對于螨卵,幼螨的形態學鑒別則更為困難。分子生物學方法分類和鑒別方面,Yang B等[13]根據核糖體第二轉錄間隔(ITS2)和線粒體細胞色素氧化酶亞基(CO1)位點基因序列,用PCR方法嘗試對六種塵螨(包括屋塵螨,粉塵螨,熱帶無爪螨,埋里宇塵螨,腐食酸螨,橢圓板白螨)進行分類。Suarez-Mzrtinez EB等[14]基于mtDNA 12SRNA的13條序列片段,對屋塵螨、熱帶無爪螨、隱秘甘螨和橢圓板白螨4種螨進行了系統進化關系的分析。此外我國學者羅萍[15]用4對隨機引物對腐酪食螨和屋塵螨基因組DNA進行分析,提示其DNA存在可鑒別的異質性。但利用隨機引物PCR進行粉塵螨和屋塵螨的鑒別目前尚未見文獻報道。本研究首次嘗試用該法對粉塵螨和屋塵螨DNA進行了擴增,結果顯示:此方法對這兩種塵螨有較好的鑒別作用。這也為粉塵螨和屋塵螨的鑒別和分類提供了一項新的手段。
本研究還對3個粉塵螨和屋塵螨的DNA片段進行了序列測定。經同源性分析,未發現與之高度同源的序列,因此這3個片段有可能為新的基因片段,其具體功能還有待進一步的研究。此外,在這3個DNA片段中,df500與dp500由同一對引物擴增得到,且片段長度非常接近,但測序發現二者并非相同或相似的一段DNA序列。上述DNA序列的測定為粉塵螨和屋塵螨的遺傳背景研究提供了新的信息,并為用分子生物學技術對塵螨進行進一步的研究提供了可能。
文獻報道[16]:塵螨的致病作用與環境中塵螨的密度有關。每1g灰塵中包含100只塵螨就會導致人體致敏,每1g灰塵中超過500只塵螨就會引發過敏性體質者哮喘等過敏性疾病的發作。因此,對環境中塵螨及其密度的檢測于過敏性疾病的診斷、預防和治療都有重要意義。目前,塵螨的檢測方法主要有鏡檢計數檢查[7]、免疫學檢測[17]、鳥嘌呤檢測[18]和酶學檢測[19]等。鏡檢計數是最傳統的方法。該法的優點是檢測成本低,結果直觀可靠并可對多種螨進行計數,但是該方法工作量大,且檢測過程中殘缺螨、變異螨和幼螨的識別存在困難。免疫學方法、鳥嘌呤檢測或酶學檢測是通過檢測灰塵中塵螨變應原或塵螨排泄物的鳥嘌呤含量或變應原酶活性來估計塵螨種類和數量的一種檢測方法。這些方法均屬于間接檢測方法,同時,免疫學反應存在交叉反應,且不同螨種產生的變應原也可能性質相同,因此,其結果可能存在較大誤差,且難以提供環境中某種塵螨數量、優勢塵螨的種類等重要信息。PCR技術具有敏感、快速、可進行定量檢測等優點,且該方法直接檢測蟲源性DNA,較免疫學檢測方法有更好的特異性。因此,本研究初步嘗試用PCR方法對這兩種塵螨進行檢測。結果顯示:該方法具有較好的特異性和敏感性。為進一步將其實際應用于環境中粉塵螨和屋塵螨的定性和定量檢測奠定了基礎。
[1]Sequndo G R,Sopelete MC,Terra SA,et al.Diversity of aller-gen exposure:implications for the efficacy of environmental control[J].Braz J Otorhinolaryngol,2009,75(2):311-316.
[2]Arlian LG,Platts Mills T A.The biology of dust mites and the remediation of mite allergens in allergic disease[J].J Allergy Clin Immunol,2001,107(3 suppl):406-413.
[3]Hainsworth T.提高對日益增多的變態反應相關疾病的認識[J].國外醫學護理學分冊,2004,6(23):263-264.
[4]International Workshop Report.Dust mite allergens and asthmaa worldwide problem[J].J Allergy Clin Immunol,1989,83:416-427.
[5]Fernandez-Caldas E,Iraola V,Boquete M,et al.Mite immunotherapy[J].Vet Dermatol,2006,17(4):223-235.
[6]胡傳翠,李朝品.塵螨與變應性疾病的研究進展[J].醫學綜述,2009,15(7):1054-1056.
[7]陳國健,盧祺,龐力沛,等.廣州市某高校學生宿舍塵螨孽生的調查[J].環境與健康雜志,2008,3(25):229-231.
[8]趙亞娥,成慧,尋萌,等.人體蠕形螨的DNA提取與隨機引物PCR檢測[J].昆蟲學報,2009,52(8):929-933.
[9]王繼英,俞英,馮利霞,等.酚-氯仿法從豬毛囊中提取基因組DNA[J].遺傳,2010,32(7):752-756.
[10]陳觀今,羅超權,韋相才,等.隨機引物聚合酶鏈反應技術鑒別弓形蟲株的研究[J].寄生蟲與醫學昆蟲學報,1994,2(1):6-7.
[11]周華云,高琪,潘波,等.隨機引物聚合酶鏈反應用于鑒別嗜人按蚊不同地理株的初步研究[J].中國血吸蟲病防治雜志,2000,4(12):214-216.
[12]Colloff MJ.Tax onomy and identification of dust mites[J].Allergy,1998,53(48 Suppl):7-12.
[13]Yang B,Cai J,Cheng X.Identification of astigmatid mites using IT S2 and COI regions[J].Parasitol Res,2011,108(2):497-503.
[14]Suarez-M artinez EB,Montealegre F,Sierra-Montes JM,et al.Molecular identification of pathogenic house dust mites using 12S rRNA sequences[J].Electrophoresis,2005,26(15):2927-34.
[15]羅萍.兩株粉塵螨基因組DNA的研究[J].四川省衛生管理干部學院學報,1998,4(17):197-198;202.
[16]Plattis-mills T AE,De Weck AL.Dust mite allergens and asthma-A world wide problem[J].J Allergen Clin Immunol,1989,83:416-427.
[17]練玉銀,楊杏芬.塵螨變應原含量檢測研究進展[J].熱帶醫學雜志,2006,5(6):603-605.
[18]Quoix E,Le Mao J,Hoy et C,et al.Prediction of mite allergen levels by guanine measurements in house-dust samples[J].Allergy,1993,48(5):306-309.
[19]謝建云.塵螨變應原的酶學研究[J].國外醫學寄生蟲病分冊,1994,3(21):111-114.

