COX-2誘餌載體的構建及其在酵母雙雜交系統中自激活作用的檢測
賀凌婕 張澍田 朱圣韜
(1.首都醫科大學附屬北京友誼醫院急診科;2.首都醫科大學附屬北京友誼醫院消化內科,北京市消化疾病中心)
環氧化酶-2(cyclooxygenase-2,COX-2)是細胞受到各種刺激時迅速合成的一種酶,以前被認為是炎性反應的一個主要標志,近年來醫學界發現它參與多種腫瘤的發生和發展,因此也被認為是癌癥病情的指標。近年來有研究[1-3]表明,在食管鱗癌和食管腺癌中都發現COX-2表達增加。利用RT-PCR、Western blotting、原位雜交技術等方法均證實COX-2在食管癌組織中的陽性表達率明顯高于相對應的癌旁組織及正常組織[4],張強等[5]用原位雜交技術檢測患者食管癌組織中COX-2mRNA的表達,發現食管癌組織中COX-2 mRNA陽性表達率為 80%,明顯高于正常食管黏膜。Takatori H等[6]對手術切除的 228例食管鱗癌組織切片用免疫組織化學技術進行分析,發現 COX-2陽性表達率為91%,且和腫瘤浸潤深度、臨床分期以及生存率等臨床病理特征密切相關。在食管癌中,隨著腫瘤浸潤深度的增加、鱗癌分化程度的減低,COX-2的表達亦相應增強[7]。此外,COX-2在食管癌前病變中也呈過表達,如鱗狀上皮發育不良和 Barrett’s食管[8-9]。Ling F C等[10]發現,COX-2在食管炎-Barrett’s食管-食管癌的發展過程中表達逐漸增高。這些研究都表明 COX-2可能與食管癌的發病相關。為進一步了解 COX-2的功能、作用機制和相互作用蛋白,我們擬采用酵母雙雜交系統進行研究,構建誘餌載體 pG BKT7-COX-2,并轉化酵母菌 Y190,觀察其是否具有自激活作用。
1 材料和方法
1.1 材料
COX-2質粒由美國密歇根大學的 W illiam Smith教授惠贈,酵母菌 (Saccharom yces cerevisiae)Y190、質粒 pGBKT7、pGADT7,對照質粒 pGBKT7-lam、pGBKT7-53、YEAST MAKER Yeast Transformation System、YEAST MAKER Yeast Plas mid Isolation kit,以及酵母菌培養基和 X-Gal等,均購自 Clontech公司。DNA重組的各種限制性內切酶及 PCR反應系統的 LA Taq DNA聚合酶、dNTP、10×buffer緩沖液等購自 TaKaRa公司。大腸桿菌 DH5α為本室保存。其他試劑均為國產分析純。
1.2 方法
1)做 PCR擴增 COX-2質粒:將 COX-2質粒轉化DH5α感受態細胞,挑取單克隆作為 PCR反應模板,用PCR的方法擴增出目的基因。引物設計如下:COX-2 F 5′-GG A ATT CAT GCT CGC CCG CGC CCT-3′;COX-2 R 5′-CGG G AT CCC TAC AGT TCA GTC GAA CGT TCT TTTAGT AGT ACT G-3′,分別在 5′端引入酶切位點EcoRⅠ和 BamHⅠ。反應總體積為 50μL,其中包括:COX-2 F 0.5μL,COX-2 R 0.5μL,2×bufferⅠ25μL, dNTP 5μL,COX-2 1μL,LA Tag E 0.5μL,ddH2O 18 μL,反應程序為:94℃預變性 5 min,94℃變性 30 s, 68℃退火30 s,72℃延伸 90 s,循環30次 ,最后72℃10 min。將獲得的 PCR產物電泳,切膠回收,連接 T-easy載體,將連接產物轉化DH5α感受態細胞,進行藍白斑篩選,取白色菌斑搖菌、提質粒。質粒測序正確后,用 EcoRⅠ和BamHⅠ酶切 COX-2-T-easy質粒,將酶切產物電泳鑒定后切膠回收,保存備用。
2)構建 pGBKT7-COX-2誘餌載體:設計 20μL體系,用 EcoRⅠ和 BamHⅠ酶切載體 pGBKT7,用 T4 DNA連接酶連接 pGBKT7酶切質粒及 COX-2酶切產物,4℃過夜。將連接產物轉化DH5α感受態細胞,涂布于卡那抗性 LB瓊脂板上,倒置于 37℃恒溫箱過夜。挑取生長出的陽性克隆作為 PCR反應的模板,以COX-2 F、COX-2 R作為引物,將連接產物菌斑做鑒定 PCR。將 PCR鑒定后的陽性克隆菌斑搖菌、提質粒,將所得質粒進行電泳鑒定及酶切鑒定。
3)制備酵母感受態:將酵母菌 Y190菌種劃線接種于 YPD平板上,30℃孵育 2~3 d后,沿劃線長出白色克隆。挑取單個酵母菌菌落,接種于 5 mL YPD液體培養基中,充分振蕩之后加 YPD液體培養基至40 mL,30℃320 r/min震蕩培養 16~18 h。取搖菌后的酵母菌液適量,加至 10 mL YPD液體培養基中, 30℃320 r/min培養 3 h。將培養后的菌液 1 000 r/ min離心 5 min,棄上清,用適量 TE/LiAC溶解沉淀。再次離心、棄上清,用 TE/LiAC溶解沉淀后,再離心,取沉淀,用 TE/LiAC將沉淀懸起至 200μL,即成為酵母感受態細胞。
4)將 pGBKT7-COX-2連接產物轉化酵母感受態:將鮭精DNA加熱使之變性,取30μL變性鮭精DNA分裝于 3個微量離心管中,分別加入已構建好的“誘餌”質粒 pG BKT7-COX-2、陽性對照質粒 PG BKT7-53+ PG ADT7-T(53+T)、陰性對照質粒 PGBKT7-lam+ PG ADT7-T(lam+T),每管中加入 100μL酵母感受態細胞,輕搖后,各加入 600μL PEG/LiAC混合液,輕柔振蕩 10 s,于 30℃,200~250 r/min振蕩培養 30 min。之后于每管中加入 70μL DMSO,輕柔混勻,42℃水浴熱擊 15 min,冰浴 1~2 min。14 000 r/min離心 5 min后棄上清,用 500μL ddH2O將沉淀重懸。取 100μL pG BKT7-COX-2菌液涂布于營養缺陷平板 SD/-Trp上,取 53+T、lam+T菌液分別涂布于 SD/-Trp/-Leu板上,倒置放入 30℃孵箱中,培養 1~2 d。
5)pGBKT7-COX-2自激活檢測(檢測β半乳糖苷酶活性):待 3個平板長出陽性克隆后,挑取含有陽性對照質粒、陰性對照質粒和重組質粒的 Y190酵母菌落,將其印跡到無菌的濾紙上。將濾紙上菌落經液氮凍融 3次,使菌體充分破裂。將經液氮凍融的濾紙菌落面朝上置于被 Z buffer/X-gal浸透的另一張濾紙上,30℃放置。前2 h內每隔 30 min觀察菌斑是否變藍,之后第 4 h、第 6 h、第 8 h、第 12 h和第 24 h再次觀察菌斑顏色。
2 結果
做 PCR擴增COX-2質粒,將獲得的 PCR產物于1%的瓊脂糖凝膠上電泳,在 1 800 bp處有一明亮的條帶,與 COX-2的大小一致(圖 1)。
COX-2質粒測序后與www.NCB I.com網上 COX-2基因比對,符合率為 99%(圖 2),提示 COX-2基因擴增正確。
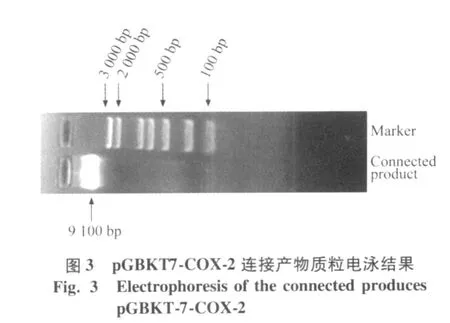
將測序正確的 COX-2基因與載體 pGBKT7連接,構建誘餌載體 pGBKT7-COX-2,將連接產物轉化DH 5α感受態細胞,搖菌提取質粒,電泳鑒定,可見大小約9 100 bp左右的pG BKT7-COX-2連接產物(圖3)。
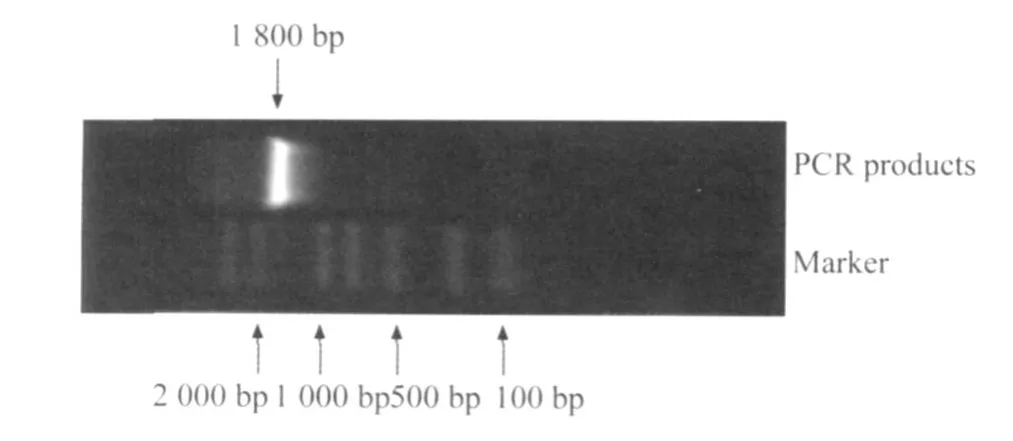
圖1 COX-2擴增產物電泳結果Fig.1 Electropho resis of COX-2 amplified p roducts
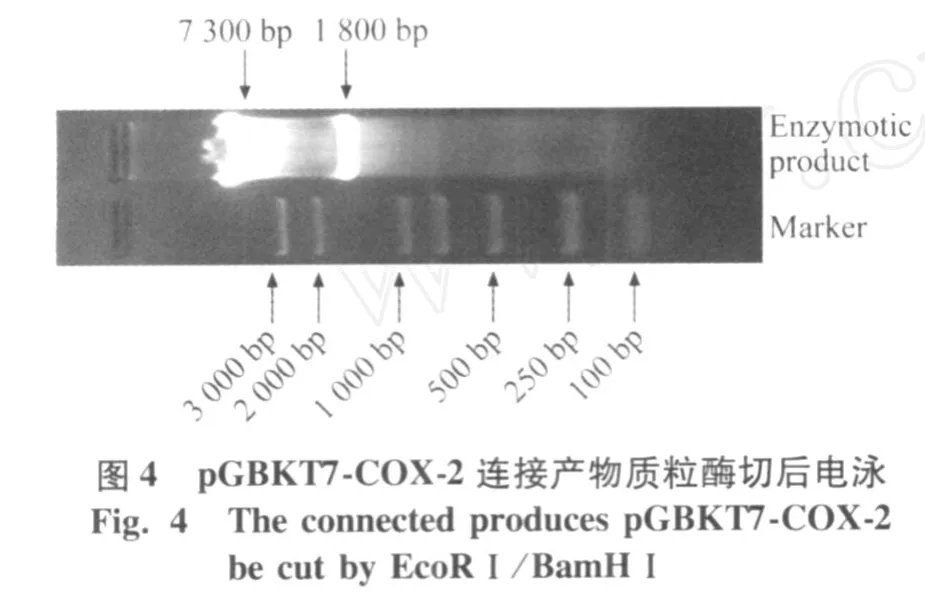
用 EcoRⅠ和 BamHⅠ進行酶切鑒定,可見 1 800 bp左右的 COX-2質粒與 73 000 bp的 pGBKT7(圖4),鑒定正確,正確構建了誘餌載體 pGBKT7-COX-2。

圖2 COX-2基因網上比對結果Fig.2 Result of the COX-2 gene online comparison
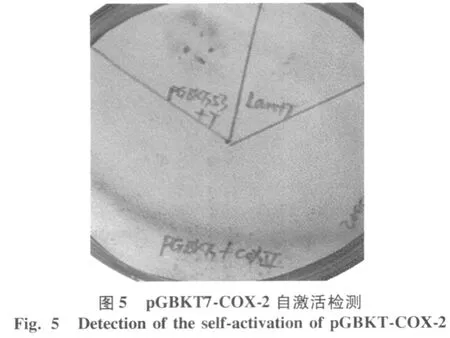
用pGBKT7-COX-2轉化酵母菌 Y190,涂布于 SD/ -Trp平板上,并將 53+T、lam+T分別作為陽性和陰性對照,轉化酵母菌 Y190,涂布于 SD/-Trp/-Leu板上,30℃培養2 d后,可見3個平板長出陽性克隆,挑取含有陽性對照質粒、陰性對照質粒和重組質粒的Y190酵母菌落,將其印跡到無菌的濾紙上。用液氮凍融 3次,使菌體充分破裂,將經液氮凍融的濾紙菌落面朝上置于被 Z buffer/X-gal浸透的另一張濾紙上,30℃放置。觀察 24 h,可見陽性對照 53+T菌斑顯藍色,陰性對照 lam+T及 pGBKT7-COX-2菌斑未變色(圖5)。
3 討論
酵母雙雜交系統 (yeast two hybrid system)是Fields S等[11]提出并建立的一種直接于細胞內檢測蛋白-蛋白之間相互作用的遺傳學方法,其最突出的特點是能夠在酵母這種繁殖迅速、遺傳背景清楚且操作簡便的體系中研究真核細胞的蛋白質之間的相互作用,并通過cDNA文庫的篩選可以直接找到與未知蛋白質相互作用的 DNA序列[12];此外,利用酵母雙雜交技術可確定蛋白間的相互作用位點及結構域。但是,由于某些蛋白本身具有激活轉錄功能或在酵母中表達時發揮轉錄激活作用,酵母雙雜交系統的一個重要的問題是“假陽性”。在應用酵母雙雜交系統進行篩選 cDNA文庫之前,首先要排除“誘餌”蛋白的自激活作用,否則過多的假陽性克隆將嚴重影響實驗結果的準確性,使后續的分析工作量大大增加。
本實驗成功構建了 pGBKT7-COX-2誘餌載體,并檢測了其自激活作用。結果表明,構建的 pGBKT7-COX-2誘餌載體對報告基因 lacZ無自激活作用,為下一步篩選 cDNA文庫實驗奠定了基礎,也為闡明食管鱗癌發病機制提供了線索。
[1] Z immer mann K C,SarbiaM,WeberA A,et al.Cyclooxygenase-2 expression in human esophageal carcinoma[J]. Cancer Res,1999,59:198-204.
[2] W ilson K T,Fu S,Ramanujam K S,et al.Increased expression of inducible nitric oxide synthase and cyclooxygenase-2 in Barrett’s esophagus and associated adenocarcinomas[J].Cancer Res,1998,58:2929-2934.
[3] RistimakiA,Honkanen N,Jankala H,et al.Expression of cyclooxygenase-2 in human gastric carcinoma[J].Cancer Res,1997,57:1276-1280.
[4] Zhi H Y,WangL,Zhang J,et al.Significance of COX-2 expression in human esophageal squamous cell carcinoma [J].Carcinogenesis,2006,27:1214-1221.
[5] 張強,穆玉恕,王宗福,等.COX-2 mRNA表達與食管癌發生發展關系的研究[J].中華腫瘤防治雜志,2008,15:178-179.
[6] Takatori H,Natsugoe S,Okumura H,et al.Cyclooxygenase-2 expression is related to prognosis in patients with esophageal squamous cell carcinoma[J].Eur J Surg Oncol, 2008,34:397-402.
[7] 于鐘,袁宇紅,詹俊,等.食管癌中 COX-2表達與其臨床病理特征及預后的關系 [J].中國病理生理雜志,2006, 22:2216.
[8] KaurB S,Khamnehei N,IravaniM,et al.Rofecoxib inhibits cyclooxygenase-2 expression and activity and reduces cell proliferation in Barrett’s esophagus[J].Gastroenterology,2002,123:60-67.
[9] Shamma A,Yamamoto H,Doki Y,et al.Up-regulation of cyclooxygenase-2 in squamous carcinogenesis of the esophagus[J].Clin Cancer Res,2000,6:1229-1238.
[10]Ling F C,Baldus S E,Khochfar J,et al.Association of COX-2 expression with corresponding active and chronic inflammatory reactions inBarrett’smetaplasia and progression to cancer[J].Histopathology,2007,50:203-209.
[11]Fields S,SongO.A novel genetic system to detect proteinprotein inter-actions[J].Nature,1989,340:245-246.
[12]徐東剛,王嘉璽.酵母雙雜交系統的應用研究進展.國外醫學[J].臨床生物化學與檢驗學分冊,2001,22:281-282.

