黑曲霉H1-9b葡萄糖氧化酶的分離純化及部分性質(zhì)研究
蘇 茉,高亞朋,梁建榮,黃 潔,唐云明
黑曲霉H1-9b葡萄糖氧化酶的分離純化及部分性質(zhì)研究
蘇 茉,高亞朋,梁建榮,黃 潔,唐云明*
(西南大學(xué)生命科學(xué)學(xué)院,重慶市甘薯工程研究中心,三峽庫區(qū)生態(tài)環(huán)境教育部重點(diǎn)實(shí)驗(yàn)室,重慶 400715)
采用研磨法破碎黑曲霉H1-9b菌絲體,經(jīng)pH5.7磷酸緩沖液抽提獲得粗酶液,粗酶液經(jīng)DEAE-Sepharose離子交換層析和Superdex-200凝膠過濾層析,得到葡萄糖氧化酶純品。該酶的比活力為30569.7U/mg,回收率為30.2%,提純倍數(shù)為41.4倍,分子質(zhì)量為94.1kD,為單亞基酶。該酶最適溫度為37℃,最適pH值為5.7,在30~40℃溫度范圍內(nèi)穩(wěn)定性較好,在pH4.0~8.0范圍內(nèi)活性穩(wěn)定。以不同濃度葡萄糖為底物在最適條件下測得該酶Km值為30.69mmol/L,Vmax為21.88μmol/L。Ag+、Cu2+、Zn2+對該酶活性有較大抑制作用。結(jié)果表明,該酶穩(wěn)定性較好,有一定的應(yīng)用價(jià)值。
黑曲霉;葡萄糖氧化酶;分離;純化;性質(zhì)
葡萄糖氧化酶(glucose oxidase EC 1.1.3.4,GOD)能夠在有氧的情況下催化氧化葡萄糖生成葡萄糖酸[1]。這種酶在自然界中有廣泛分布,在工業(yè)生產(chǎn)中多以黑曲霉、青霉等微生物為主要來源[2]。葡萄糖氧化酶在食品加工、釀酒[3]及醫(yī)藥衛(wèi)生行業(yè)均有廣泛應(yīng)用[4],故生產(chǎn)高活性且成本低廉的葡萄糖氧化酶有重要意義。目前用黑曲霉為原材料分離純化葡萄糖氧化酶已有報(bào)道,王志新[5]提純黑曲霉A9的GOD比活力為349.84U/mg,美國Sigma公司生產(chǎn)的商品GOD比活力為266.82U/mg,中國科學(xué)院武漢病毒研究所構(gòu)建的重組酵母所產(chǎn)GOD比活力為426.25U/mg[6],但是酶活力和比活力均不理想。為此,本實(shí)驗(yàn)嘗試用實(shí)驗(yàn)室葡萄糖氧化酶高產(chǎn)菌株黑曲霉H1-9b作為出發(fā)菌株,發(fā)酵生產(chǎn)并分離純化葡萄糖氧化酶,同時(shí)對其部分性質(zhì)進(jìn)行研究。
1 材料與方法
1.1 菌種、培養(yǎng)基與試劑
黑曲霉(Aspergillius niger)H1-9b由西南大學(xué)生命科學(xué)學(xué)院酶工程實(shí)驗(yàn)室保存。
培養(yǎng)基參考文獻(xiàn)[7]配制。發(fā)酵培養(yǎng)基(g/L):蔗糖80、蛋白胨3、KH2PO42、MgSO4·7H2O 0.7、 KCl 0.5、NaNO34, pH5.5;斜面培養(yǎng)基(g/L):蔗糖 30、NaNO32、K2HPO41、KCl 0.5、MgSO40.5、FeSO40.01、瓊脂 20,pH5.5。
DEAE-Sephrose(DEAE-瓊脂糖)、Superdex-200(葡聚糖凝膠)、三羥甲基氨基甲烷(Tris) 香港Farco公司;牛血清白蛋白(bovine seyum albumin)、卵清蛋白(ovalbumin chicken)、胰蛋白酶抑制劑(trypsin inhibtor)、溶菌酶(lysozyme)、藍(lán)色葡聚糖-2000、蛋白質(zhì)SDSPAGE標(biāo)準(zhǔn)品 美國Promega公司;載體兩性電解質(zhì) 美國Bio-Rad公司;丙烯酰胺、甲叉-雙丙烯酰胺 瑞士Fluka公司;其余試劑均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
MC4L冷凍干燥機(jī) 德國Uniequip公司;DYY-Ⅱ型電泳儀 北京六一儀器廠;UV-2550 PC型分光光度計(jì)日本島津公司;BSZ-2型自動(dòng)雙蒸餾水儀 上海博通化學(xué)科技有限公司;高速冷凍離心機(jī) 日本玖保田公司;PHS-32W微電路pH計(jì) 上海理達(dá)儀器廠;Powerlook 2100XL凝膠掃描儀 臺灣Umax公司;AKTA prime plus蛋白質(zhì)純化系統(tǒng) 美國GE公司。
1.3 葡萄糖氧化酶的發(fā)酵
1.3.1 種子液培養(yǎng)
在斜面培養(yǎng)基上接種黑曲霉H1-9b孢子,28℃培養(yǎng)4~5d。
1.3.2 搖瓶發(fā)酵
250mL錐形瓶中分裝50mL發(fā)酵培養(yǎng)基,121℃滅菌20min,接種黑曲霉H1-9a孢子濃度為104個(gè)/mL,28℃、200r/min搖床培養(yǎng)80h即達(dá)產(chǎn)酶高峰。
1.3.3 菌絲體的制備
搖瓶發(fā)酵培養(yǎng)完成后,用紗布過濾發(fā)酵液,收集球狀菌絲體,用雙蒸水將其反復(fù)沖洗,直至把發(fā)酵液沖干凈;再用0.2mol/L pH5.7的磷酸緩沖液沖洗菌絲體,壓干水分,稱質(zhì)量后收集備用。
1.4 酶的分離純化
1.4.1 粗酶液的制備
本實(shí)驗(yàn)采用研磨法破碎菌絲體。將菌絲體置于研缽中,加入適量石英砂,對菌體進(jìn)行研磨;充分研磨后按1:1(m/V)加入預(yù)冷的0.2mol/L pH5.7磷酸緩沖液浸提粗酶,4℃抽提2h。抽提完成后4℃、12000r/min離心20min,取上清液,即為粗酶液,透析1d后收集備用。
1.4.2 DEAE-Sepharose離子交換層析
用300mL 0.05mol/L pH7.1的Tris-HCl緩沖溶液平衡DEAE-Sepharose離子交換層析柱,取5mL粗酶液上樣,用0~1mol/L NaCl(用0.05mol/L,pH7.1的 Tris-HCl緩沖溶液配制)進(jìn)行梯度洗脫,流速0.5mL/min,每管收集5mL,層析完成后收集GOD活性管,透析脫鹽,冷凍干燥后備用。
1.4.3 Superdex-200凝膠過濾層析
用0.05mol/L pH7.1的Tris-HCl緩沖溶液平衡Superdex-200凝膠過濾層析柱過夜,將冷凍干燥后的樣品加水稀釋至2mL上樣,用0.05mol/L pH7.1的Tris-HCl緩沖溶液進(jìn)行洗脫,流速0.3mL/min,每管收集3mL,層析完成后收集GOD活性管,透析脫鹽,冷凍干燥得到GOD純品。
1.5 酶活力的測定
參照文獻(xiàn)[8-9]報(bào)道的方法并加以改進(jìn)。取適當(dāng)稀釋后酶液50μL,加入2.0mL 0.1mol/L pH5.7磷酸緩沖溶液,0.3mL 質(zhì)量分?jǐn)?shù)10%葡萄糖溶液,50μL 16mmol/L 4-氨基安替吡啉,50μL 7.5mmol/L苯酚,50μL過氧化物酶(1000U/mL),在37℃準(zhǔn)確反應(yīng)4min,再置于沸水浴中快速滅活4min,冷卻至室溫,在波長500nm處測定其吸光度;空白對照除酶液預(yù)先滅活,其他處理相同。將每分鐘消耗1μmol葡萄糖所需要的酶量定義為一個(gè)活力單位(U)。
1.6 蛋白質(zhì)含量的測定
用Bradford等[10]方法測定蛋白質(zhì)含量,以牛血清白蛋白為標(biāo)準(zhǔn)品。
1.7 GOD分子質(zhì)量測定
用凝膠過濾法[11]測定GOD全分子質(zhì)量,SDS-PAGE法[12]測定GOD亞基分子質(zhì)量。8% SDS-PAGE分離膠,5%濃縮膠,電泳后用考馬斯亮藍(lán)R-250染色。
1.8 酶的性質(zhì)測定
1.8.1 最適pH值及pH值穩(wěn)定性
37℃條件下,測定GOD在不同pH值(4.0~8.0)緩沖溶液中的酶活力;將GOD置于不同pH值(4.0~8.0)緩沖溶液中,測定25℃保存7d后的酶活力。以最大酶活力為100%,其他條件下酶活力與之相比,計(jì)算相對酶活力。
1.8.2 最適溫度及熱穩(wěn)定性
分別測定GOD在不同溫度(20~80℃) 條件下的酶活力,及在30~70℃條件下分別保溫1、2、3、4、5h后的酶活力。以最大酶活力為100%,其他條件下酶活力與之相比,計(jì)算相對酶活力。
1.8.3 GOD的Km值及Vmax測定
在最適條件下,以不同濃度(25~75mmol/L)的葡萄糖為底物,測定其酶活力,并按雙倒數(shù)法(Lineweaver-Burk法[13])作圖,求出其Km值及Vmax。
1.8.4 金屬離子對酶活性的影響
將GOD與不同的金屬離子溶液混合,使金屬離子的終濃度為1~7mmol/L或0.25~1.5mmol/L,4℃放置30min后,在最適條件下測定其酶活力,以不加金屬離子的酶活力為100%(作為標(biāo)準(zhǔn)管),添加金屬離子后的殘酶活力與標(biāo)準(zhǔn)管酶活力之比即為相對酶活力。金屬離子分別為:Li+、K+、Ag+、Mn2+、Mg2+、Zn2+、Ca2+、Ba2+、Co2+、Cu2+、Pb2+。
2 結(jié)果與分析
2.1 葡萄糖氧化酶的分離純化
粗酶液經(jīng)D E A E-S e p h a r o s e離子交換層析和Superdex-200凝膠過濾層析洗脫曲線如圖1、2所示,酶的分離純化結(jié)果見表1。從整個(gè)分離純化過程看,純化效果較好,純化倍數(shù)較高。

圖1 黑曲霉H1-9b所產(chǎn)GOD的DEAE-Sepharose離子交換層析曲線Fig.1 DEAE-Sepharose ion-exchange chromatography of GOD from A. niger H1-9b

圖2 黑曲霉H1-9b所產(chǎn)GOD的Superdex-200凝膠過濾層析曲線Fig.2 Superdex-200 gel filtration chromatography of GOD from A. Niger H1-9b

表1 黑曲霉H1-9b所產(chǎn)GOD純化結(jié)果Table 1 Purification of GOD from A. niger H1-9b
2.2 酶的純度鑒定
由Superdex-200凝膠過濾層析純化的酶液經(jīng)SDSPAGE分析,用考馬斯亮藍(lán)R-250染色,呈現(xiàn)單一條帶,說明該酶已經(jīng)達(dá)到電泳純(圖3)。

圖3 黑曲霉H1-9b所產(chǎn)GOD的SDS-PAGE電泳圖譜Fig.3 SDS-PAGE of GOD from A. niger H1-9b
2.3 酶的分子質(zhì)量
經(jīng)Superdex-200凝膠過濾層析測得酶的分子質(zhì)量約為94.1kD,經(jīng)SDS-PAGE測得酶的亞基分子質(zhì)量約為94.0kD,可見黑曲霉H1-9b所產(chǎn)GOD是單亞基酶。
2.4 酶的性質(zhì)鑒定
2.4.1 最適pH值及pH值穩(wěn)定性

圖4 pH值對黑曲霉H1-9b所產(chǎn)GOD酶活力的影響Fig.4 Effect of pH on the activity of GOD from A. niger H1-9b
由圖4可見,在37℃時(shí),黑曲霉H1-9b 所產(chǎn)GOD在pH5.7左右活性最強(qiáng),在pH5.0~7.0范圍內(nèi)酶活力較高,超出此范圍酶活力顯著下降。

圖5 黑曲霉H1-9b所產(chǎn)GOD的pH值穩(wěn)定性Fig.5 pH stability of GOD from A. niger H1-9b
由圖5可見,將酶與不同pH值的緩沖溶液混合,25℃放置7d后,保存在各個(gè)pH值下的GOD相對酶活力均保持在80%以上,說明該酶在pH4.0~8.0范圍內(nèi)穩(wěn)定性良好。
2.4.2 最適溫度及熱穩(wěn)定性

圖6 溫度對黑曲霉H1-9b所產(chǎn)GOD酶活力的影響Fig.6 Effect of temperature on the activity of GOD from A. nger H1-9b

圖7 黑曲霉H1-9b所產(chǎn)GOD的熱穩(wěn)定性Fig.7 Thermostability of GOD from A. niger H1-9b
由圖6可見,黑曲霉H1-9b 所產(chǎn)GOD最適溫度為37℃。由圖7可見,該酶在30~40℃具有較好的熱穩(wěn)定性,保溫5h后相對酶活力在50%左右,超過50℃后活力損失較大,在70℃保溫5h后酶活力基本喪失。
2.4.3 酶的米氏常數(shù)
以不同濃度葡萄糖為底物,測得黑曲霉H1-9b所產(chǎn)GOD的Km值為30.69mmol/L,Vmax為21.88μmol/(L·s) (圖8)。

圖8 黑曲霉H1-9b所產(chǎn)GOD的Km值Fig.8 Km of GOD from A. niger H1-9b
2.4.4 金屬離子對黑曲霉H1-9b所產(chǎn)GOD酶活性的影響

表2 金屬離子對黑曲霉H1-9b所產(chǎn)GOD酶活力的影響Table 2 Effects of Li+, K+, Mn2+, Mg2+, Ca2+, Ba2+and Pb2+on the activity of GOD from A. niger H1-9b
如表2所示,金屬離子Li+、K+、Mn2+、Mg2+、Ca2+、Ba2+、Pb2+在1~7mmol/L濃度范圍內(nèi)對黑曲霉H1-9b GOD的活性影響不大,活力均保持在80%以上。而Zn2+、Cu2+、Ag+對其活性影響較大,抑制作用明顯,見圖9。尤其是Ag+,當(dāng)其濃度達(dá)到1mmol/L時(shí),GOD活性已經(jīng)完全喪失。Co2+在低濃度下對GOD有雙重作用,當(dāng)濃度小于1mol/L時(shí),對該酶有抑制作用,但隨著濃度的升高,這種抑制作用逐漸減弱。
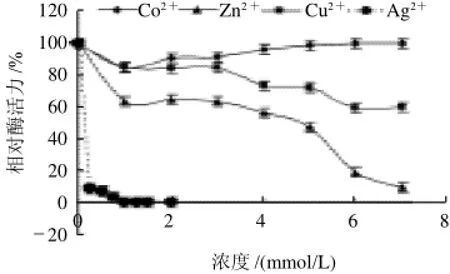
圖9 Co2+、Zn2+、Cu2+、Ag+對黑曲霉H1-9b所產(chǎn)GOD酶活力的影響Fig.9 Effects of Co2+, Zn2+, Cu2+and Ag+on the activity of GOD from A. nger H1-9b
3 討論與結(jié)論
本實(shí)驗(yàn)從黑曲霉H1-9b中分離得到GOD純品,該酶的比活為30569.7U/mg,回收率為30.2%,純化倍數(shù)為41.4倍。尤其是在離子交換層析后,酶比活力呈大幅度上升,分離效果較好。張婷[14]、Simpson等[15]純化的GOD均由兩個(gè)亞基組成,酶蛋白分子質(zhì)量分別為160、148kD,而本實(shí)驗(yàn)測得黑曲霉H1-9b所產(chǎn)GOD的分子質(zhì)量為94kD,且為單亞基酶。這與普遍報(bào)道有所不同,說明GOD分子結(jié)構(gòu)在不同來源的材料中具有特異性。
黑曲霉H1-9b 所產(chǎn)GOD的熱穩(wěn)定性一般,在30~40℃的溫度范圍內(nèi)保溫5h后相對酶活力在50%以上,在工業(yè)生產(chǎn)中可以在常溫下使用。該酶的pH值(pH4.0~8.0)穩(wěn)定性較高,說明該酶的酸堿耐受力好,可在較寬廣的pH值范圍內(nèi)發(fā)揮作用,有較高的應(yīng)用價(jià)值。不同來源的GOD的Km值差異較大,張茜[16]純化的尼崎青霉菌葡萄糖氧化酶Km值為122.6mmol/L,Rando等[17]報(bào)道的GOD的Km值為6.2mmol/L,本實(shí)驗(yàn)中測得黑曲霉H1-9b所產(chǎn)GOD的Km值為30.69mmol/L,與王志新[5]的實(shí)驗(yàn)結(jié)果(Km值35.74mmol/L)較為接近,顯示黑曲霉H1-9b所產(chǎn)GOD對葡萄糖的親和力較好。
Zn2+、Cu2+、Ag+對黑曲霉H1-9b 所產(chǎn)GOD的活性有抑制作用,而在Kelley 等[18]的實(shí)驗(yàn)中當(dāng)Cu2+達(dá)到10mmol/L時(shí),GOD活性仍沒有被抑制。Ag+對該酶的抑制作用很強(qiáng),當(dāng)其濃度增加到1mmol/L時(shí),GOD活性已被完全抑制,故認(rèn)為Zn2+、Cu2+、Ag+是該酶的金屬離子抑制劑。Co2+對黑曲霉H1-9b 所產(chǎn)GOD的作用比較特殊,當(dāng)Co2+濃度低于1mmol/L時(shí),GOD的活性受到了抑制,降至85%,而隨著Co2+濃度的逐漸增加,它對GOD活性的抑制作用減弱,直至其濃度達(dá)到6~7mmol/L時(shí),GOD的相對酶活力又上升至100%。其原因可能是:GOD酶分子上對Co2+有不同的結(jié)合位點(diǎn),類似于許強(qiáng)等[19]用紫外差分吸收光譜技術(shù)研究葡萄糖異構(gòu)酶與金屬離子作用時(shí)得出當(dāng)金屬離子和葡萄糖異構(gòu)酶分子結(jié)合后,每個(gè)酶分子對金屬離子至少存在強(qiáng)弱兩種結(jié)合位點(diǎn)。據(jù)此推測GOD與Co2+結(jié)合后,也可能存在強(qiáng)弱結(jié)合位點(diǎn),當(dāng)Co2+濃度低時(shí),Co2+與酶分子的強(qiáng)結(jié)合位點(diǎn)結(jié)合,改變了酶的分子結(jié)構(gòu),但又不足以達(dá)到穩(wěn)定結(jié)構(gòu)的作用,所以使得酶活力略微下降,當(dāng)濃度升高以后,強(qiáng)弱結(jié)合位點(diǎn)均被占據(jù),達(dá)到穩(wěn)定酶分子結(jié)構(gòu)的作用,酶活力回升。而在本實(shí)驗(yàn)中涉及的其他金屬離子:Li+、K+、Mn2+、Mg2+、Ca2+、Ba2+、Pb2+則在1~7mmol/L濃度范圍內(nèi)對該酶活性的影響不大,且未發(fā)現(xiàn)對GOD活性有明顯激活作用的金屬離子。
[1]HATZIUIKOLAOU D G, MACRIS B J. Factors regulating production of glucose oxidase by Aspergillus niger[J]. Enzyme and Microbial Technology, 1995, 17(6): 530-534.
[2]FOGARTY W M. Microbial enzymes and biotechnology[M]. London: Applied Science Publishers, 1983: 111-123.
[3]PICKERING G J. Optimising glucose conversion in the production of reduced alcohol wine using glucose oxidase[J]. Food Research International, 1998, 31(10): 685-692.
[4]BANKAR B S, BULE M V, SINGHAL R S, et al. Glucose oxidase: an overview[J]. Biotechnology Advances, 2009, 27(4): 489-501.
[5]王志新. 黑曲霉A9葡萄糖氧化酶的提取純化及其酶學(xué)性質(zhì)研究[D].保定: 河北農(nóng)業(yè)大學(xué), 2006.
[6]RETAMA J R, LOPEZ M S P. Biosensors based on acrylic microgels: A comparative study of immobilized glucose oxidase and tyrosinase[J]. Biosensors and Bioelectronics, 2005, 20(11): 2268-2275.
[7]劉峰, 黃鷺強(qiáng), 林穎, 等. 從土壤中快速篩選葡萄糖氧化酶產(chǎn)生菌及發(fā)酵工藝的優(yōu)化[J]. 生物技術(shù), 2007, 17(3): 64-68.
[8]張茜, 傅婉輝, 康勁翮, 等. 青霉葡萄糖氧化酶的分離純化及性質(zhì)研究[J]. 廈門大學(xué)學(xué)報(bào): 自然科學(xué)版, 2009, 48(1): 99-102.
[9]GROMADA A, FIEDUREK J. Selective isolation of Aspergillus niger mutants with enhanced glucose oxidase production[J]. Journal of Applied Microbiology, 1997, 82(5): 648-652.
[10]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[11]陳石根, 周瑞琪. 酶學(xué)[M]. 上海: 復(fù)旦大學(xué)出版社, 2001: 174-175.
[12]張龍翔, 張庭芳, 李令媛. 生化實(shí)驗(yàn)方法和技術(shù)[M]. 2版. 北京: 高等教育出版, 1997: 100-106.
[13]沈同, 王敬巖. 生物化學(xué): 下冊[M]. 2版. 北京: 高等教育出版社, 2000: 250-251.
[14]張婷. Aspergillius niger Z-25產(chǎn)葡萄糖氧化酶發(fā)酵條件優(yōu)化及酶的分離純化研究[D]. 南京: 南京農(nóng)業(yè)大學(xué), 2008.
[15]SIMPSON C, JORDAAN J, GARDINER N S, et al. Isolation, purification and characterization of a novel glucose oxidase from Penicillium sp. CBS 120262 optimally active at neutral pH[J]. Protein Expression and Purification, 2007, 51(2): 260-266.
[16]張茜. 尼崎青霉菌葡萄糖氧化酶的分離純化及性質(zhì)研究[D]. 廈門: 廈門大學(xué), 2009.
[17]RANDO D, KOHRING G W, GIFFHORN F. Production, purification and characterization of glucose oxidase from a newly isolated strain of Penicillium pinophilum[J]. Applied Microbiology and Biotechnology, 1997, 48(1): 34-40.
[18]KELLEY R L, REDDY C A. Purification and characterization of glucose oxidase from ligninolytic cultures of phanerochaete chrysosporium[J]. Journal of Bacteriol, 1986, 166(1): 269-274.
[19]許強(qiáng), 黃友梅. 應(yīng)用光譜技術(shù)研究葡萄糖異構(gòu)酶與金屬離子的作用[J]. 內(nèi)蒙古石油化工, 1997, 23(3): 26-32.
Isolation, Purification and Some Properties of Glucose Oxidase from Aspergillius niger H1-9b
SU Mo,GAO Ya-peng,LIANG Jian-rong,HUANG Jie,TANG Yun-ming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweetpotato Engineering Research Center, School of Life Science, Southwest University, Chongqing 400715, China)
Glucose oxidase (GOD), an H2O2-producing enzyme, was isolated and purified from Aspergillius niger H1-9b through electrophoretic homogeneity, ion-exchange chromatography on DEAE-Sepharose column and Superdex-200 gel filtration chromatography. The purified GOD had a molecular weight of 94.1 kD as a monomer. The specific activity of GOD was 30569.7 U/mg with recovery rate of 30.2% and purification fold of 41.4. The optimal reaction pH and temperature of GOD were 5.7 and 37 ℃, respectively. The GOD displayed an excellent stability under the conditions of 30-40 ℃ and pH 4.0-8.0. The kinetic parameters such as Km and Vmax were 30.69 mmol/L and 21.88μmol/L while using glucose as the substrate. Obvious inhibitory effects of Ag+, Cu2+and Zn2+on the activity of GOD were observed. Therefore, glucose oxidase from Aspergillius niger H1-9b will have wide applications due to its excellent thermostability and stability in wide pH range.
Aspergillius niger H1-9b;glucose oxidase;isolation;purification;property
Q946.5
A
1002-6630(2011)03-0181-05
2010-04-21
重慶市科學(xué)技術(shù)委員會科技攻關(guān)項(xiàng)目(CSCT2004AC1012)
蘇茉(1986—),女,碩士研究生,主要從事蛋白質(zhì)與酶工程研究。E-mail:chaos421@163.com
*通信作者:唐云明(1960—),男,教授,博士,主要從事蛋白質(zhì)與酶工程研究。E-mail:tbright2008@126.com

