花蓋紅菇菌絲體提取物的體外功效及組分分析
袁云輝,張樹斌,姚鋼乾,趙俊霞,王立安,*
花蓋紅菇菌絲體提取物的體外功效及組分分析
袁云輝1,張樹斌1,姚鋼乾2,趙俊霞3,王立安1,*
(1.河北師范大學生命科學學院,河北 石家莊 050016;2.河北旅游職業學院生物工程系,河北 承德 067000;3.河北醫科大學基礎醫學院,河北 石家莊 050017)
采用搖瓶發酵獲得花蓋紅菇菌絲體,用石油醚、乙酸乙酯、乙醇和水提取菌絲體活性物質,得到不同的提取物。采用清除DPPH自由基實驗和抑制小鼠肝細胞脂質過氧化活性實驗檢測各提取物的抗氧化活性。結果顯示:乙酸乙酯提取物和乙醇提取物均具有較高的抗氧化活性,其中以乙醇提取物活性最高。MTT法檢測各提取物對H446肺癌細胞增殖的抑制作用,結果表明:石油醚提取物、乙酸乙酯提取物及乙醇提取物均有較高的抗腫瘤活性。采用色譜技術對乙醇提取物進行分離純化,得到3個單一組分,分別命名為組分Ⅰ、Ⅱ、Ⅲ;經結構鑒定組分Ⅰ為1-氮雜[4,2,0]雙環-4-烯-8-酮。
花蓋紅菇;菌絲體;乙醇提取物;抗氧化;抗腫瘤
花蓋紅菇(Russula cyanoxantha)又稱藍黃紅菇、花蓋菇。隸屬于傘菌目紅菇科紅菇屬。民間常用其子實體治療消化不良、脾虛泄瀉、漲滿腹痛等癥,其子實體提取物對小白鼠肉瘤180和艾氏腹水癌的抑制率分別為70%和60%[1]。高錦明等[2]曾對野生花蓋紅菇子實體的化學成分進行了研究,分離鑒定出6種化合物,4種麥角甾醇、D-阿洛醇及硬脂酸,并根據化合物結構特點分析了其抗腫瘤等功能。
目前,從高等真菌中尋找抗氧化、抗腫瘤等功能性物質的研究已成為國內外研究的熱點。但許多高等真菌不能進行人工栽培,而自然界子實體資源又有限,采用發酵技術獲取大量菌絲體已成為開發利用這些寶貴資源的重要途徑。本實驗利用野生花蓋紅菇菌絲體為材料,采用液體搖瓶發酵培養技術,對培養獲得的菌絲體提取物的抗氧化、抗腫瘤活性進行測定,對活性較高的提取物的化學組分進行分離純化及結構分析。
1 材料與方法
1.1 材料、培養基與試劑
花蓋紅菇(Russula cyanoxantha)采自河北省平山縣駝梁山,菌絲體現保存在河北師范大學真菌生化與分子生物學實驗室;H446肺癌細胞株、昆明小鼠購自河北醫科大學動物中心。將小鼠脫臼處死后,立即取出肝臟稱質量,以0~4℃預冷的生理鹽水制成10%的肝勻漿懸液,4℃冰箱保存備用,在24h以內用完。
斜面及平板活化培養基為常規PDA培養基;液體種子培養基為不含瓊脂的PDA培養基;發酵基礎培養基為:葡萄糖40g/L、蛋白胨5g/L、KH2PO40.5g/L,pH值自然。
1,1-二苯代苦味肼基(DPPH) 美國Sigma公司;石油醚、乙酸乙酯、乙醇、甲醇(均為分析純) 天津永大化學試劑有限公司;GIBCOTMRPMI(Roswell park memorial institute)1640培養基 美國Invitrogen公司;硅膠(100~200目,300~400目) 青島海洋化工廠。
1.2 儀器與設備
真空干燥箱 上海精宏試驗設備有限公司;旋轉蒸發器 上海亞榮生化儀器廠;756分光光度計 上海菁華科技儀器有限公司;MK3酶標儀 熱電(上海)儀器有限公司;HPLC系統 美國 Waters 公司;AutoSpec-Ultima Tof質譜 英國 Micromass公司;500MHz核磁共振波譜儀 德國Bruker公司。
1.3 方法
1.3.1 菌種活化及液體培養
從保存的試管斜面中挑取菌塊,接種到平板活化培養基的中央,25℃避光培養。待平板長滿后,用打孔器(d=0.5cm)在平板邊緣菌絲生長旺盛的部分打孔,挑取菌塊接種到裝有250mL液體種子培養基的500mL三角瓶中,每瓶3塊,于25℃、150r/min搖床培養4d后即得種子液。再將其轉接到發酵基礎培養基中,同條件下搖瓶培養4d得到培養物。
1.3.2 菌絲體提取物的制備
用4層紗布過濾搖瓶發酵培養物,收集得到菌絲體后,于真空干燥箱中50℃干燥,共得27.4g干菌絲體,粉碎后備用。
菌絲體干粉于索氏提取器中先用石油醚連續回流提取12h,再用乙酸乙酯連續回流提取12h,最后用無水乙醇連續回流提取12h。完成3次萃取的菌絲體用80℃熱水浸提4h后,加兩倍體積的90%乙醇過夜沉淀,離心得菌絲體多糖。各提取物經旋轉蒸發去掉有機溶劑后,于50℃真空干燥,得浸膏樣提取物或多糖干粉。將浸膏樣提取物或多糖干粉采用分析天平稱質量,計算提取物的得率。

式中:m為提取物質量;m0為菌絲體干粉質量。
1.3.3 提取物清除DPPH自由基實驗
采用DPPH法,參考文獻[3-4]方法進行測定。
將各提取物用無水甲醇配成質量濃度為10mg/mL的母液,然后用無水甲醇稀釋為質量濃度1、0.1mg/mL的溶液,獲得3種質量濃度測試樣品,放于4℃冰箱備用。
分別取2mL不同質量濃度的樣品于3支試管中,向各管中加入2mL濃度為2×10-4mol/L的DPPH乙醇溶液,混合均勻,30min后于波長517nm處測定其吸光度(Ai)。同時測2mL樣品液+2mL無水乙醇的吸光度(Aj);2mL DPPH的乙醇溶液+2mL無水甲醇的吸光度(A0)。實驗重復3次,計算各樣品對DPPH自由基的清除率。

1.3.4 提取物抑制小鼠肝細胞脂質過氧化活性測定
采用硫代巴比妥酸法,參考文獻[5]方法進行測定。
取每種待測溶液3mL,于波長532nm 處測其吸光度(A),實驗重復3次。計算各提取物對小鼠肝細胞脂質過氧化抑制率。

式中:A0為只加肝組織勻漿的吸光度;A為加樣品和肝組織勻漿的吸光度;Ab為樣品的吸光度。
1.3.5 提取物抗腫瘤活性的測定
細胞培養及四甲基偶氮唑鹽微量酶反應比色法(MTT)檢測,參考文獻[3,6]進行測定。
取對數生長期的H446肺癌細胞株(細胞濃度1×105個/mL)接種于96孔培養板中,每孔加入100μL。各提取物用二甲基亞砜(DMSO)配成終質量濃度為10mg/mL的母液。細胞培養24h后,每孔分別加入100μL各提取物(用無血清的RPMI 1640培養基稀釋),終質量濃度為200、400、800μg/mL。對照組加等量的無血清RPMI 1640培養基,每個處理4次重復。于37℃、CO2培養箱培養48h后,棄去上清液,每孔加入MTT 20μL,繼續培養4h,棄去上清液,每孔加DMSO 150mL,振蕩混勻10min,用酶標儀測波長490nm處的吸光度(A)。計算菌絲體提取物對癌細胞增殖的抑制率。
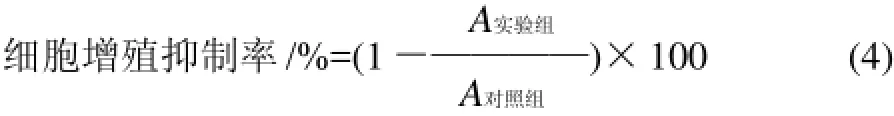
1.3.6 菌絲體乙醇提取物的分離純化及結構鑒定
將乙醇提取物3g,用100~200目的硅膠拌樣,用硅膠柱(硅膠為300~400目,柱長75cm)分離。以乙酸乙酯-甲醇系統洗脫,流速為15mL/min,收集乙酸乙酯、甲醇體積比分別為20:1、15:1、10:1時的洗脫液。將收集后的洗脫液采用旋轉蒸發器于37℃去除洗脫液,對得到的組分進行定量分析。
將得到的組分采用HPLC系統檢測其純度。對單一組分通過高分辨質譜確定其相對分子質量,通過核磁共振譜確定其碳原子、氫原子的個數及每一個原子的化學位移。綜合以上信息對單一組分的化學結構進行分析。
1.3.7 數據分析
實驗中得到的各數據由Statistica 6.0進行單因素方差分析處理。
2 結果與分析
2.1 花蓋紅菇菌絲體提取物的得率

表1 花蓋紅菇菌絲體提取物的得率Table 1 Yield of bioactive components from mycelia of Russula cyanoxantha
由表1可知,菌絲體乙醇提取物的得率最高,為19.42%;其次為菌絲體多糖,為14.89%;石油醚和乙酸乙酯提取物的得率較少且相近,分別為5.18%和5.14%。表明在花蓋紅菇菌絲體液體培養條件下,可以獲得大量的菌絲體乙醇提取物和多糖。
2.2 菌絲體提取物對DPPH自由基的清除率
表2 花蓋紅菇菌絲體提取物對DPPH自由基的清除率,n=3)Table 2 Scavenging capabilities of the extracts from mycelia of Russula cyanoxantha on DPPH free radicalsn=3)%

表2 花蓋紅菇菌絲體提取物對DPPH自由基的清除率,n=3)Table 2 Scavenging capabilities of the extracts from mycelia of Russula cyanoxantha on DPPH free radicalsn=3)%
注:同列字母a~e不同表示差異顯著(P<0.05);同行字母x~z不同表示差異顯著(P<0.05)。
提取物質量濃度/(mg/mL)1010.1石油醚提取物22.27±4.37bx6.33±0.92cy2.51±0.68cz乙酸乙酯提取物63.23±2.80cdx8.54±1.15dey1.85±1.02cz乙醇提取物87.72±0.35ax53.31±2.52ay7.69±2.06az多糖8.84±2.99ex0.61±0.35cy0.96±0.71cy
由表2可知,不同質量濃度的各提取物均有不同程度的清除 DPPH自由基的作用。其中,乙醇提取物的抗氧化活性在相同質量濃度下顯著高于其他提取物。除0.1mg/mL多糖外,各提取物隨著質量濃度的減小,對DPPH自由基清除率均顯著降低(P<0.05)。說明提取物中的抗氧化物質含量與抗氧化活性正相關。
在質量濃度10mg/mL時,4種提取物對DPPH自由基清除能力存在明顯差異。其中乙醇提取物對DPPH自由基清除能力最強,其次為乙酸乙酯提取物,再次為石油醚提取物,菌絲體多糖對自由基清除能力表現最差。在質量濃度為1mg/mL時,乙醇提取物對DPPH自由基清除能力仍表現最強;除乙醇提取物對DPPH自由基清除率下降較小外,其他各提取物對DPPH自由基清除能力均顯著下降。隨著質量濃度降低到0.1mg/mL,石油醚、乙酸乙酯、乙醇提取物清除DPPH自由基的能力又都顯著下降。
多糖對DPPH自由基清除能力在3個測定質量濃度中均表現較低。在質量濃度為1mg/mL和0.1mg/mL時,清除率均小于1,且兩者差異不顯著。
2.3 菌絲體提取物抑制小鼠肝細胞脂質過氧化活性
表3 花蓋紅菇菌絲體提取物對小鼠肝細胞脂質過氧化的抑制率(n=3)Table 3 Inhibitory rates of the extracts from mycelia of Russula cyanoxantha on lipid peroxidation (x± s,n=3)%

表3 花蓋紅菇菌絲體提取物對小鼠肝細胞脂質過氧化的抑制率(n=3)Table 3 Inhibitory rates of the extracts from mycelia of Russula cyanoxantha on lipid peroxidation (x± s,n=3)%
注:同列字母a~f不同表示差異顯著(P<0.05);同行字母x~z不同表示差異顯著(P<0.05)。
提取物質量濃度/(mg/mL)1010.1石油醚提取物43.69±3.01cx41.53±3.71cx20.33±1.87cy乙酸乙酯提取物86.24±0.708ax74.86±1.84aey22.16±0.30cz乙醇提取物91.86±0.99ax74.56±0.38ay66.21±5.30az多糖38.59±3.43cx13.30±3.97fy8.80±4.48dy
由表3可知,不同質量濃度下花蓋紅菇菌絲體各提取物均表現出不同程度的抑制小鼠肝細胞脂質過氧化的作用,并且,隨著質量濃度的降低,抑制脂質過氧化能力均不同程度下降,存在一定的量效關系。
在質量濃度為10mg/mL時,乙醇提取物和乙酸乙酯提取物抑制小鼠肝細胞的脂質過氧化能力較強,兩者不存在顯著差異;其次為石油醚提取物和多糖,兩者之間的差異也不顯著。在質量濃度為1mg/mL時,乙醇提取物和乙酸乙酯提取物仍表現出較強的抑制小鼠肝細胞的脂質過氧化能力,且兩者不存在顯著差異;其次為石油醚提取物;多糖表現最低。在質量濃度為0.1mg/mL時,乙醇提取物表現出最高的脂質過氧化抑制率,其次依次為乙酸乙酯提取物、石油醚提取物和多糖。
綜合表2、3的測定結果可知,乙醇提取物的抗氧化活性最強,其次為乙酸乙酯提取物,再次為石油醚提取物。多糖具一定的抗氧化能力,但相對上述三者最弱。
2.4 菌絲體提取物的抗腫瘤活性
由表4可知,菌絲體各提取物對H446肺癌細胞的增殖均有不同程度的抑制作用,并且隨著質量濃度的升高抑制作用逐漸增強。表明各提取物在抑制H446肺癌細胞的增殖方面存在一定的量效關系。
表4 花蓋紅菇菌絲體提取物對H446肺癌細胞增殖的抑制率,n=3)Table 4 Inhibitory rates of the extracts from mycelia of Russula cyanoxantha on the proliferation of H446 cancer cell linen=3)

表4 花蓋紅菇菌絲體提取物對H446肺癌細胞增殖的抑制率,n=3)Table 4 Inhibitory rates of the extracts from mycelia of Russula cyanoxantha on the proliferation of H446 cancer cell linen=3)
注:同列字母a~d不同表示差異顯著(P<0.05);同行字母x~z不同表示差異顯著(P<0.05)。
提取物質量濃度/(μg/mL)200400800石油醚提取物53.76±0.74ax55.70±1.58ay56.51±0.54ay乙酸乙酯提取物38.24±0.86bx43.45±2.62cy49.87±1.39bz乙醇提取物44.79±0.61bx53.20±0.52by54.86±1.05ay多糖27.15±0.58cx30.46±0.77dy35.43±1.01cz
在終質量濃度為200μg/mL時,石油醚提取物對H446肺癌細胞增殖的抑制作用最強,其次為乙醇和乙酸乙酯提取物,兩者差異不顯著。多糖的抑制作用最弱。在終質量濃度為400μg/mL時,石油醚提取物仍表現出最強的抑制活性,其次依次為乙醇提取物、乙酸乙酯提取物、多糖。在終質量濃度為800μg/mL時,石油醚提取物和乙醇提取物對肺癌細胞增殖的抑制作用表現最強,且兩者差異不顯著;其次為乙酸乙酯提取物;多糖的抑制活性仍表現最弱。
綜合上述結果可以看出,花蓋紅菇菌絲體各提取物對H446肺癌細胞的增殖抑制能力強弱的順序依次為:石油醚提取物>乙醇提取物>乙酸乙酯提取物>多糖。
2.5 菌絲體乙醇提取物的分離純化及結構鑒定
以乙酸乙酯-甲醇體系洗脫,在V(乙酸乙酯):V(甲醇)=20:1時得到組分Ⅰ(10mg);在V(乙酸乙酯):V(甲醇)= 15:1時得到組分Ⅱ(3mg);在V(乙酸乙酯): V(甲醇)=10:1時得到組分Ⅲ (3mg)。經HPLC系統檢測均為單一組分(圖1~3)。

圖1 組分Ⅰ的高效液相檢測圖譜Fig.1 HPLC chromatograph of Fraction I
組分Ⅰ為黃色浸膏(甲醇),其質譜、核磁共振譜分析數據為:F A B-M S m/z:1 2 3%[M]+,分子式(C7H9NO);1H-NMR(DMSO,500MHz):δ3.8(H3)、2.1(H4)、5.7(H5)、5.9(H6)、2.1(H7)、3.7(H8);13CNMR(DMSO,500MHz):δ164.8(C1)、47.9(C3)、47.1(C4)、131.3(C5)、125.6(C6)、28.5(C7)、40.2(C8)。

圖2 組分Ⅱ的高效液相檢測圖譜Fig.2 HPLC chromatograph of Fraction II

圖3 組分Ⅲ的高效液相檢測圖譜Fig.3 HPLC chromatograph of Fraction III
根據上述數據確定組分Ⅰ的相對分子質量為123,為1-氮雜[4,2,0]雙環-4-烯-8-酮;化學結構式如圖4所示。
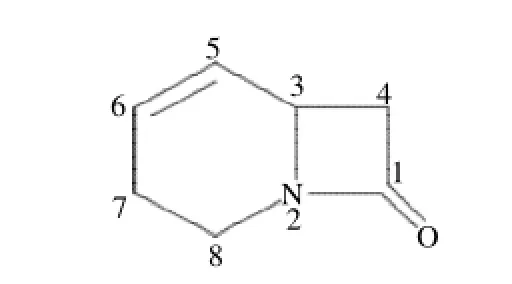
圖4 乙醇提取物中分離到的組分Ⅰ的結構式Fig.4 Structural formula of Fraction I from ethanol-soluble portion (1-aza-bicyclo [4.2.0] oct-4-en-8-one)
3 討 論
目前,已開發利用的天然抗氧化劑多來自植物材料,主要有香辛料提取物、茶多酚類、天然黃酮類、維生素類、蛋白質和酶類、類胡蘿卜素、植酸等幾類物質[7]。近年,對高等真菌中天然抗氧化劑的研究與開發已成為該領域的新熱點。本實驗證實,花蓋紅菇菌絲體各提取物中乙醇提取物的抗氧化活性最強。此外,Tsai等[8]在對豬肚菇(Clitocybe maxima)、阿魏蘑(Pleurotus ferulae)、糙皮側耳(P. ostreatus)3種食用菌子實體提取物的研究中也發現乙醇提取物清除DPPH自由基能力最強,并且報道主要抗氧化成分為酚類物質。本實驗中花蓋紅菇菌絲體乙醇提取物的得率也最高,為19.42%,為進一步將高等真菌乙醇提取物開發為天然抗氧化劑提供了科學依據。
本實驗結果表明花蓋紅菇菌絲體3種具不同極性有機溶劑的提取物均具不同程度的抗氧化活性,表明高等真菌中抗氧化物質的復雜性。Ju等[9]報道了樺褐孔菌(Inonotus obliquus) 子實體中含有香草酸、兒茶酸、紫丁香酸等抗氧化活性物質,進一步證明高等真菌中含有多種不同類型的抗氧化物質。
在本實驗中,花蓋紅菇菌絲體多糖的抗氧化活性表現較差,與其他報道略有不同。如Meng等[10]報道羊肚菌(Morchella esculenta)菌絲體胞外多糖具有較強的清除超氧陰離子自由基和羥自由基能力,并且具有還原能力,說明不同來源真菌多糖其抗氧化活性可能不同。另外,多糖抗氧化活性強弱可能還與糖苷鍵的連接方式有關, Sun等[11]對綠紅菇(Russula virescens)抗氧化活性多糖研究發現,高活性多糖中,1→6糖苷鍵占 68.3%,1→3糖苷鍵占31.7%;低活性多糖中,1→6糖苷鍵占7.9%,1→2糖苷鍵占9.6%,1→4糖苷鍵占35.7%,1→3糖苷鍵占46.8%。多糖的抗氧化活性可能還與純度有關。陶明煊等[12]報道,金頂側耳(P. citrinopileauts)、姬菇(P. cornucopiae)和毛頭鬼傘(Coprinus comatus)精多糖與粗多糖相比,對超氧陰離子自由基清除率分別提高62.5%、58.3%和51.5%;對羥自由基清除率分別提高33.1%、42.3%和33.2%;對DPPH自由基清除率分別提高56.0%、63.5%和60.3%,粗多糖經精制后,自由基清除能力明顯提高。
腫瘤目前仍是人類健康的首要威脅,從大型真菌中尋找抗腫瘤藥物已成為一個重要研究方向。其中大型真菌多糖具有提高免疫力、抗腫瘤的作用已得到科學研究的普遍證實[13-14],但最新研究發現,真菌多糖在誘導癌細胞凋亡、抑制致腫瘤物激活酶、激活解毒酶等方面也具重要作用[15-16]。目前,市場上以食藥用菌多糖為原料的保健產品很多,其中,靈芝多糖、香菇多糖、茯苓多糖和裂褶菌多糖等注射液作為癌癥患者治療的輔助藥物,已在臨床上得到正式應用。但從本研究的結果看,花蓋紅菇多糖抗H446肺癌細胞的活性并不強,可能與多糖抗腫瘤主要是通過提高機體免疫力而不是直接殺傷腫瘤細胞有關。而石油醚、乙酸乙酯、乙醇提取物均表現較強的抗腫瘤活性,暗示著這些提取物中存在著直接殺傷或誘導癌細胞凋亡的物質,對這些成分進一步分離純化,有助于尋找具有新型結構的抗癌化合物。
本實驗在對抗氧化、抗腫瘤活性較高的乙醇提取物進行分離純化過程中,獲得了3種組分。獲得的組分Ⅰ是一個類似于頭孢類母核的β-內酰胺類成分,據其結構推測可能具有廣譜的抗菌作用,并且未見文獻報道。另外兩種組分Ⅱ和Ⅲ,由于量較少,不適合采用NMR進行結構分析,未獲得理想結果。這方面的研究筆者仍在繼續。
高等真菌“創造系數”很高,含多種多樣的生物活性物質,如萜類、黃酮類、酚類物質,凝集素、甾類化合物等。這些天然生物活性物質化學結構多樣而且新穎,這種化學結構的多樣性對于現代保健品、藥物的開發和農藥先導物質的發現至關重要[17]。以液體培養技術為基礎,以活性跟蹤為導向,系統研究高等真菌活性物質的化學成分和藥理作用,不僅可以拓寬其活性物質研究空間,形成一個新的研究領域,而且也可積極推進真菌化學與藥學等多學科的相互滲透、相互交叉,為人類健康造福。
[1]黃年來. 中國大型真菌原色圖鑒[M]. 北京: 中國農業出版社, 1998: 224-225.
[2]高錦明, 董澤軍, 劉吉開. 藍黃紅菇的化學成分[J]. 云南植物研究, 2000, 22(1): 85-89.
[3]趙俊霞, 袁廣峰, 徐瑞雅, 等. 草菇培養物中粗三萜和黃酮含量及抗氧化抗腫瘤活性研究[J]. 菌物學報, 2007, 26(3): 426-432.
[4]豐永紅, 于淑娟, 李國基. DPPH 法測甘蔗提取物抗氧化活性研究[J]. 甘蔗糖業, 2003(1): 31-33.
[5]ASKAWA T, MATSUSLUTA S. Thiobarbituric acid test for detecting lipid peroxides[J]. Lipid, 1980, 14: 401-406.
[6]鄭琳, 黃蔭成, 高清祥. 白阿魏蘑粗提物抗氧化和抗腫瘤活性的研究[J]. 菌物學報, 2005, 24(1): 71-78.
[7]眭紅衛. 天然抗氧化劑的開發研究與應用前景[J]. 武漢商業服務學院學報, 2006, 20(3): 82-84.
[8]TSAI S Y, HUANG S J, LO S H, et al. Flavour components and antioxidant properties of several cultivated mushrooms[J]. Food Chemistry, 2009, 113: 578-584.
[9]JU H K, CHUNG H W, HONG S S. Effect of steam treatment on soluble phenolic content and antioxidant activity of the Chaga mushroom (Inonotus obliquus)[J]. Food Chemistry, 2010, 119: 619-625.
[10]MENG Fanyun, LIU Xiaonan, JIA Le, et al. Optimization for the production of exopolysaccharides from Morchella esculenta SO-02 in submerged culture and its antioxidant activities in vitro[J]. Carbohydrate Polymers, 2010, 79(3): 700-704.
[11]SUN Zhongwei, ZHANG Lixiang, ZHANG Bin, et al. Structural characterisation and antioxidant properties of polysaccharides from the fruiting bodies of Russula virescens[J]. Food Chemistry, 2010, 118(3): 675-680.
[12]陶明煊, 王峰, 劉俊, 等. 3種食用菌多糖自由基清除作用研究[J]. 食品科學, 2009, 30(23): 135-137.
[13]耿建芳, 肖月升. 食用菌多糖抗腫瘤的免疫調節作用探討[J]. 時珍國醫國藥, 2006, 17(5): 855-856.
[14]陳艷. 中藥多糖抗腫瘤機制研究進展[J]. 藥學與臨床研究, 2010, 18 (2): 123-126.
[15]李松, 吳青華, 陳暢, 等. 多糖抗腫瘤活性的最新研究進展[J]. 中國生化藥物雜志, 2007, 28(3): 213-215.
[16]陳義勇, 顧小紅, 湯堅. 樺褐孔菌多糖IOP3a的分離純化及其體外抗腫瘤活性研究[J]. 食品科學, 2010, 31(15): 91-94.
[17]劉吉開. 高等真菌化學[M]. 北京: 中國科學技術出版社, 2004: 1-7.
Bioactivity and Chemical Components of Mycelial Extracts of Russula cyanoxantha
YUAN Yun-hui1,ZHANG Shu-bin1,YAO Gang-qian2,ZHAO Jun-xia3,WANG Li-an1,*
(1. College of Life Science, Hebei Normal University, Shijiazhuang 050016, China;2. Department of Biology Engineering, Hebei Tourism Vocational College, Chengde 067000, China;3. College of Basic Medical, Hebei Medical University, Shijiazhuang 050017, China)
Russula cyanoxantha was cultured using liquid fermentation medium. Mycelia of Russula cyanoxantha were subjected to extraction by petroleum ether (PE), ethyl acetate (EA) and ethanol, respectively. Antioxidant activities of different extraction fractions were evaluated by scavenging capacity on DPPH free radicals and inhibitory rate of lipid peroxidation. Results indicated that EA-soluble extract and ethanol-soluble extract had better antioxidant activities and the ethanol-soluble extract revealed the highest antioxidant capability. MTT assay indicated that PE, EA and ethanol extracts had obvious inhibition effects on the proliferation of H446 cancer cells, suggesting the anti-tumor activities of these extracts. The compositions of ethanol extract from mycelia of Russula cyanoxantha were analyzed. Three fractions were achieved by chromatographic separation as Fraction I, II and III, respectively. Fraction I was identified as 1-aza-bicyclo [4.2.0] oct-4-en-8-one by IR, FAB-MS,1H NMR,13C NMR, HSQC and HMBC methods.
Russula cyanoxantha;mycelia;ethanol extract;antioxidant activity;anti-tumor activity
Q939.5
A
1002-6630(2011)03-0223-05
2010-04-19
河北省自然科學基金項目(C2008000155);河北省教育廳重點研究計劃項目(ZH2007107)
袁云輝(1982—),男,碩士研究生,主要從事真菌生物化學研究。E-mail:yuanyunhui82827@163.com
*通信作者:王立安(1965— ),男,教授,博士,主要從事真菌天然產物研究。E-mail:wlian1965@126.com

