三維Ag/ZnO中空微球的制備及其抗菌性能
盧偉偉,宋應利,張 軍,王鍵吉
(河南科技大學化工與制藥學院,河南洛陽471003)
0 前言
納米無機抗菌劑與傳統的有機抗菌劑和塊狀無機抗菌劑相比,具有穩定性好、安全性能高、抗菌譜廣、效果持久、所需用量少等眾多優點。近年來,在眾多的無機抗菌劑中,Ag納米粒子以及Ag+離子的抗菌性能已經被廣泛研究和應用[1-7]。但在抗菌方面,單質Ag納米粒子有別于Ag+離子,單質Ag納米粒子的抗菌活性受到其粒徑的影響極大,即粒徑越小,其抗菌活性越高[2,7]。然而,隨著粒徑的減小,表面能的增加,Ag納米粒子非常容易團聚,從而使其抗菌性能大大降低。同時,為了更經濟的使用貴金屬Ag,也需要尋找一種既不損害其功能又高效的方式來分散Ag納米粒子。基于這種目的,Ag納米粒子被擔載于SiO、分子篩[9]以及碳纖維[10]等載體上來使用,然而這些載體卻沒有抗菌活性。而制備成本較低的ZnO作為另一種優良的無機抗菌劑,可以作為Ag納米粒子的良好載體,從而形成Ag/ZnO復合材料應用于納米抗菌研究。
本文在生物高分子海藻酸鈉的輔助下,采用水熱合成的方法制備了具有三維分層超結構的Ag/ZnO中空微球,利用場發射掃描電鏡、高分辨透射電鏡和光電子能譜等手段對其結構進行了表征,最后對其抗菌性能進行了研究。
1 試驗部分
1.1 三維Ag/ZnO中空微球的制備
海藻酸鈉購買自Acros,其他所有試劑均購自北京化學試劑有限公司。三維Ag/ZnO中空微球的制備過程如下:將1.5 mmol乙酸鋅和適量硝酸銀溶解于20 mL水和10 mL乙醇的混合溶劑中,在磁力攪拌下,向上述溶液中加入0.55 mL、25.4 mmol/L的海藻酸鈉水溶液,然后再逐滴加入1.0 mL質量分數為28%的氨水,攪拌10 min左右轉移到50 mL聚四氟乙烯內襯的高壓反應釜中,旋緊釜蓋,置于烘箱中393 K下恒溫反應8 h。反應結束后,取出反應釜,自然冷卻至室溫,所得產物經離心分離,并用去離子水和乙醇洗滌數次,最后自然晾干,得到粉末狀的Ag/ZnO樣品。
1.2 樣品的表征
樣品形貌的FESEM觀察在Hitachi S-4800場發射掃描電子掃描顯微鏡上進行。樣品的TEM和 HRTEM表征分別在Hitachi H-800低分辨透射電鏡及JEOL 2100高分辨透射電鏡上進行。樣品的表面性質及氧化態通過X射線光電子能譜在PHIQuantum 2000型XPS探針儀上進行表征。以各個樣品中的烴基污染物中C 1s作為內標矯正樣品中其他各元素的絕對電子結合能。樣品表面的實際Ag含量通過靈敏度因子法進行計算。
1.3 抗菌性能測試
通過兩種方法測定樣品的抗菌性能:紙片擴散法(改性的Kirby-Bauer技術)和最小抑菌濃度(MIC)法。
1.3.1 定性的紙片擴散法
將蘸有ZnO或Ag/ZnO樣品(直徑大約5 mm)的圓形紙片置于事先接種的瓊脂平板中,于37℃培養24 h后取出觀察抑菌圈的大小。
1.3.2 定量MIC分析
稱取不同量的Ag/ZnO樣品倒入盛有20 mL LB培養液的三角燒瓶中,蓋上透氣棉塞放入滅菌鍋中處理后,冷卻。然后,于上述三角瓶中分別接種200μL(濃度為每毫升細菌菌落數為108個)的菌液,在振動搖床上恒溫35℃振蕩16 h。最后,取等量的溶液經梯度稀釋后,分別涂于固體LB培養基上,采用平板計數法計算活菌數(取3個平板的平均值)。能夠抑制細菌生長的最小樣品濃度定義為此樣品的最小抑菌濃度值(MIC值)。每個樣品做3次平行,MIC值取其平均值。
2 結果與討論
2.1 Ag/ZnO中空球的晶體微觀結構
所制備的Ag/ZnO樣品的FESEM表征如圖1所示。從圖1a和圖1b所示的SEM電鏡照片可以看出:樣品整體上呈3~5μm的球形。圖1c顯示了一個破碎微球的一部分,從圖1c可以看出:微球為中空,其球壁是由直徑約100 nm、長度約1μm的納米棒定向排列組成。而從圖1d可以看出:微球表面并非光滑的,看到的為定向排列的納米棒的頂端。

圖1 Ag/ZnO中空微球的FESEM圖
圖2所示為對Ag/ZnO樣品所做的TEM和HRTEM分析。圖2a所示的破碎微球某部分的TEM圖確認了在FESEM觀察中得到的結論,即Ag/ZnO中空微球的球壁是由定向排列的納米棒組成的。圖2b所示的TEM圖為散落于銅網上的某幾根Ag/ZnO納米棒,其中,ZnO和Ag的高分辨的二維晶格透射像分別如圖2c和圖2d所示。圖2c中均勻的二維晶格條紋說明了ZnO的高度結晶性,其<0001>方向的晶格間距約為0.528 nm,近似等于六方晶系ZnO(0001)晶面的面間距,這說明ZnO是沿著<0001>方向擇優生長的。結合圖2a可知:所有組成微球的ZnO納米棒都是沿著其生長方向垂直于微球表面而定向排列的。從圖2d的HRTEM圖還可以觀察到多晶態Ag納米粒子的不均勻晶格條紋,這也說明了所制備的樣品是由金屬Ag和半導體ZnO所組成的復合材料。

圖2 樣品的TEM和HRTEM圖
為了進一步考察所制備Ag/ZnO中空微球的表面性質,樣品進行了XPS分析。樣品中元素的電子結合能都采用污染烴的C 1s峰(標準值284.6 eV)進行了矯正。樣品的XPS全譜和Ag 3d能級的XPS窄譜如圖3所示。圖3a顯示了純ZnO和Ag的質量分數為2.13%的Ag/ZnO樣品的XPS全譜,通過對比可以發現:Ag的峰僅出現在Ag/ZnO樣品中。Ag/ZnO樣品的Ag 3d XPS曲線如圖3b所示,作為對比,所制得的純Ag的XPS譜也同樣列出。通過比較可以發現:Ag的質量分數為2.13%的Ag/ZnO樣品中Ag電子結合能向低位移動,這表明在Ag/ZnO體系中,金屬Ag向半導體ZnO轉移電子,導致了Ag的電子密度減小而使Ag納米粒子帶部分正電荷。

圖3 樣品的XPS圖譜
2.2 樣品抗菌性能的研究
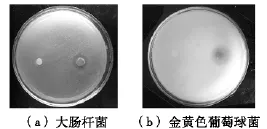
圖4 ZnO和Ag/ZnO抑菌作用的定性紙片擴散法實驗照片
許多的文獻已經報道Ag納米粒子具有強的抗菌作用[1-2],然而由于納米Ag易于團聚,這大大降低了其抗菌性能。為了解決這個問題,在研究中,Ag納米粒子被擔載于ZnO上。除此之外,由于納米Ag和ZnO納米棒之間存在強的相互作用,在形成Ag/ZnO復合材料后,它們可能協同地發揮抗菌作用。本文考察了所制備的Ag的質量分數為2.13% 的Ag/ZnO樣品對大腸桿菌和金黃色葡萄球菌的抗菌性能。樣品對大腸桿菌和金黃色葡萄球菌的抗菌作用,分別做了紙片擴散的定性分析和測定MIC值的定量分析。定性的紙片擴散法得到的樣品抑菌圈的照片如圖4所示,從圖4中可以看出:對大腸桿菌和金黃色葡萄球菌,Ag/ZnO樣品的紙片周圍都有明顯的抑菌圈產生。這表明Ag/ZnO不僅對格蘭氏陰性細菌而且對格蘭氏陽性細菌也具有抗菌活性。
為了更進一步考察樣品的抗菌性能,對Ag,ZnO和Ag/ZnO的MIC值進行了測定,其結果列于表1中,實驗結果表明:Ag的質量分數為2.13%的Ag/ZnO樣品對大腸桿菌和金黃色葡萄球菌的MIC值分別為600μg/mL和400μg/mL。如以Ag的量來計算,則Ag的質量分數為2.13%的Ag/ZnO樣品對大腸桿菌抑菌值僅為12.8μg/mL,而對金黃色葡萄球菌則僅為8.5μg/mL。從表1中還可以看出:Ag納米粒子的MIC值對大腸桿菌和金黃色葡萄球菌分別為15μg/mL和25μg/mL;純ZnO的MIC值對大腸桿菌和金黃色葡萄球菌分別為3 500μg/mL和1 000μg/mL。因此,從實用性和經濟性來說,Ag的質量分數為2.13%的Ag/ZnO微球的抗菌性能要遠遠高于純的Ag和ZnO。
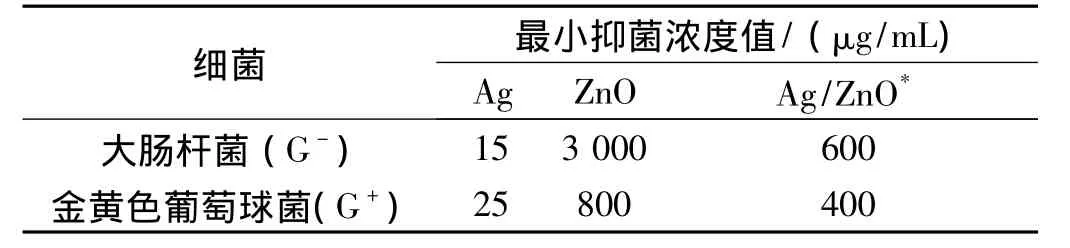
表1 Ag,ZnO和Ag/ZnO樣品的最小抑菌濃度(MIC)值
從表1的數據可以看出:盡管Ag和 ZnO都具有抗菌活性,但它們對G-和G+細菌的抗菌效果不同,Ag對G-細菌的抗菌性能要好于對G+的抗菌性能,而ZnO則對G+的抗菌性能較好。這種現象分別在有關Ag[1]和ZnO[11-12]的抗菌文獻中有過報道。因此,當Ag和ZnO結合形成Ag/ZnO復合材料時,Ag/ZnO同時對G-和G+細菌表現出了優異的抗菌性能;并且Ag/ZnO的抗菌效果并不是Ag和ZnO抗菌效果的簡單相加而是相互協同加強的。
一方面,ZnO納米棒作為載體減少了Ag納米顆粒的團聚,從而使Ag納米粒子有更多的機會接觸細菌的細胞壁并和其中含有S和P的化合物反應。已有文獻報道顯示:Ag納米粒子和細胞壁的這種相互作用,將影響細胞壁的滲透性和呼吸性能等而最終導致細菌的死亡[2,6]。另一方面,Ag納米粒子和細菌之間的靜電相互作用,在抗菌過程中也起到很大的作用[1-2]。在細菌存活的正常pH值,由于細胞壁上大量含羧基和其他基團化合物的脫落溶解,細菌表面總體上呈電負性[12]。并且由于體系中電子從金屬Ag轉移至ZnO,因此Ag/ZnO復合材料中的Ag納米粒子和純Ag納米粒子相比具有很強的電正性。所以,正是由于Ag/ZnO中金屬Ag和半導體ZnO的這種相互作用,導致了正電性的Ag和負電性的細菌之間靜電作用的加強,從而提高了Ag/ZnO的抗菌性能。
3 結論
本文采用水熱合成的方法制備了Ag含量不同的三維Ag/ZnO中空微球,對其結構進行了表征和抗菌性能的研究,結構表征結果說明:所制的樣品為直徑3~5μm的中空微球,其球壁是由直徑約100 nm,長度約1μm的Ag/ZnO納米棒沿著其生長方向并垂直于微球表面的定向排列所組成。這種新穎獨特的自組裝三維分層超結構的Ag/ZnO復合材料的形成,一方面有效解決了Ag納米粒子和Ag/ZnO復合納米棒在溶液中的團聚問題,而使所制備材料的抗菌性能大大提高;另一方面,由于Ag對格蘭氏陰性細菌的抑制作用較強,而ZnO對格蘭氏陽性細菌的抑制作用較強,而使Ag/ZnO復合材料表現出協同的高效抗菌性能。
[1] Shrivastava S,Bera T,Roy A,et al.Characterization of Enhanced Antibacterial Effects of Novel Silver Nanoparticles[J].Nanotechnology,2007,18(22):5103-5111.
[2] Morones J,Elechiguerra J,Camacho A,et al.The Bactericidal Effect of Silver Nanoparticles[J].Nanotechnology,2005,16 (10):2346-2353.
[3] Aymonier C,Schlotterbeck U,Antonietti L,et al.Hybrids of Silver Nanoparticles with Amphiphilic Hyperbranched Macromolecules Exhibiting Antimicrobial Properties[J].Chemical Communications,2002,24:3018-3019.
[4] Oyanedel C,Smith J.Sustainable Colloidal Silver Impregnated Ceramic Filter for Point of Use Water Treatment[J].Environmental Science&Technology,2008,42(3):927-933.
[5] GogoiS,Gopinath P,Paul A,etal.Green Fluorescent Protein-expressing Escherichia coli as a Model System for Investigating the Antimicrobial Activities of Silver Nanoparticles[J].Langmuir,2006,22(22):9322-9328.
[6] Baker C,Pradhan A,Pakstis L,et al.Synthesis and Antibacterial Properties of Silver Nanoparticles[J].Journal of Nanoscience and Nanotechnology,2005,5(2):244-249.
[7] Siekkinen A R.Synthesis of Silver Nanoplates at High Yields by Slowing Down the Polyol Reduction of Silver Nitrate with Polyacrylamide[J].Journal of Materials Chemistry,2007,17(25):2600-2602.
[8] Yoon K Y,Byeon JH,Park CW,et al.Antimicrobial Effect of Silver Particles on Bacterial Contamination of Activated Carbon Fibers[J].Environmental Science&Technology,2008,42(4):1251-1255.
[9] Yamamoto O,Nakakoshi K,Sasamoto T,etal.Adsorption and Growth Inhibition of Bacteria on Carbon Materials Containing Zinc Oxide[J].Carbon,2001,39(11):1643-1651.
[10] Sawai J.Quantitative Evaluation of Antibacterial Activities of Metallic Oxide Powders(ZnO,MgO and CaO)by Conductimetric Assay[J].Journal of Microbiological Methods,2003,54(2):177-182.
[11] Thiel J,Pakstis L,Buzby S,et al.Antibacterial Properties of Silver-doped Titania[J].Small,2007,3(5):799-803.
[12] Stoimenov PK,Klinger R,Marchin G L,et al.Metal Oxide Nanoparticles as Bactericidal Agents[J].Langmuir,2002,18 (17):6679-6686.

