細菌一種“新的分泌機制”初探
李澤鴻,彭其勝
(1.吉林農業大學生命科學學院,長春 130118;2.吉林大學畜牧獸醫學院,長春 130062)
革蘭氏陰性細菌中已發現四種蛋白質分泌途徑,稱為 I、II、III、IV 型分泌機制[1]。II和 IV 型是Sec系統依賴途徑(Sec基因編碼一些分泌途徑必需的Sec蛋白質,這些分泌途徑被稱為Sec依賴的分泌途徑)。蛋白質被這兩種分泌途徑運輸經過細胞膜前,有一個獨立的跨過內膜的步驟。II型和IV型分泌蛋白質的共同之處在于外排到周質時蛋白的氨基端上存在一個疏水信號序列。信號序列幫助蛋白質分泌,當分泌蛋白到達周質時會被信號肽酶剪切掉[2]。I型是 Sec非依賴途徑。與II型和IV型分泌途徑相比較,I型和III型分泌不依賴于Sec系統,所以不需要分泌蛋白的氨基端加工。I型和III型途徑的蛋白質分泌是一個連續的過程,不存在明顯的周質中間體[3-4]。
重組蛋白在大腸桿菌胞周質中分泌表達應屬于II型分泌機制[2],在重組蛋白的氨基端通常融合一段信號肽基因,當翻譯完成后,這條信號肽就會被大腸桿菌胞質中的信號肽酶切除,這是一條傳統的分子生物學基本原理。但是,本文在構建一種重組毒素DAB389(Gly4Ser)2-αMSH時,發現另一種原核胞周質分泌表達機制:在該重組蛋白的前面沒有信號肽基因,卻能在胞周質中分泌表達。為此將這種現象提出并做初步探討。
1 材料與方法
1.1 材料
1.1.1 菌株、質粒和細胞 質粒 pET28a(+)、pET20b(+)、Rosettablue(DE3)、BL21(DE3)pLysS購置于Novagen公司;pMD18T載體試劑盒購于大連寶生物公司;pET28a/DAB389(Gly4Ser)2-EGF質粒由軍事醫學科學院軍事獸醫研究所張國利博士惠贈;大腸桿菌JM105由吉林農業大學生命科學學院實驗室保存。
1.1.2 工具酶及試劑 限制性內切酶、T4 DNA連接酶、Taq DNA聚合酶、PCR產物回收試劑盒均購自大連TaKaRa公司。誘導劑IPTG購自Merck公司,蛋白質相對分子量標準購自上海生物化學研究所。Cu Chelating Sepharose Fast Flow親和層析設備及介質購自瑞典Pharmacia Biotech公司。抗白喉毒素陽性血清為本實驗室保存,辣根過氧化物酶(HRP)標記鼠抗馬IgG為Sigma產品;PCR引物、寡核苷核片段的合成及DNA測序由大連TaKaRa公司承擔。
1.1.3 PCR引物及寡核苷酸片段的設計 DAB389(Gly4Ser)2-αMSH上、下游引物分別為:

1.2 方法
1.2.1 DAB389(Gly4Ser)2- αMSH 基因片段的PCR擴增 94℃預變性4 min,擴增參數:94℃ 40 s,50℃ 50 s,72℃ 60 s,7 個循環,94℃ 40 s,60℃ 50 s,72℃ 60 s,30 個循環;72℃延伸 10 min。
1.2.2 表達載體的構建與鑒定 PCR產物純化后,置于 pMD18T載體,構建 pMD18T-DAB389(Gly4Ser)2-αMSH質粒,對質粒進行 Nco I和EcoR I雙酶切,得目的基因 DAB389(Gly4Ser)2-αMSH,與經同樣雙酶切的pET28a(+)載體連接,得到融合蛋白表達載體 pET28a-DAB389(Gly4Ser)2-αMSH,篩選陽性克隆后測序鑒定,對pET28a-DAB389(Gly4Ser)2-αMSH 進行 Nco I和EcoR I雙酶切,與經同樣雙酶切的載體 pET20b(+)連接,得融合蛋白表達載體pET20b-DAB389(Gly4Ser)2-αMSH,篩選陽性克隆后測序鑒定。
1.2.3 表達蛋白及 SDS-PAGE分析 分別將pET28a-DAB389(Gly4Ser)2-αMSH、pET20b-DAB389(Gly4Ser)2-αMSH轉化Rosettablue(DE3),用終濃度為1 mmol/L IPTG,37℃,3 h誘導表達。收集表達宿主菌,用10倍體積的蔗糖溶液(20%蔗糖,20 mmol/L Tris- Cl,2 mmol/L EDTA)懸浮菌體,4℃放置10 min,離心收集菌體,用4℃ 重蒸水懸浮菌體,4℃放置10 min,離心,取上清液SDSPAGE分析蛋白表達形式,然后收集表達宿主菌的原生質體,超聲波裂解后SDS-PAGE分析蛋白表達形式。
1.2.5 Cu Chelating Sepharose Fast Flow 親和層析純化目的蛋白 色譜柱填裝完成后,用起始緩沖液A平衡層析柱10~15個柱床,上樣,用起始緩沖液A洗脫流穿峰至基線平穩,以A(20 mmol/L Tris-Cl,0.5 mol/L NaCl,pH 7.5)→B(20 mmol/L Tris -Cl,0.5 mol/L NaCl,50 mmol/L 咪唑液,pH 7.5)進行梯度洗脫,洗脫流速為3 mL/min,時間90 min。收集各組分峰成分進行SDS-PAGE分析。
1.2.6 DAB389(Gly4Ser)2- αMSH 中的信號肽分析 將DAB389(Gly4Ser)2-αMSH一級結構輸入Technical University of Denmark 的 SignalP 3.0 Server,進行信號肽序列分析。
2 結果
2.1 目的基因DAB389(Gly4Ser)2-αMSH片段的PCR擴增 PCR擴增結果顯示:DAB389(Gly4Ser)2-αMSH基因片段為1278 bp,與預期的大小相符(圖1)。
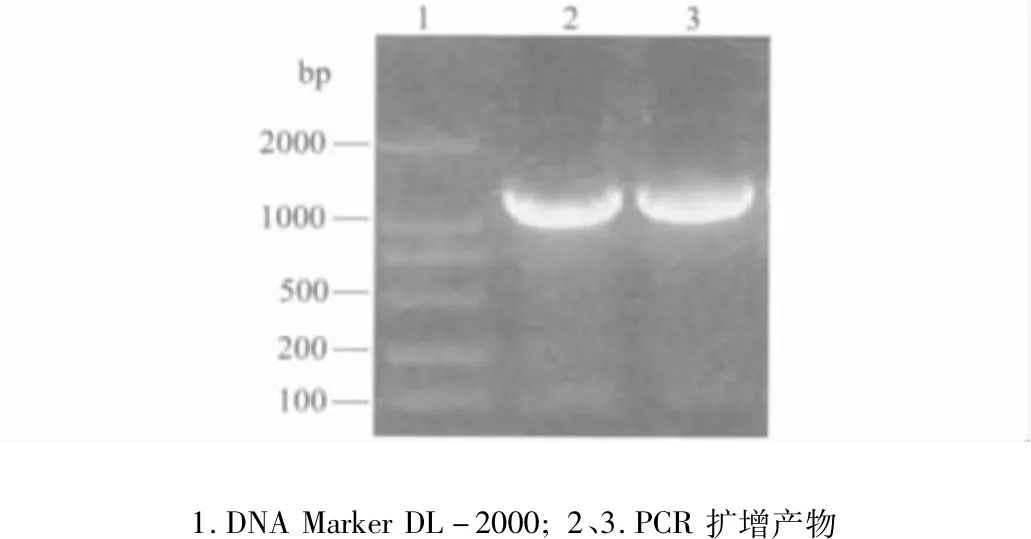
圖1 DAB389(Gly4Ser)2-αMSH基因的擴增結果
2.2 免疫毒素 DAB389(Gly4Ser)2-αMSH的兩種表達載體構建及鑒定 pET28a(+)和pET20b(+)同為Novagen的pET表達載體系列,后者帶有pelB leader信號肽,將PCR擴增產物插入載體pET28a(+)后,得 pET28a-DAB389(Gly4Ser)2-αMSH,經Nco I和EcoR I雙酶切后,插入相同酶切的pET20b(+)即可得到 pET20b-DAB389(Gly4Ser)2-αMSH表達載體。DNA測序證實兩種表達載體插入的目的基因無堿基突變和讀碼框轉移。
2.3 免疫毒素 DAB389(Gly4Ser)2-αMSH的表達與分析 兩種表達載體pET28a-DAB389(Gly4Ser)2-αMSH和pET20b-DAB389(Gly4Ser)2-αMSH分別轉化Rosetta(DE3)后,經誘導表達后,其中pET28a-DAB389(Gly4Ser)2-αMSH表達產物進行SDS-PAGE分析(圖2),在Mr 46 000有一條明顯的條帶,與預期值相符;表達宿主菌經過糖-水滲透溶脹后,取其上清進行SDS-PAGE。結果表明,免疫毒素DAB389(Gly4Ser)2-αMSH以分泌細菌周質形式表達;pET20b-DT389-MSH表達產物進行SDS-PAGE分析,結果表明,DAB389(Gly4Ser)2-αMSH不能表達。

圖2 表達產物的SDS-PAGE分析結果
2.4 Western印跡分析 pET28a-DAB389(Gly4Ser)2-αMSH在Rosetta(DE3)中的表達產物經Western印跡分析檢測,在對應于DAB389(Gly4Ser)2-αMSH處有明顯的蛋白雜交帶(圖3),說明產物為特異性蛋白。

圖3 Western-Blot鑒定結果
2.5 Cu Chelating Sepharose Fast Flow純化DAB389(Gly4Ser)2-αMSH 表達蛋白經55%硫酸銨鹽析后,脫鹽,然后經Cu Chelating Sepharose Fast Flow層析純化,分離的目的蛋白純度達到90.53%(圖4)。
心理學家在研究創新思維的培養問題時指出∶“學生的學習動機和求知欲,不會自然涌現,它取決于教師所創設的教學情況。”所以,教師必須經常地、有意識地為學生精心創設各種情景。
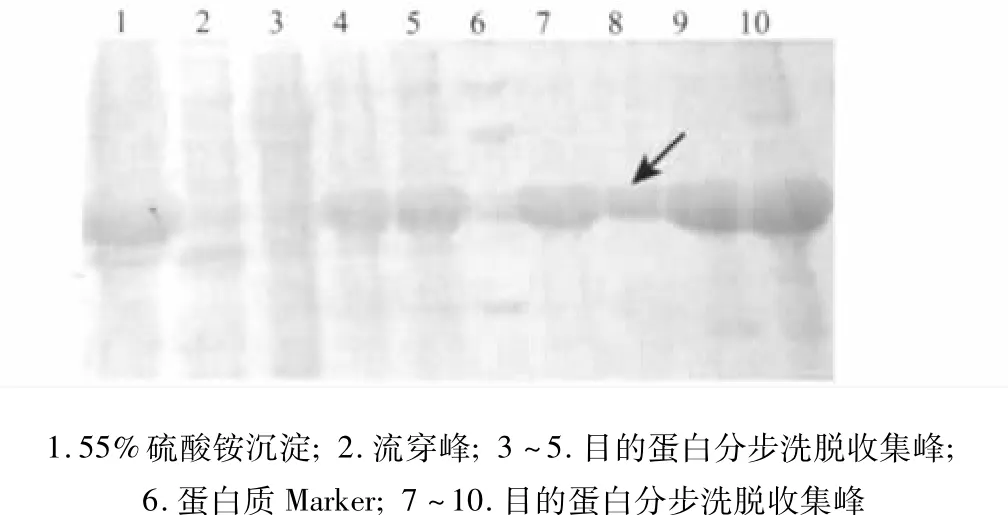
圖4 DAB389(Gly4Ser)2-αMSH蛋白經Cu Chelating Sepharose Fast Flow純化的結果
2.6 DAB389(Gly4Ser)2- αMSH 性質分析 通過SignalP 3.0 Server(Technical University of Denmark)分析DAB389(Gly4Ser)2-αMSH中的信號肽存在情況(圖5、表1),重組蛋白氨基端前70個氨基酸中不存在信號肽。
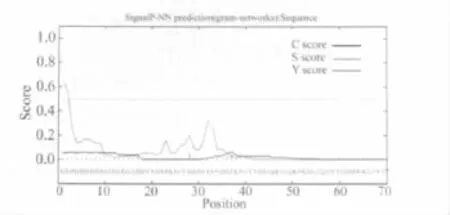
圖5 DAB389(Gly4Ser)2-αMSH中信號肽的預測分析結果
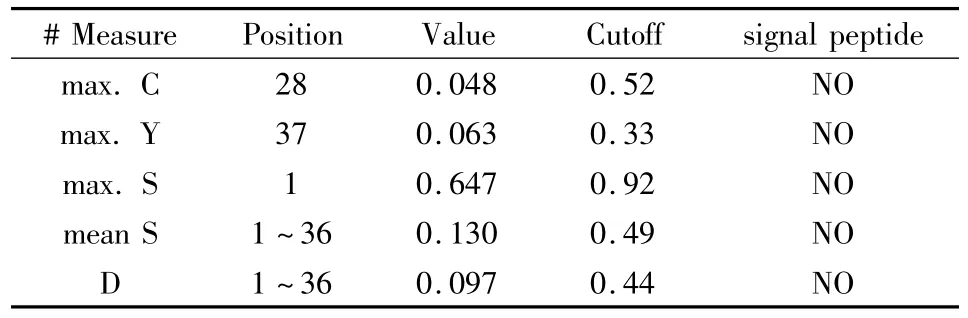
表1 DAB389(Gly4Ser)2-αMSH中信號肽的預測結果Sequence length=70
通過另一種信號肽軟件SignalP-HMM分析,結果也同樣顯示在DAB389(Gly4Ser)2-αMSH的氨基端不存在信號肽。
3 討論
在本實驗中,Rosetta(DE3)表達宿主菌經過糖-水滲透溶脹后,得原生質體[5]。SDS-PAGE分析其周質成分時,發現 DAB389(Gly4Ser)2-αMSH分泌在細菌的周質腔內,Western分析其表達蛋白也具有特異性,確系本文構建的重組蛋白。由于用于表達的質粒是pET28a,該質粒是一種胞內表達質粒,表達基因插入在質粒的Nco I和EcoR I之間,在起始密碼子(ATG)處根本不存在信號肽序列,而且通過Signal neural networks軟件(NN)分析重組蛋白的特性,發現 DAB389(Gly4Ser)2-αMSH的氨基端也不存在信號肽序列。將這種現象與革蘭氏陰性細菌中已發現的四種蛋白質分泌表達機制相比較,發現DAB389(Gly4Ser)2-αMSH分泌表達雖然與II、IV型分泌機制類似[4],都是將蛋白分泌到細菌的周質腔中,但是由于 DAB389(Gly4Ser)2-αMSH的氨基端不含有信號肽,因此這種分泌機制不應屬于II、IV型;I型和III型途徑的蛋白質分泌是一個連續的過程,不存在明顯的周質中間體,不依賴于Sec系統,因此這種分泌機制也不應屬于 I、III型[2-3],因此本文推測在革蘭氏陰性細菌中可能還存在另一種蛋白質分泌機制。
白喉棒狀桿菌毒素(Diphtheria toxin,DT)系白喉桿菌分泌胞外的蛋白質,由β-棒狀桿菌噬菌體所攜帶的tox基因整合于染色體而編碼的。基因全長為2 200 bp,其中301~375 bp為信號肽基因,376~1980 bp編碼白喉毒素,從其基因特點和編碼蛋白質性質來看,它屬于I型分泌系統,蛋白完成轉膜后,信號肽酶會將其自動切除[6]。本文構建的免疫毒素DAB389(Gly4Ser)2-αMSH中的毒素部分DAB389為DT中除去受體結合區后所剩的成熟肽部分,不含信號肽。本實驗表明,在免疫毒素前面置入功能較強的信號肽pelB后,在大腸桿菌中反而不表達 DAB389(Gly4Ser)2-αMSH,對這種現象學者們早有解釋:并不是在重組蛋白前加入信號肽就能導致其分泌表達,它只是一個必要條件,要分泌表達還與其他因素有關。例如,氨基端前20~30個氨基酸的疏水性、正電荷的分布及宿主菌的性質等影響蛋白的分泌表達[7-8]。但對于 DAB389(Gly4Ser)2-αMSH在胞內表達質粒中分泌表達這種現象至今尚無人涉及,作者認為:可能在DAB389(Gly4Ser)2-αMSH的氨基端含有類似信號肽功能的序列,在蛋白表達中起信號肽的作用,引導蛋白進入細菌周質腔內;而且,這條類似信號肽的序列在轉膜完成后不被切除,因為從目前銅離子親和層析純化結果來看,DAB389(Gly4Ser)2-αMSH前引入的His·Tag序列并未被切除,如果被切除,純化的效果不會如此明顯。
總之,無論上述解釋和推測正確與否,但是本實驗發現的這種現象很有意義,以期引起學者們的思考。
參教文獻:
[1]王 健,趙立平.細菌Ⅲ型分泌系統[J].生命的化學,2001,21(2):147-149.
[2]Kakizawa S,Oshima K,Nishigawa H,et al.Secretion of Immunodominant Membrane Protein from Onion Yellows Phytoplasma through the Sec Protein-translocation System in Escherichia coli[J].Microbiology,2004,150:135 -142.
[3]Holland I B,Schmitt L,Young J.Type 1 Protein Secretion in Bacteria,the ABC -transporter Dependent Pathway(Review)[J].Mol Membr Biol,2005,22(1/2):29 -39.
[4]Stuber K,Frey J,Burnens A P,et al.Detection of Type III Secretion Genes as a General Indicator of Bacterial Virulence[J].Mol Cell Probes,2003,17(1):25 -32.
[5]Lavely W C,Scarfone C,Cevikalp H,et al.Phantom Validation of Coregistration of pET and CT for Image-guided Radiotherapy[J].Med Phys,2004,31(5):1083 -1092.
[6]Kaczorek M,Delpeyroux F,Chenciner N,et al.Nucleotide Sequence and Expression of the Diphtheria Toxin 228 Gene in Escherichia coli[J].Science,1983,221(4613):855 -858.
[7]Engelman D M,Steitz T A.The Spontaneous Insertion of Protein into and across Membranes:the Helical Hairpin Hydrothesis[J].Cell,1981,23(2):411 -422.
[8]Davis N G,Model P.An Artificial Anchor Domain:Hydrophobicity Suffices to Stop Transfer[J].Cell,1985,41:607 -614.

