梓醇改善東莨菪堿誘導的學習記憶障礙及機制研究
王紅利,薛莉君,萬 東,祝慧鳳,徐曉玉
(1.西南大學藥學院暨中醫藥學院,重慶 400715;2.重慶市藥效評價工程技術中心,重慶 400715;3.重慶醫科大學附屬第一醫院,重慶 400016)
梓醇是滋陰補髓中藥地黃的主要活性成分之一,具有神經保護、抗炎、利尿、降血糖、抗癌、以及抗肝炎病毒等藥理作用[1-2]。前期研究發現梓醇具有明顯的腦保護效應,促進中風大鼠神經功能恢復,促進軸突生長蛋白GAP43表達[3],有利于缺血性中風后神經血管結構和功能的重塑[4]。課題組在觀察梓醇對中風大鼠神經行為學功能的影響,用殘肢抓取食物的實驗時發現:食物所放位置是相對固定的[5],梓醇治療組中風大鼠最先找到食物。基于以上的實驗發現,本實驗通過腹腔注射丁溴東莨菪堿復制記憶障礙模型[6],選用 Morris 水迷宮[7-8]來測試梓醇對東莨菪堿所致學習記憶障礙的影響,并采用ELISA定量檢測大腦ACh和BDNF的含量,以期闡明其可能的作用機制,為梓醇治療中風、記憶障礙等相關疾病提供實驗依據。
1 材料與方法
1.1動物與分組昆明種小鼠70只,♀♂各半,體質量22~28 g,購自重慶醫科大學實驗動物中心(合格證號:檢動字2002A040)。經訓練3 d,篩選出逃避潛伏期無差異小鼠56只,選取40只,♀♂各半,隨機分為4組:正常組、模型組(東莨菪堿,2 mg·kg-1)、奧拉西坦組(陽性藥物、105 mg·kg-1)和梓醇治療組(9 mg·kg-1),每組10只。
1.2藥物和試劑梓醇(購自石家莊流波百鳥生物技術有限公司),奧拉西坦(廣東世信藥業有限公司,規格5 ml:1.0 g,批號1001024),丁溴東莨菪堿(購自海南雙成藥業有限公司,規格20 mg,批號20090211),ACh(CK-E20536M)和 BDNF(CKE20084M)含量ELISA試劑盒均購自美國Rapidbio(RB)公司。
1.3主要儀器Morris水迷宮儀(成都泰盟科技有限公司),EL-204電子天平(梅特勒-托利多儀器有限公司),H1650-W臺式微量高速離心機(長沙湘儀離心機儀器有限公司),勻漿機(寧波新芝生物科技股份有限公司),722型紫外可見分光光度計(上海菁華科技儀器有限公司),550型全自動酶標儀(美國BioRad公司)。
1.4藥物干預70小鼠連續3 d進行Morris水迷宮訓練與測試,淘汰逃避潛伏期有明顯差異的小鼠后,從中選取40只隨機分為4組(n=10):正常組、模型組(丁溴東莨菪堿)、奧拉西坦組(105 mg·kg-1)、梓醇治療組(9 mg·kg-1)。所用藥物均用生理鹽水稀釋,給藥劑量換算為10 ml·kg-1,均采用尾靜脈注射給藥,除模型組注射生理鹽水外,其余兩組分別同時注射奧拉西坦105 mg·kg-1,梓醇9 mg·kg-1,每日1 次,連續 3 d。
1.5水迷宮記憶訓練與測試測試之前,除正常組腹腔注射生理鹽水外,其余各組小鼠均腹腔注射丁溴東莨菪堿,造成小鼠記憶障礙模型[6],然后進行水迷宮測試。Morris水迷宮由圓形水池和自動錄像及分析系統兩部分組成。圓形水池(直徑80 cm,高30 cm)加水后用黑墨水滴成黑色使水不透明,且將迷宮均分為4個象限,水溫保持在25℃左右。另有一個黑色圓形平臺(直徑10 cm,高28 cm),置于某一個象限中央,位于水面下1~2 cm左右。測試時,選擇象限作為入水點,將小鼠面向池壁放入水中,根據水迷宮跟蹤系統記錄動物尋找并爬上平臺所需時間,即逃避潛伏期(escape latency),120 s內未找到平臺則將動物引至平臺,逃避潛伏期記為120 s。實驗進行3 d,每只小鼠每天訓練4次(包括4個象限入水點),且將小鼠引至平臺后在平臺上停留10 s。
1.6ELISA檢測腦ACh和BDNF含量水迷宮測試結束后,將各組小鼠快速斷頭取腦,于冰盤上分離大腦皮質和海馬,精確稱重,將皮質與海馬用生理鹽水按 1 ∶9 比例制成冰浴勻漿[10],4 000 r·min-1,4℃離心10 min,取上清液作為待測樣品備用。按照ELISA試劑盒說明書實驗步驟測定ACh和BDNF含量。
1.7統計學處理數據采用±s表示,采用SPSS11.0統計軟件進行分析。各組間逃避潛伏期采用方差分析。
2 結果
2.1梓醇改善東莨菪堿誘導的記憶障礙Morris水迷宮實驗結果,與正常組相比,各組使用2 mg·kg-1東莨菪堿后,小鼠的潛伏期明顯延長(104.85± 32.13vs88.9 ± 21.47,P<0.05),表明 2 mg·kg-1東莨菪堿成功復制小鼠學習記憶障礙;經藥物治療后,梓醇組和奧拉西坦組均明顯縮短小鼠的逃避潛伏期(104.85±32.13vs73.12 ±21.13vs87.24±25.35,P<0.05),但與正常組比較差異無顯著性(P>0.05);梓醇組與奧拉西坦組比較,小鼠的逃避潛伏期差異無顯著性(P>0.05)。實驗結果如Fig 1。
2.2梓醇對小鼠大腦(皮質與海馬)腦源性神經元營養因子(BDNF)和乙酰膽堿(ACh)水平的影響與模型組相比,梓醇組小鼠大腦皮質和海馬BDNF含量明顯增加(304.12±49.01vs230.1±35.76,P<0.01);梓醇組小鼠大腦皮質和海馬ACh含量明顯增加(570 ±59.18vs446.6 ±32.18,P<0.01)。梓醇組和奧拉西坦組小鼠大腦皮質和海馬BDNF及ACh含量均超過正常組,梓醇組和奧拉西坦組ACh含量和BDNF含量組間比較差異無顯著性(P>0.05),表明梓醇與奧拉西坦具有相似的改善學習記憶機制。
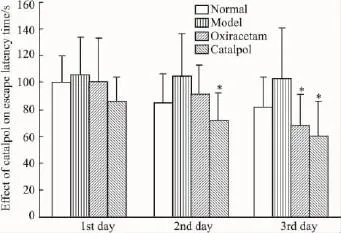
Fig1 Effects of catalpol on escape latency in amnesia mice evaluated by Morris water maze test
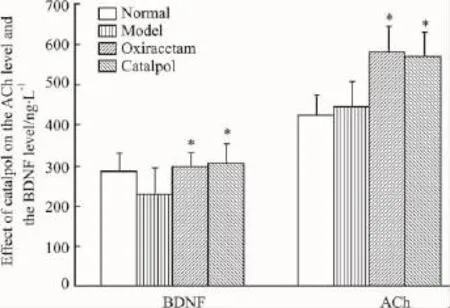
Fig 2 Effects of catalpol on ACh and BDNF of hippocampus and cortex in amnesia mice induced by scopolamine
2.3BDNF和ACh相關性分析如 Fig 3,BDNF與ACh的含量可能有相關性(r=0.61,P<0.05),表明梓醇有改善丁溴東莨菪堿誘導的學習和記憶機能障礙,其促進BDNF的表達與膽堿能系統尤其是ACh含量相關,BDNF與ACh有密切的聯系。
3 討論
學習記憶能力的優劣直接影響很多疾病的康復過程。中風、癡呆等老年疾病常常伴有學習記憶能力的下降。中風后患者學習記憶能力的增強有利于患者語言、肢體精細感覺運動的學習和功能恢復,同時癡呆患者學習記憶能力的改善也明顯提高患者生活質量,因此尋找到既能有利于中風等疾病的治療,同時又能夠促進學習記憶的有效藥物,將是醫藥學界一大幸事。
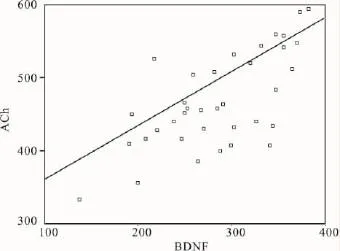
Fig 3 Correlation between ACh and BDNF(r=0.61,P <0.05)
學習和記憶機制涉及復雜的神經生理和生化機制,尤其是膽堿能系統與學習記憶關系密切[9-10]。大腦有諸多機制用于記憶存儲,而ACh水平是這一過程的關鍵因素[11]。研究表明腦部釋放的神經遞質——ACh的多少決定了記憶的細節程度[11]。高水平的ACh能幫助大腦記憶更多細節。梓醇提高大腦皮質和海馬ACh含量,至少表明梓醇改善學習記憶影響了乙酰膽堿能系統,梓醇提高腦ACh濃度可能有利于細節記憶,將對記憶類疾病的治療帶來影響。
腦源性神經營養因子(BDNF)是神經營養因子家族中的重要成員,富集于大腦皮質和海馬等區域,也是記憶形成過程中的關鍵蛋白之一。越來越多的研究證實:BDNF是在記憶形成過程中的關鍵蛋白[12-14]。老年疾病如老年性癡呆癥與帕金森綜合癥[15-16],患者大腦皮質海馬BDNF蛋白質及其受體TrkB的合成和分泌均明顯減少。研究表明BDNF及其受體參與海馬學習記憶的過程:①BDNF通過基底前腦膽堿能系統調節學習記憶:BDNF可以通過其受體Trk-B促進ACh的釋放,同時受PKC信號通路的調控[17-20],參與神經突觸可塑性調節,影響學習記憶過程;②BDNF通過調節突觸傳遞易化長時程增強(LTP)。而且一定劑量的BDNF有助于克服恐懼,消除痛苦記憶[15-16],將有助于疾病如中風后良性記憶的恢復,對心理的良性作用是不言而喻的。本研究結果表明梓醇促進大腦皮質和海馬BDNF的分泌,可能會通過其受體TrkB調節ACh合成、分泌和釋放,從而改善學習記憶障礙小鼠學習記憶能力。從BDNF與ACh兩參數相關性分析結果看,梓醇促進BDNF與ACh分泌具有較為明顯的相關性,更進一步證實了上述推測。
目前的文獻支持梓醇是一種神經血管單元保護劑,不僅治療中風疾病[4,21],而且對于多種老年疾病[22-24]、神經退行性疾病都具有治療潛能,因此具有重要的研究和開發價值。本研究初步證實了梓醇提高了學習記憶障礙模型小鼠大腦ACh和BDNF的濃度,且二者具有良好的相關性,但梓醇影響ACh合成、分泌、代謝通路的具體環節還不清楚,這將是課題組下一步探討的課題。
[1]祝慧鳳,萬 東,張 芬.地黃梓醇腦保護的藥理作用及機制研究進展[J].中國中藥雜志,2009,34(23):2983-6.
[1]Zhu H F,Wan D,Zhang F.Progress in studies of pharmacological action and mechanisms of catalpol on brain diease[J].Chin Pharm J,2009,34(23):2983-6.
[2]Zhang R X,Li M X,Jia Z P.Rehmannia glutinosa:review of botany,chemistry and pharmacology[J].J Ethnopharmacol,2008,117(2):199-214.
[3]祝慧鳳,萬 東,羅 勇.梓醇上調GAP-43表達伴隨局灶腦缺血大鼠神經功能恢復[J].中國藥理學通報,2007,23(9):1231-6.
[3]Zhu H F,Wan D,Luo Y.Catalpol up-regulated GAP-43 protein expression and improved behavior outcome of focal cerebral ischemia rats[J].Chin Pharmacol Bull,2007,23(9):1231-6.
[4]Zhu H F,Wan D,Luo Y,et al.Catalpol increases brain angiogenesis and upregulates VEGF and EPO in the rat after permanent middle cerebral artery occlusion[J].Int J Biol Sci,2010,6(5):443-53.
[5]周佳麗,祝慧鳳,萬 東,等.“抓取測試盒”對局灶腦缺血大鼠前肢功能的評價[J].中國藥理學通報,2008,24(11):1531-3.
[5]Zhou J L,Zhu H F,Wan D,et al.Evaluation of“grasping test box”on the forelimb function of focal cerebral ischemia rats[J].Chin Pharmacol Bull,2008,24(11):1531-3.
[6]Flood J F,Cherkin A.Scopolamine effects on memory retention in mice:a model of dementia[J]?Behav Neural Biol,1986,45(2):169-84.
[7]Morris R G,Garrud P,Rawlins J N,O'Keefe J.Place navigation impaired in rats with hippocampal lesions[J].Nature,1982,297(5868):681-3.
[8]Terry A V Jr.Spatial Navigation(Water Maze)Tasks[M]//Buccafusco J J,editor.Methods of behavior analysis in neuroscience.2 nd edition.Boca Raton(FL):CRC Press.2009.Chapter 13.
[9]Weinberger N M,Miasnikov A A,Chen J C.The level of cholinergic nucleus basalis activation controls the specificity of auditory associative memory[J].Neurobiol Learn Mem,2006,86(3):270-85.
[10]Weinberger N M.The nucleus basalis and memory codes:auditory cortical plasticity and the induction of specific,associative behav-ioral memory[J].Neurobiol Learn Mem,2003,80(3):268-84.
[11]Weinberger N M,Miasnikov A A,Chen J C.Sensory memory consolidation observed:increased specificity of detail over days[J].Neurobiol Learn Mem,2009,91(3):273-86.
[12]Barnes P,Thomas K L.Proteolysis of proBDNF is a key regulator in the formation of memory[J].PLoS One,2008,3(9):e3248.
[13]Pang P T,Lu B.Regulation of late-phase LTP and long-term memory in normal and aging hippocampus:role of secreted proteins tPA and BDNF[J].Ageing Res Rev,2004,3(4):407-30.
[14]Pang P T,Teng H K,Zaitsev E,et al.Cleavage of proBDNF by tPA/plasmin is essential for long-term hippocampal plasticity[J].Science,2004,306(5695):487-91.
[15]Kirtley A,Thomas K L.The exclusive induction of extinction is gated by BDNF[J].Learn Mem,2010,17(12):612-9.
[16]Peters J,Dieppa-Perea L M,Melendez L M,Quirk G J.Induction of fear extinction with hippocampal-infralimbic BDNF[J].Science,2010,328(5983):1288-90.
[17]Peng H B,Yang J F,Dai Z,et al.Differential effects of neurotrophins and schwann cell-derived signals on neuronal survival/growth and synaptogenesis[J].J Neurosci,2003,23(12):5050-60.
[18]Knipper M,da Penha Berzaghi M,Bl?chl A,et al.Positive feedback between acetylcholine and the neurotrophins nerve growth factor and brain-derived neurotrophic factor in the rat hippocampus[J].Eur J Neurosci,1994,6(4):668-71.
[19]Garcia N,Tomàs M,Santafé M M,et al.The interaction between tropomyosin-related kinase B receptors and presynaptic muscarinic receptors modulates transmitter release in adult rodent motor nerve terminals[J].J Neurosci,2010,30(49):16514-22.
[20]Garcia N,Santafé M M,Tomàs M,et al.Involvement of brain-derived neurotrophic factor(BDNF)in the functional elimination of synaptic contacts at polyinnervated neuromuscular synapses during development[J].J Neurosci Res,2010,88(7):1406-19.
[21]Li D Q,Bao Y M,Li Y,et al.Catalpol modulates the expressions of Bcl-2 and Bax and attenuates apoptosis in gerbils after ischemic injury[J].Brain Res,2006,1115(1):179-85.
[22]Liu J,He Q J,Zou W,et al.Catalpol increases hippocampal neuroplasticity and up-regulates PKC and BDNF in the aged rats[J].Brain Res,2006,1123(1):68-79.
[23]Xu G,Xiong Z,Yong Y,et al.Catalpol attenuates MPTP induced neuronal degeneration of nigral-striatal dopaminergic pathway in mice through elevating glial cell derived neurotrophic factor in striatum[J].Neuroscience,2010,167(1):174-84.
[24]張自強,劉玉梅,薛幫群,位 蘭.梓醇對過氧化氫誘導的星形膠質細胞氧化損傷的保護作用[J].中國中藥雜志,2009,34(15):1955-8.
[24]Zhang Z Q,Liu Y M,Xue B Q,Wei L.Protective effects of catalpol against H2O2-induced oxidative damage in astrocytes[J].Chin Pharm J,2009,34(15):1955-8.

