卡托普利對MC3T3-E1細胞增殖、分化及Ⅰ型膠原mRNA表達的影響
劉鈺瑜,姚衛民,徐道華,崔 燎
卡托普利(captopril,CPT)屬于血管緊張素Ⅰ轉換酶抑制藥,通過作用于腎素—血管緊張素—醛固酮(renin-angiotensin aldosterone system,RAAS)系統,阻斷血管緊張素Ⅱ的強烈縮血管作用而抗高血壓。RAAS在心血管疾病與骨質疏松之間可能存在著相關聯的分子機制。體內外實驗發現CPT具有抗骨質疏松作用,可增加維甲酸性骨質疏松小鼠股骨的骨鈣和骨羥脯氨酸的含量,對去卵巢大鼠的生物力學性能有改善作用,也有促進成骨細胞分化的作用[1-2],但目前關于ACEI能否用于骨質疏松的防治尚無定論。本實驗通過體外細胞培養,觀察CPT對成骨細胞樣細胞增殖、分化和Ⅰ型膠原mRNA表達的作用,為探討CPT的防治骨質疏松作用提供進一步體外實驗依據。
1 材料與方法
1.1 試劑和儀器 DMEM培養基(Gibco公司);胰蛋白酶、MTT、前列腺素E2(Sigma公司);卡托普利標準品(ALEXIS公司);堿性磷酸酶檢測試劑盒(北京中生生物公司)、Access RT-PCR試劑盒(Invitrogen公司)。NAPCO二氧化碳恒溫培養箱(5420-1,Precision Scientific美國);XD-101倒置相差顯微鏡(江南光電股份有限公司);酶標儀:Bio-ELX-800型,USA;9600Gen Amp PCR System(美國PE公司);DYY-5型穩壓穩流電泳儀,WD-9403C型紫外分析儀(北京六一儀器廠)。RT-PCR選用β-肌動蛋白(β-actin)為內參照,引物由上海生物工程公司合成,序列見Tab 1。
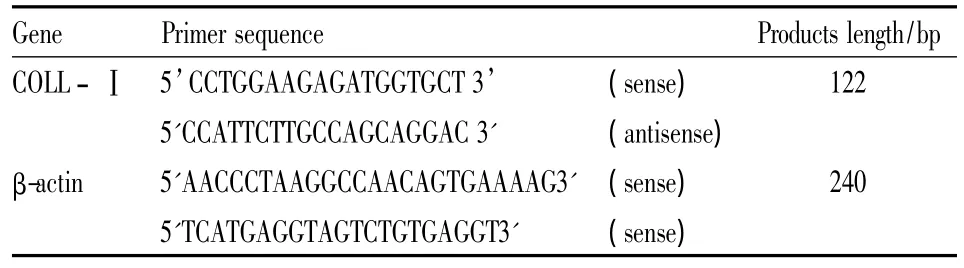
Tab 1 Primer sequence of COLL-Ⅰand β-actin
1.2 方法
1.2.1 MTT法測定MC3T3-E1細胞的增殖 細胞以2×104/cm2的密度接種入96孔板,第一孔為空白調零。細胞接種24h后加入不同濃度的卡托普利,使終濃度分別是:10-12、10-11、10-10mol·L-1;陽性對照組用前列腺素E2(終濃度是10-7mol·L-1);同時以溶劑作為對照組。于加藥后12、24、36 h進行檢測,實驗結束前4 h加20 μl的MTT(5 g·L-1),繼續在37℃,5%CO2條件下孵育4 h,吸取培養液后加二甲基亞砜0.15 ml,振搖至結晶完全溶解,于酶標儀檢測其吸光度,檢測波長570 nm,參考波長630 nm。
1.2.2 PNPP法測定MC3T3-E1細胞堿性磷酸酶(ALP)活性 細胞接種24 h后加藥,加藥方法同前。于藥物作用d 3、d 5、d 7測定細胞堿性磷酸酶含量。測定時,去掉培養液,PBS沖洗,然后加入堿性磷酸酶檢測試劑盒中新鮮配制的底物100 μl,37℃放置0.5 h,然后用0.1 mol·L-1的 NaOH 100 μl終止反應,在酶標儀于405 nm波長下測定OD值。樣品OD值在ALP標準曲線上讀取酶活性值(U·L-1)。
1.2.3 逆轉錄聚合酶鏈反應(RT-PCR)測定Ⅰ型膠原mRNA的表達 細胞按2×104·cm-2接種于6孔板,24 h后加入不同濃度的藥物,卡托普利的終濃度為 10-13、10-12、10-11、10-10mol·L-1,前列腺素E2的終濃度是10-7mol·L-1。培養7 d后,按照TRIzol試劑盒說明進行總RNA的抽提。反應條件為50℃逆轉錄30 min,94℃預變性2 min,94℃變性30 s,54℃退火 30 s,70℃延伸 45 s,35 個循環,最后一個循環72℃延伸8 min。PCR產物于2%瓊脂糖凝膠電泳,溴化乙錠染色,紫外燈下觀察并拍照。以Bandscan程序對圖片行總灰度掃描,與對應的β-actin的電泳帶總灰度的比值為半定量結果(相對值)。1.3統計學處理 計量資料以±s表示。SPSS11.0軟件行方差分析并進行Bonferroni組間比較。
2 結果
2.1 卡托普利對MC3T3-E1細胞增殖的影響 用不含血清的培養液培養細胞,隨著培養時間的延長,各組細胞數目逐漸下降。與對照組相比,在24 h,卡托普利10-12和10-11mol·L-12個濃度可促進細胞的增殖。在36 h,卡托普利10-12和10-11mol·L-1濃度仍可促進細胞的增殖,但作用不如24 h明顯。與對照組相比,前列腺素E2在用藥后36 h對細胞增殖有明顯的促進作用。見Tab 2。
Tab 2 Effects of captopril on cell growth in MC3T3-E1 cells(±s,n=8)

Tab 2 Effects of captopril on cell growth in MC3T3-E1 cells(±s,n=8)
*P <0.05,**P <0.01 vs control
Group 12 h 24 h 36 h Control 0.197±0.023 0.130±0.008 0.116±0.017 PGE210-7mol·L-1 0.218±0.017 0.159±0.009 0.169±0.015**Captopril 10-12mol·L-1 0.196±0.016 0.171±0.013** 0.148±0.014*Captopril 10-11mol·L-1 0.220±0.018 0.201±0.018** 0.172±0.019**Captopril 10-10mol·L-10.201±0.015 0.161±0.019 0.128±0.019
2.2 卡托普利對 MC3T3-E1細胞堿性磷酸酶(ALP)活性的影響 用含1%胎牛血清的培養液培養細胞隨著培養時間的延長,各組細胞ALP含量逐漸增高,在d 5時達最高值,隨后下降。與對照組相比,卡托普利在d 3和d 5能提高細胞堿性磷酸酶活性。在d 3,卡托普利10-11和10-10mol·L-1兩個濃度可提高細胞堿性磷酸酶活性。在d 5,卡托普利10-11mol·L-1濃度仍可提高成骨細胞堿性磷酸酶活性,但作用不如3 d時明顯。與對照組相比,前列腺素E2在d 3至d 5對細胞堿性磷酸酶活性均有明顯的提高作用,見Tab 3。
2.3 卡托普利對MC3T3-E1細胞Ⅰ型膠原(Type I Collagen,COLL-Ⅰ)基因表達水平的影響 與對照組相比,加藥后7 d,10-7mol·L-1前列腺素和10-12mol·L-1~10-10mol·L-1濃度的卡托普利可促進MC3T3-E1細胞表達COLL-Ⅰ,其中10-11mol·L-1濃度的卡托普利有較強的促進COLL-Ⅰ表達的作用,但是該作用較陽性藥物前列腺素弱,見Fig 1。
Tab 3 Effects of captopril on the ALP activities(U·L-1)in MC3T3-E1 cells(±s,n=8)
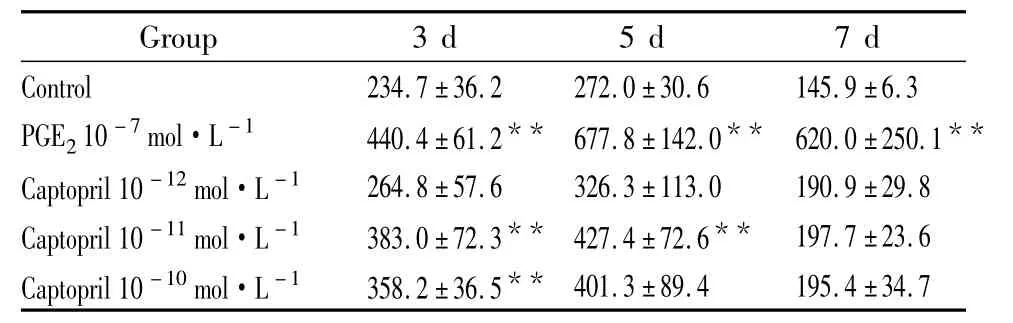
Tab 3 Effects of captopril on the ALP activities(U·L-1)in MC3T3-E1 cells(±s,n=8)
**P<0.01 vs control
Group 3 d 5 d 7 d Control 234.7±36.2 272.0±30.6 145.9±6.3 PGE210-7mol·L-1 440.4±61.2** 677.8±142.0** 620.0±250.1**Captopril 10-12mol·L-1 264.8±57.6 326.3±113.0 190.9±29.8 Captopril 10-11mol·L-1 383.0±72.3** 427.4±72.6** 197.7±23.6 Captopril 10-10mol·L-1 358.2±36.5**401.3±89.4 195.4±34.7

Fig 1 Effects of captopril on the COLL-ⅠmRNA expression in MC3T3-E1 cells
3 討論
目前研究表明高血壓與骨質疏松密切相關,很多心血管疾病的患者,往往同時伴有骨質疏松,所以我們在使用心血管系統藥物治療這些人群心血管疾病的同時,須注意到藥物對骨量的影響。在臨床用藥中也發現很多作用于心血管系統的藥物有改變骨量的作用,并影響到病人骨折的發生率。RAAS在心血管疾病與骨質疏松之間可能存在著相關聯的分子機制。在轉基因小鼠實驗看到,表達人類腎素基因的小鼠腎素高表達后,小鼠血壓正常,但是由于RAAS的激活,導致骨量減少,所以認為該系統對骨骼系統的影響,導致骨質疏松的發生甚至可不依賴于高血壓的發生而獨立出現[3]。體內實驗證實成骨細胞和破骨細胞都可以合成和表達血管緊張素轉化酶、血管緊張素受體等RAAS的各組分[4],雖然骨骼系統局部的RAAS對骨量的影響還沒有完全闡明[5],但體外實驗已經證實血管緊張素Ⅱ可以抑制成骨細胞的分化和骨形成[6]。目前一般認為RAAS可調節骨吸收,血管緊張素Ⅰ和血管緊張素Ⅱ被認為是強烈的骨吸收促進劑,一些血管緊張素轉化酶抑制藥通過減少血管緊張素Ⅱ的生成減少骨吸收,而且體外實驗研究表明這類藥物抑制骨吸收的作用并不是直接地抑制破骨細胞,而是通過作用于成骨細胞,從而發揮抑制破骨細胞作用的[7]。體內實驗中我們發現血管緊張素轉化酶抑制藥卡托普利(5 mg·kg-1·d-1)能改善老年去卵巢大鼠的生物力學性能[1],卡托普利(6.25 mg·kg-1·d-1)可增加維甲酸性骨質疏松小鼠股骨的骨鈣和骨羥脯氨酸的含量[2]。為進一步探討卡托普利的促成骨作用,本實驗觀察卡托普利對成骨樣細胞的作用,并與陽性藥物前列腺素E2進行比較。成骨細胞(osteoblast)是骨形成過程中最重要的功能細胞,它不僅分泌骨基質參與成骨,同時也參與破骨細胞骨吸收功能的調節,因此在骨代謝過程中起著極為重要的作用。結果顯示前列腺素E2可促進MC3T3-E1細胞增殖,前列腺素E2是一個已被公認的促進成骨細胞增殖的工具藥[8],可通過激活蛋白酶 C,促進 DNA合成[9]。卡托普利有類似前列腺素E2的促進MC3T3-E1細胞增殖的作用,成骨細胞數量的不斷增加可以產生豐富的膠原,從而通過鈣化基質的形成產生更多的骨組織。卡托普利除刺激細胞增殖外,還可促進堿性磷酸酶的表達。堿性磷酸酶的表達是成骨細胞分化的主要特征之一,是成熟成骨細胞的標志,其活性的高低可反映成骨細胞的成熟狀況,還在新骨形成中發揮著鈣結合蛋白的作用。卡托普利可促進細胞表達堿性磷酸酶,說明其有促進成骨細胞分化的作用。前列腺素E2也有很強的促進堿性磷酸酶表達的作用。有研究表明低濃度的前列腺素E2可通過促進cAMP的合成提高ALP的活性[10]。卡托普利對成骨細胞Ⅰ型膠原基因的表達有促進作用,Ⅰ型膠原蛋白是成骨細胞分化的特征之一,是構成骨骼有機基質的主要成分,占骨有機基質90%以上,Ⅰ型膠原在成骨細胞增殖早期已經開始表達,并隨著基質成熟而逐漸增加,其表達與骨形成活性密切相關。在礦化期大量形成的Ⅰ型膠原可作為羥基磷灰石結晶的異質晶核,在生物礦化中起一定作用,從而維持骨組織的完整和強度。有研究表明前列腺素E2對膠原合成有促進作用[11],本實驗用前列腺素E2作為陽性藥也證實了這點,同時提示卡托普利對Ⅰ型膠原基因表達也有促進作用,但比前列腺素E2弱。
綜上所述,本實驗初步證實卡托普利有促進成骨細胞樣細胞增殖、分化和促進Ⅰ型膠原基因表達,為卡托普利用于骨質疏松的防治提供體外實驗的依據。
[1]Liu Y Y,Yao W M,Wu T,et al.Captopril improves osteopenia in ovariectomized rats and promotes bone formation in osteoblasts[J].J Bone Miner Metab,2011,29(2):149-58.
[2]陳 方,吳 鐵,崔 燎,等.卡托普利抗小鼠維甲酸性骨質疏松的作用探討[J].中國藥理學通報,2002,18(5):572-575.
[2]Chen F,Wu T,Cui L,et al.A study on captopril antagonized osteoporosis induced by retinoic acid in mice and its dose-response effects[J].Chin Pharmacol Bull,2002,18(5):572-5.
[3]Asaba Y,Ito M,Fumoto T,et al.Activation of renin-angiotensin system induces osteoporosis independently of hypertension[J].J Bone Miner Res,2009,24(2):241-50.
[4]Izu Y,Mizoguchi F,Kawamata A,et al.AngiotensinⅡtype 2 receptor blockade increases bone mass[J].J Biol Chem,2009,284(8):4857-64.
[5]Nakagami H,Osako M K,Shimizu H,et al.Potential contribution of action of renin angiotensin system to bone metabolism[J].Curr Hypertens Rev,2007,3(2):129-32.
[6]Schurman S J,Bergstrom W H,Shoemaker L R,et al.AngiotensinⅡreduces calcium uptake into bone[J].Pediatr Nephrol,2004,19(1):33-5.
[7]Hatton R,Stimpel M,Chambers T J.Angiotensin Ⅱ is generated from angiotensin I by bone cells and stimulates osteoclastic bone resorption in vitro[J].J Endocrinol,1997,152(1):5-10.
[8]Tang L Y,Kimmel D B,Jee W S,et al.Functional characterization of prostaglandin E2inducible osteogenic colony forming units in cultures of cells isolated from the neonatal rat calvarium[J].J Celllul Physiol,1996,166(1):76-83
[9]Chyun Y S,Raisz L G.Stimulation of bone formation by prostaglandin E2[J].Prostaglandins,1984,27(1):97-103.
[10]Hakeda Y,Nakatani Y,Hiramatsu M,et al.Inductive effects of prostaglandins on alkaline phosphatase in osteoblastic cells,clone MC3T3-E1[J].J Biochem(Tokyo),1985,97(1):97-104.
[11]Raisz L G,Fall P M,Gabbitas B Y,et al.Effects of prostaglandin E2on bone formation in cultured fetal rat calvariae:role of insulinlike growth factor-I[J].Endocrinology,1993,133(4):1504-10.

