糖尿病合并肺結核患者外周血的免疫功能探討
621100 四川省三臺縣人民醫院 楊勇瓊
310002 南京軍區杭州療養院海勤療養區 周曉明
310015 杭州師范大學附屬醫院 王建軍
結核病仍然是危害全球公眾健康問題的主要原因之一,全球每年有新發結核病人800萬,200萬人因結核病死亡[1-2]。在過去幾十年里,結核病與糖尿病的相關性受到廣泛關注,大量的回顧性研究表明糖尿病患者對結核病具有高度易感傾向,糖尿病是結核發生及耐多藥的重要危險因素之一[3]。
盡管有眾多證據顯示糖尿病會引起患者顯著增加對肺結核的易感性,但是目前關于糖尿病患者易感肺結核的免疫機制的報道尚少。有研究者發現糖尿病合并肺結核患者PBMC分泌細胞因子水平發生改變,表現為Th1/Th2比例下降[4]。在宿主抗結核免疫中,Th1細胞能介導巨噬細胞活化來抑制結核桿菌感染。糖尿病合并肺結核患者PBMC是否存在一定的免疫功能缺陷,目前國內尚無相關報道。本實驗通過檢測糖尿病合并肺結核患者體內巨噬細胞活化程度及巨噬細胞殺滅結核桿菌能力等來明確上述問題。
1 材料和方法
1.1 人外周血標本 研究對象均來自2009-02—2010-02重慶醫科大學附屬第一醫院肺科收治的新發和復發確診為肺結核的病人、糖尿病合并肺結核病人各20例及健康志愿者20例。研究者年齡<50歲。HBsAg陰性,HIV抗體陰性,并簽署知情同意書的志愿者。
1.2 主要試劑 胎牛血清購自杭州四季青;Ficoll淋巴細胞分離液購自天津灝陽生物;NO檢測試劑盒、TNF-α ELISA試劑盒均購于南京建成公司;改良羅氏培養基購于杭州創新生物公司;結核桿菌株由重慶醫科大學附屬第一醫院呼吸內科P2實驗室提供。
1.3 巨噬細胞的分離培養及成熟誘導 取健康組、結核病組、糖尿病合并肺結核組肝素抗凝外周全血20 mL,經密度梯度離心法(2 500 r/min×20 min)分離單個核細胞。生理鹽水洗3次,用完全培養基 (10%胎牛血清的1640培養液)調整細胞濃度為2×106/mL,加入6孔培養板,37℃ 5%CO2孵箱培養2 h。去除懸浮細胞,貼壁細胞即為單核細胞。每孔加完全培養基2 mL誘導分化成巨噬細胞,隔2 d換液,培養第9天收集培養上清液及巨噬細胞。
1.4 巨噬細胞電鏡觀察 收集巨噬細胞用多聚甲醛-戊二醛4℃固定90 min后,將細胞移入離心管中,用PBS洗滌2次,離心(3 000 r/min×5 min)后再4℃保存于PBS中。1%鋨酸固定,梯度乙醇脫水,環氧樹脂包埋,超薄切片,電子染色,透射電鏡觀察巨噬細胞形態學超微結構。
1.5 檢測巨噬細胞培養上清液中TNF-α、NO水平 收集第9天巨噬細胞培養上清液,用ELISA試劑盒檢測TNF-α水平,用硝酸還原酶法檢測NO水平,操作步驟按說明書進行,顯色后用酶標儀檢測450 nm波長的吸光度值,根據標準曲線確定TNF-α和NO水平。
1.6 結核桿菌的培養及計數 用改良羅氏培養基培養結核桿菌2周后挑取菌落研磨,麥氏比濁法測定菌液濃度,調整為1 mg/mL(相當于菌量為3×108個/mL)。用生理鹽水稀釋后感染巨噬細胞,感染按細菌∶細胞=10∶1比例進行。
1.7 巨噬細胞殺滅結核桿菌能力檢測 收集并裂解感染結核桿菌24 h的各組巨噬細胞(方法同參考文獻[5]):先用生理鹽水洗滌3次,然后每孔加4℃保存的滅菌雙蒸水0.5 mL,室溫放置10 min,再加0.5 mL/孔細胞裂解液,觀察細胞完全裂解后,收集孔內全部液體離心(10 000 r/min×10 min)。離心棄上清液,每管加20%BSA 0.5 mL,渦旋振蕩30 s,制成菌懸液。用生理鹽水將懸液按10×梯度逐級稀釋,去不同稀釋度的菌液0.1 mL,接種在羅氏培養基上,培養10 d后觀察菌落數量。
1.8 統計學處理 采用SPSS 17.0統計軟件進行統計分析,實驗數據用柱形圖表示,多個組比較采用方差分析,兩個組比較采用t檢驗,以P<0.05為差異有統計學意義。
2 實驗結果
2.1 巨噬細胞形態學觀察 細胞培養第9天透射電鏡觀察顯示,巨噬細胞胞質內含大量特征性標志物溶酶體,吞飲小泡、吞噬體,線粒體豐富,胞漿顆粒明顯,細胞膜內側有許多微絲和微管(圖1~2)。
2.2 TNF-α及NO的檢測 ELISA檢測各組間TNF-α水平均有差異,其中TB+DM組(597.5±69.1)pg/mL較TB組(688.2±64.8)pg/mL、健康組(839.3±74.5)pg/mL顯著降低,差異有統計學意義(F=18.48,P<0.05),TB組低于健康組,差異有統計學意義 (P<0.05,圖3);NO水平各組間均有差異TB+DM組(57.3±14.6)μmol/L較TB組(83.5±23.3)μmol/L、健康組(108.9±22.3)μmol/L顯著降低,差異有統計學意義(F=9.522,P<0.05),TB組低于健康組,差異有統計學意義(P<0.05,圖4)。
圖1 培養第9天巨噬細胞
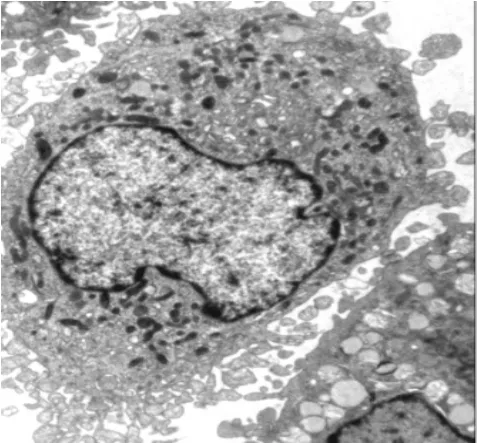
圖2 巨噬細胞電鏡圖
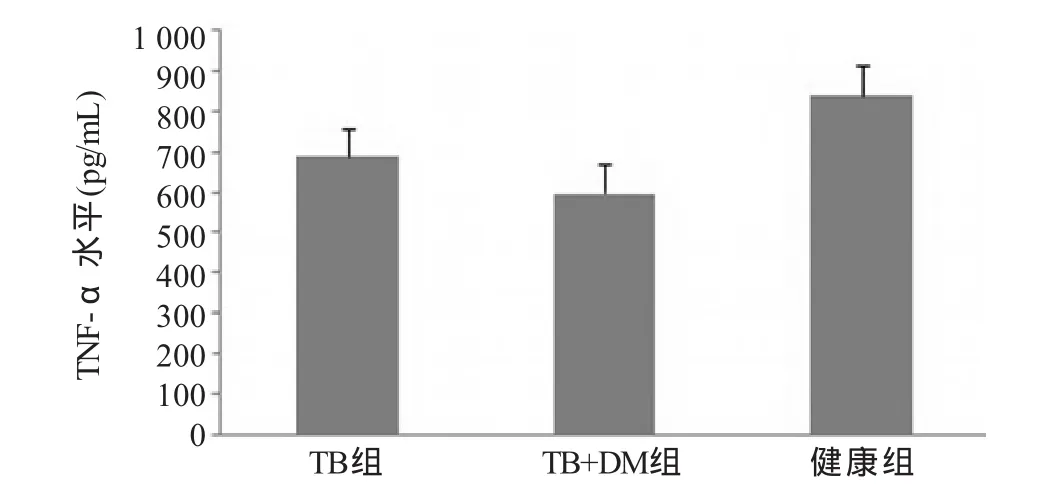
圖3 各組巨噬細胞上清液中TNF-α水平比較
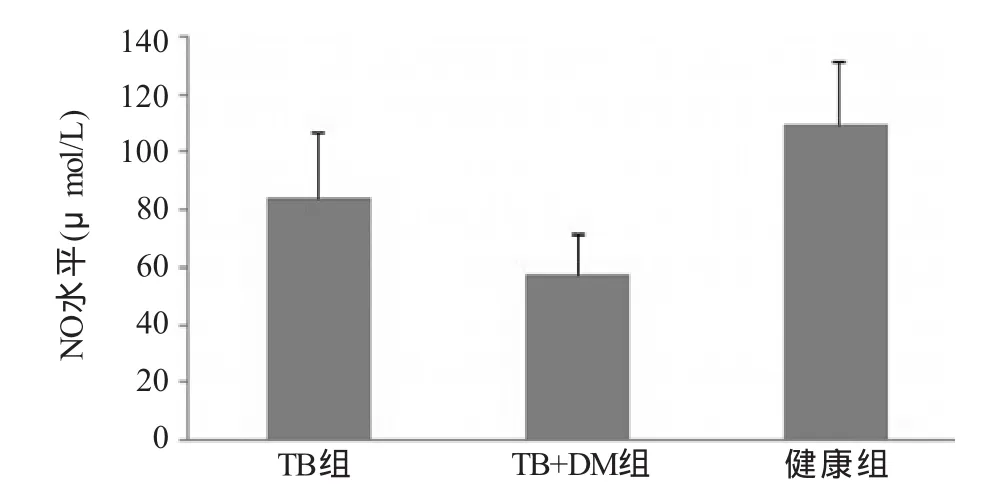
圖4 各組巨噬細胞上清液中NO水平比較
2.3 巨噬細胞內活菌計數的比較 將接種的細菌計數取10的對數值(lg CFU)表示。感染巨噬細胞前計數接種的活菌數為6.7。裂解巨噬細胞培養被巨噬細胞吞噬的MTB,10 d后計數菌落,各組間均有差異。TB+DM組(6.14±0.154)較TB組(5.97±0.132)、健康組(5.77±0.127)顯著升高,差異有統計學意義(F=11.165,P<0.05),TB組高于健康組,差異有統計學意義(P<0.05,圖5)。
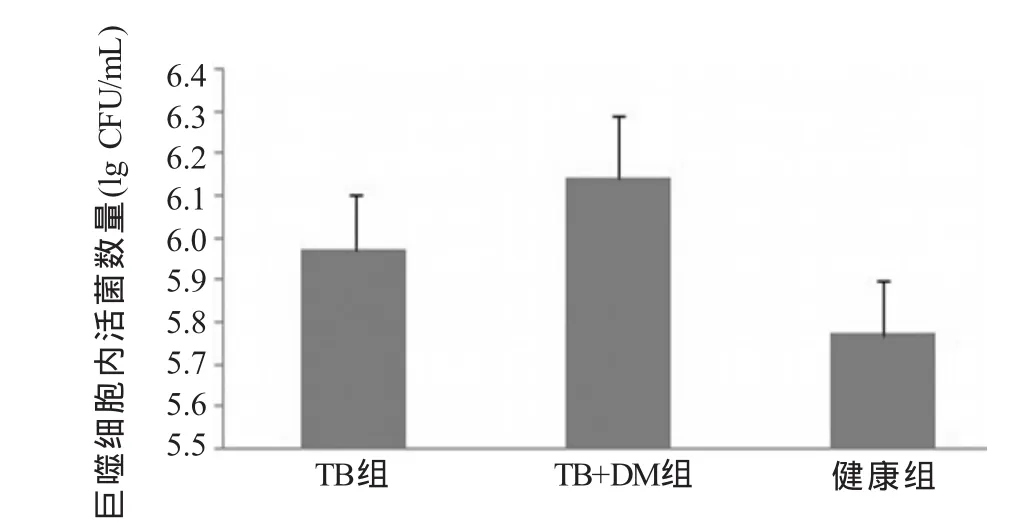
圖5 各組巨噬細胞內活菌計數比較
3 討論
糖尿病作為結核病發生發展的一個重要危險因素,已經越來越受到關注。動物實驗研究顯示,糖尿病大鼠對結核桿菌具有高度的易感性可能與其抗結核免疫功能下降有關[4,6]。在宿主抗結核免疫中,巨噬細胞是主要效應細胞,受結核桿菌感染后首先是巨噬細胞作出反應,分泌大量TNF-α、IL-6、IL-1等細胞因子使淋巴細胞和單核細胞聚集到結核桿菌入侵部位,限制其擴散并殺滅結核桿菌[1,6-7]。在結核病發病機制中,結核桿菌通過多種途徑逃避免疫攻擊,但最終都是通過影響或利用巨噬細胞來躲避宿主抗結核免疫應答的。
本研究發現,糖尿病合并肺結核患者外周血單核細胞誘導分化的巨噬細胞分泌的TNF-α水平較單純肺結核組和健康組相比顯著降低,TNF-α主要由巨噬細胞分泌,在宿主抗結核病中起著重要的作用。它能促進淋巴細胞和單核細胞聚集到感染部位,促進宿主細胞對結核桿菌的殺滅作用。同時還能促進受感染發生的巨噬細胞凋亡,從而釋放出未被徹底殺滅的結核桿菌,使之重新受到活化后的免疫細胞的吞噬和殺滅,以防止結核桿菌慢性反復感染和復發[8]。TNF-α水平降低,表明糖尿病合并肺結核患者體內的巨噬細胞抗結核免疫功能受損。研究還發現,糖尿病合并肺結核患者巨噬細胞分泌的NO水平也顯著低于單純肺結核組和健康組。NO由巨噬細胞分泌產生,能顯著增強巨噬細胞殺滅結核桿菌的能力,并作為巨噬細胞活化的一個重要標志。其水平降低,表明糖尿病患者巨噬細胞活化及殺滅結核桿菌能力降低[9]。這也可能是糖尿病患者易感肺結核的重要原因之一。
在活化后的3組巨噬細胞吞噬殺滅結核桿菌的研究中發現,糖尿病合并肺結核患者的巨噬細胞吞噬結核桿菌后,其未殺滅的結核桿菌菌落數顯著高于單純肺結核組和健康組。表明糖尿病合并肺結核組巨噬細胞殺滅結核桿菌的能力降低,這可能也是糖尿病合并肺結核患者容易導致結核病反復感染、復發及產生耐多藥的重要因素之一[3]。
綜上所述,本研究通過檢測糖尿病合并肺結核患者巨噬細胞活化及吞噬能力,從細胞層面研究糖尿病易感肺結核的發病機制,為糖尿病與肺結核相關性的免疫學研究奠定基礎。
[1]王建軍,郭述良,李蘭,等.ManLAM對樹突狀細胞成熟及下游免疫的影響[J].中國免疫學雜志,2010,26(7):587-590.
[2]Stevenson CR,Critchley JA,Forouhi NG,et al.Diabetes and the risk of tuberculosis:a neglected threat to public health[J].Chronic Illn,2007,3(3):228-245.
[3]Singla R,Khan N.Does diabetes predispose to the development of multidrug-resistant tuberculosis?[J].Chest,2003,123(1):308-309.
[4]Sugawara I,Mizuno S.Higher susceptibility of type 1 diabetic rats to Mycobacterium tuberculosis infection[J].Tohoku J Exp Med,2008,216(4):363-370.
[5]Broxmeyer L,Sosnowska D,Miltner E,et al.Killing of Mycobacterium avium and Mycobacterium tuberculosis by a mycobacteriophage delivered by a nonvirulentmycobacterium:a model for phage therapy of intracellular bacterial pathogens[J].J Infect Dis,2002,186(8):1155-1160.
[6]Sugawara I,Yamada H,Mizuno S.Pulmonary tuberculosis in spontaneously diabeticgoto kakizakirats[J].Tohoku JExp Med,2004,204(2):135-145.
[7]Vallerskog T,MartensGW,KornfeldH.Diabeticmicedisplay adelayed adaptiveimmuneresponseto Mycobacterium tuberculosis[J].J Immunol,2010,184(11):6275-6282.
[8]Loeuillet C,Martinon F,Perez C,et al.Mycobacterium tuberculosis subverts innate immunity to evade specific effectors[J].J Immunol,2006,177(9):6245-6255.
[9]王建軍,郭述良,羅永艾.C型凝集素在結核病發病機制中的作用[J].中華結核和呼吸雜志,2010,33(3):214-216.

