Ubc9基因重組腺病毒的構建及其在HeLa細胞中的表達
李薇,劉曉萍,徐祥,譚艷,于業軍,李艷君,任書亭,賈躍偉
為了進一步研究 Ubc9 對細胞功能的影響,我們構建帶有紅色熒光標記(RFP)的含 Ubc9 基因的腺病毒載體,觀察 Ubc9 在 HeLa 細胞中的表達情況,為今后研究 Ubc9 的功能提供一個工具。
1 材料與方法
1.1 質粒、菌株和主要生化試劑
穿梭質粒 pAdTrack-TO4、腺病毒骨架質粒pAdeasy-1、pCMV6-XL6-Ubc9 質粒、大腸桿菌DH5a、BJ5183 及腺病毒包裝細胞 HEK293 細胞由第三軍醫大學大坪醫院外研所贈予;轉染試劑PolyJetTM購自美國 SignaGen 公司;質粒小量提取試劑盒、膠回收試劑盒以及 DNA 標記物購自北京康為世紀生物科技有限公司;無內毒素質粒大量制備試劑盒購自北京百泰克生物技術有限公司;DMEM 培養基、血清、胰蛋白酶購自美國 Gibco公司;限制性內切酶、T4 DNA 連接酶購自大連Takara 公司;瓊脂糖及各種生化制劑由凌飛公司進口分裝;PCR 引物由上海生工公司合成;基因測序由上海英濰捷基有限公司完成。
1.2 方法
1.2.1 PCR 法擴增目的 Ubc9 基因 以 pcmv6-xl6-Ubc9 質粒為模板進行 PCR 擴增。在引物中分別引入 BamH I 和 Xho I 的酶切位點,上游引物:5’ GGATCCATGTCGGGGATCGCCCTCAG 3’;下游引物:5’ TCCGCTCGAGTTATGAGGGCGCAAA CTTC 3’。PCR 反應參數:94℃預變性 2min,94℃變性 30 s,60℃退火 30 s,72℃延伸 30 s,循環 30 次,最后 72℃延伸 5min。PCR 產物經 2%瓊脂糖凝膠電泳,切膠回收獲得目的片段。
1.2.2 腺病毒穿梭質粒 pAdTrack-CMV-Ubc9 的構建 將 PCR 擴增的 Ubc9 基因產物和帶有RFP 的穿梭質粒 pAdTrack-CMV 分別以 BamH I和 Xho I 進行雙酶切,經 2%瓊脂糖凝膠電泳鑒定并純化回收 Ubc9 片段及 pAdTrack-CMV 穿梭質粒。用 T4 DNA 連接酶過夜連接,轉化大腸桿菌 DH5a。挑選轉化菌落,小量快速提取重組質粒。通過限制性酶切和測序分析進行鑒定。同時,以不含目的基因 Ubc9 的穿梭質粒 pAdTrack-CMV 作為載體對照。
1.2.3 含有 pAdEasy-1 的 BJ5183 菌的制備 挑取單一克隆 BJ5183 菌接種在含 LB 培養基搖瓶中,37℃,200 r/min,培養 16 h。取 200 μl 菌液加入 20 ml 新鮮的 LB 培養基,37℃,260 r/min,培養 2 h,直至 OD 值為0.4~0.5。取 1.5 ml 菌液置 1.5 ml 離心管中,冰上放置 10min。4℃,3000×g離心 10min,棄上清。
加入 1 ml 0.1 mol/L 的 CaCl2輕輕吹打,充分懸浮,冰浴 10min。4℃,3000×g離心 10min,棄上清。加 1 ml 0.1 mol/L 的 CaCl2重懸沉淀,冰浴 30min。4℃,3000×g離心 10min,棄上清。用 100 μl 0.1 mol/L 的 CaCl2重懸沉淀,即感受態制備完成。
在感受態細胞中,加入 5 μl pAdEasy-1 質粒,冰浴 30min。42℃熱刺激 90 s。冰浴 5min。加LB 培養基 900 μl,37℃,200 r/min 培養 30min后 3000×g離心 3min。收集沉淀并留 100 μl 上清,棄多余部分,混勻,涂布到含氨芐青霉素的 LB板。37℃培養箱倒置培養,約 16 h。挑取單個菌落,擴增培養,獲取含有腺病毒骨架質粒 pAdEasy-1的 BJ5183 感受態細菌,儲存待用。
1.2.4 pAdEasy-1/Ubc9 腺病毒載體的構建 取1 μg pAdTrack-CMV-Ubc9 質粒 DNA,PmeI 酶切線性化,乙醇沉淀回收后,轉化至含有腺病毒骨架質粒 pAdEasy-1 的 BJ5183 感受態細菌中,混勻,冰上靜置 30min。42℃熱刺激 90 s,冰浴5min,加 LB 培養基 900 μl,37℃,200 r/min 培養 20min。接種于含有卡那霉素的平板上,孵育16 h。挑取較小的 10 個克隆擴增培養,提取質粒。用 PacI 酶切鑒定質粒,將鑒定正確的重組質粒再次轉化感受態 DH5a 菌。擴增培養,大量提取pAdEasy-1/ Ubc9 的重組腺病毒質粒。并用 PacI酶切使之線性化,保存于 –20℃待用。
1.2.5 重組腺病毒的包裝及擴增 于轉染前 12~18 h 鋪 293 細胞,當細胞密度達 50%~70%時。采用脂質體法將 5 μg 線性化的重組質粒 pAdEasy-1/Ubc9 轉染至 293 細胞中,12 h 后換新鮮培養基(具體操作參照 PolyJetTM說明進行轉染,同時轉染空載體作對照)。37℃5%CO2培養 5~7 d,待細胞出現病變時(7~10 d)收集細胞。于 –70℃和37℃水浴中反復凍融 4 次,3000×g離心 10min,收集上清。上清液中含原始重組腺病毒(Ad-Ubc9)。取重組病毒液重復感染 293 細胞 2~3 次,以大量擴增病毒。分裝病毒液,保存于 –70℃。
2016年8月,游成令的女兒患上“急性普通B淋巴細胞L1型白血病”。這突如其來的噩耗,給這對農村走出來的夫妻帶來了巨大的精神和經濟壓力。游成令后悔以前沒有多關心女兒一點。在工作和家庭之間,她從來都是把工作放在第一位。
1.2.6 重組腺病毒感染 HeLa 細胞 取 HeLa細胞鋪于 6cm 平皿中,密度為106個/ml。貼壁后吸棄培養液,用滅菌 PBS 洗 2~3 遍。加入含Ad-Ubc9 病毒液感染 HeLa 細胞。培養 2 h 后棄病毒液,PBS 洗 3 遍,加入含 0.5%小牛血清的DMEM 培養液培養 72 h。
1.2.7 Western blot 檢測重組腺病毒蛋白的表達 感染 3 d 后收集細胞,提取總細胞蛋白(RIPA法)。取 10 μg 蛋白,用 12%SDS-PAGE 分離。PVDF 膜在轉印液中平衡 10min,然后遵循膠在負極,膜在正極的原則進行轉印,電壓 90 V,4℃,2 h;取出 PVDF 膜用麗春紅染液染色,約 5min,蛋白條帶出現后,用去離子水漂洗;將 PVDF 膜置于 100 g/L 脫脂奶粉溶液中,封閉 2 h,兔抗Ubc9 血清(1∶1000),4℃過夜,TPBS 洗滌 3 次,10min/次;二抗濃度為1∶10000,室溫孵育1 h,TPBS 洗滌 3 次,10min/次。ECL Kit 檢測結果(同時用未感染病毒的 HeLa 細胞作對照)。
2 結果
2.1 目的片段(Ubc9)的擴增
以 pcmv6-xl6-Ubc9 質粒為模板,PCR 擴增出477 bp 的 Ubc9 片段。產物經 2%瓊脂糖凝膠電泳可觀察到約 477 bp 的條帶,與預期結果相符(圖1)。

圖1 含 Ubc9 基因質粒 PCR 擴增結果Figure 1 Amplification of Ubc9 gene by PCR
2.2 酶切鑒定重組穿梭質粒 pAdTrack-CMV-Ubc9
BamH I 和 Xho I 雙酶切產物電泳可觀察到約 9 kb 和 477 bp 的 DNA 條帶,經過堿基測序,Ubc9基因未見突變,表明含有Ubc9基因的穿梭載體構建成功,可用于后續實驗(圖2)。
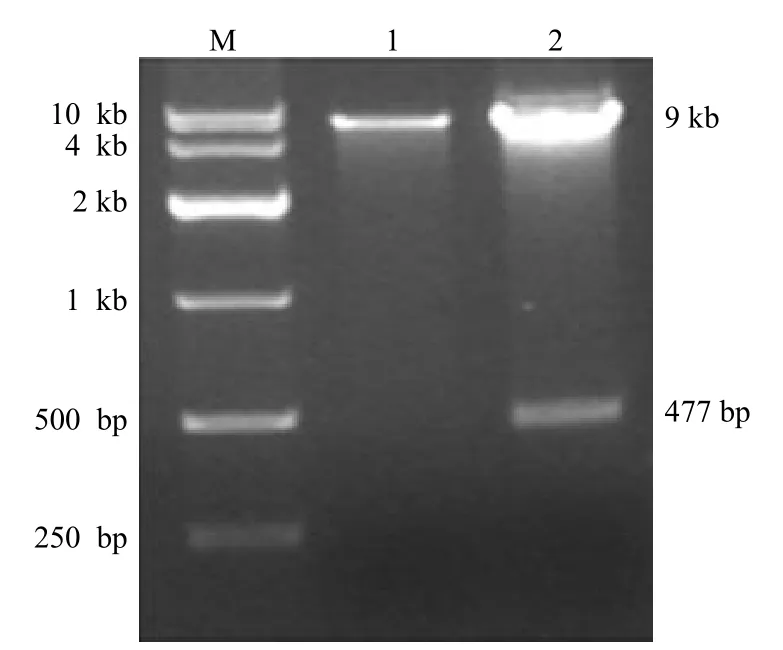
圖2 瓊脂糖凝膠電泳鑒定穿梭質粒 pAdTrack-CMV-Ubc9的酶切結果Figure 2 Restriction enzyme digestion analysis of shuttle plasmid pAdTrack-CMV-Ubc9 vectors
2.3 酶切鑒定重組質粒 pAdEasy-1/Ubc9
pAdEasy-1/Ubc9 質粒經 Pac I,酶切后獲得大小兩個片段,即 1 個大約 30 kb 和 1 個 4.5 kb的片段,表明穿梭質粒 pAdTrack-CMV-Ubc9 與腺病毒骨架質粒 pAdEasy-1 同源重組成功(圖3)。
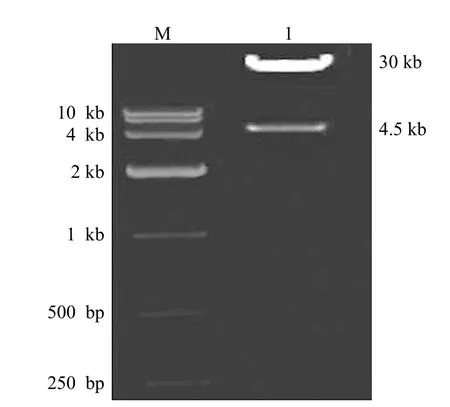
圖3 瓊脂糖凝膠電泳鑒定 pAdEasy-1/Ubc9 的酶切結果Figure 3 Identification of recombinant adenovims vector by restriction enzyme digestion
2.4 重組腺病毒 Ad-Ubc9 的包裝
將帶有紅色熒光標記的線性化 pAdEasy-1/Ubc9 轉染 293 細胞后,在熒光顯微鏡下,Ad-Ubc9 成功包裝細胞呈現 RFP 陽性(圖4)。
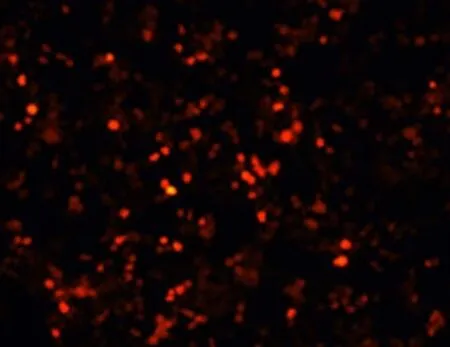
圖4 轉染 293 細胞后 RFP 的表達Figure 4 RFP expression after plasmid transfected HEK293 cells
2.5 Ubc9 基因在靶細胞中的表達
Western blot 檢測可見感染重組腺病毒 Ad-Ubc9 的 HeLa 細胞中呈現 Ubc9 蛋白高表達(圖5)。
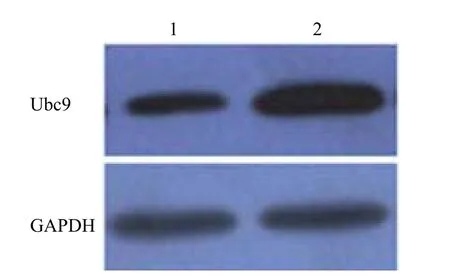
圖5 Ubc9 在 HeLa 細胞中表達Figure 5 Analysis Ubc9 expression in HeLa cells by western blot
3 討論
SUMO 的生化反應過程是一系列獨特的活化酶級聯反應過程,最終使其與底物蛋白結合完成蛋白質修飾,從而調節細胞活動。自 SUMO 發現的十多年來,大量研究集中在酶反應體系和蛋白質相互作用方面,而 SUMO 修飾的功能學研究甚少。Ubc9 作為唯一的 E2 酶,SUMO 化修飾的完成依賴于 Ubc9 的表達,近年來對 Ubc9 的研究成為熱點。有報道 Ubc9 基因的敲除可導致雞細胞的雙核細胞數量增加和鼠類細胞的細胞核形態異常以及染色體的缺失[9-10]。在果蠅細胞中,Ubc9 功能的缺失引起造血細胞的有絲分裂紊亂[11]。酵母菌中Ubc9 基因突變,會使其對引起 DNA 損傷的因素更加敏感[12-13]。為了更廣泛地研究 Ubc9在細胞中的功能,我們構建表達 Ubc9 的腺病毒表達載體。
重組腺病毒是復制缺陷型的腺病毒載體,也是目前基因治療研究和臨床試驗中應用最廣泛的病毒載體。傳統上,雙載體(即穿梭質粒和骨架質粒)同源重組過程是在哺乳動物細胞中來實現的。然而,由于哺乳動物細胞中同源重組的低效性以及某種程度上的不可預見性,使得該過程成為重組腺病毒制備的限速步驟。與傳統方法不同的是,該試驗中兩種質粒的重組是在細菌(BJ5183)中而非真核細胞中完成。由于質粒轉化細菌的效率極高,細菌繁殖速度快,且 BJ5183 菌中的 Rec A 可表達很強的重組酶活性,因此,細菌中同源重組法克服了細胞內質粒共轉染效率低和同源重組率低的缺點,大大縮短了實驗周期,且顯著提高了成功率。另外,這種重組質粒轉染哺乳動物包裝細胞株后,在共轉染的基因編碼的紅色熒光(RFP)的指示下,陽性轉染重組病毒的細胞容易被觀察和追蹤。該系統加快了各種目的重組腺病毒的制備和鑒定過程。
本實驗通過限制性酶切分析及堿基序列測定,均證明已正確構建重組穿梭質粒 pAdTrack-CMVUbc9。在 HEK293 細胞中成功包裝重組腺病毒Ad-Ubc9。本研究所產生的重組腺病毒 Ad-Ubc9能在體外感染 HeLa 細胞,并成功表達出 Ubc9 蛋白,為進一步研究 Ubc9 基因在細胞中的功能奠定了基礎。
[1]Li XD, Yang S, Qiu YF, et al.SUMOylation: an important post-translational modification in vivo.Chin J Cell Biol, 2008, 30:142-146.
[2]Sternsdorf T, Jensen K, Freemont PS.Sumo.Curr Biol, 2003, 13(7):R258-R259.
[3]Johnson ES.Protein modification by SUMO.Annu Rev Biochem,2004, 73:355-382.
[4]Hayashi T, Seki M, Maeda D, et al.Ubc9 is essential for viability of higher eukaryotic cells.Exp Cell Res, 2002, 280(2):212-221.
[5]Seufert W, Futcher B, Jentsch S.Role of a ubiquitin-conjugating enzyme in degradation of S- and M-phase cyclins.Nature, 1995,373(6509):78-81.
[6]McDoniels-Silvers AL, Nimri CF, Stoner GD, et al.Differential gene expression in human lung adeno-carcinomas and squamous cell carcinomas.Clin Cancer Res, 2002, 8(4):1127-1138.
[7]Mo YY, Yu Y, Theodosiou E, et al.A role for Ubc9 in tumorigenesis.Oncogene, 2005, 24(16):2677-2683.
[8]Moschos SJ, Athanassiou H, Edington H, et al.Proteomic analysis of melanoma-in fi ltrated lymph nodes gains insights into the molecular pro fi le of metastatic melanoma.Proc Amer Assoc Cancer Res,2005(46).
[9]Hayashi T, Seki M, Maeda D, et al.Ubc9 is essential for viability of higher eukaryotic cells.Exp Cell Res, 2002, 280(2):212-221.
[10]Nacerddine K, Lehembre F, Bhaumik M, et al.The SUMO pathway is essential for nuclear integrity and chromosome segregation in mice.Dev Cell, 2005, 9(6):769-779.
[11]Chiu H, Ring BC, Sorrentino RP, et al.dUbc9 negatively regulates the Toll-NF-kappa B pathways in larval hematopoiesis and drosomycin activation in Drosophila.Dev Biol, 2005, 288(1):60-72.
[12]Mao Y, Sun M, Desai SD, et al.SUMO-1 conjugation to topoisomerase I: A possible repair response to topoisomerase-mediated DNA damage.Proc Natl Acad Sci U S A, 2000, 97(8):4046-4051.
[13]Jacquiau HR, vanWaardenburg RC, Reid RJ, et al.Defects in SUMO(small ubiquitin-related modi fi er) conjugation and deconjugation alter cell sensitivity to DNA topoisomerase I-induced DNA damage.J Biol Chem, 2005, 280(25):23566-23575.

