雌激素對人臍帶來源間充質細胞骨架和超微結構的影響
趙葉琳,趙曉寅,孫凌云,侯亞義
人臍帶間充質干細胞(MSC)具有免疫抑制作用和多向分化潛能,被用于治療各種疾病。而雌激素與許多自身免疫性疾病的發(fā)生與發(fā)展有關,以前的研究中發(fā)現(xiàn) 17β-雌二醇(E2)能影響破骨細胞內細胞骨架的結構,下調微絲肌動蛋白(F-actin)的表達,降低破骨細胞的活動能力,從而抑制破骨細胞的骨吸收功能[1-2]。E2對 MSC 有多種調節(jié)作用,如能抑制 MSC 的成骨分化[3]及抑制 MSC 的免疫調節(jié)功能[4]。但關于 E2 對 MSC 細胞骨架和超微結構的影響還未見報道。
F-actin 呈纖維狀,是構成細胞內微絲骨架的主要部分。肌動蛋白相關蛋白2/3(Arp2/3)復合物又是構成 F-actin 的結構基礎[2]。F-actin 在細胞內的聚合及解聚,與細胞的運動、形態(tài)及細胞內外的信息傳遞等功能有關,為細胞內外信息傳遞提供分子橋梁,控制細胞形態(tài)、運動和增殖等生物效應[5-6]。
紐蛋白(vinculin)是一種與黏著類型連接形成有關的細胞骨架蛋白,存在于細胞—細胞及細胞—基質間的黏著部位,其作用是將 F-actin 錨著于連接點形成部位的細胞膜上[7]。紐蛋白的表達對 MSC的黏附功能有著重要作用[8]。
本研究中,我們通過激光共聚焦顯微鏡(laser confocal microscope,LCM)觀察了 E2 作用下細胞骨架和細胞連接的情況,用透射電子顯微鏡(transmission electron microscopy,TEM)觀察細胞內部細胞器的變化,探討 E2 作用后 MSC 功能變化的可能原因。
1 材料與方法
1.1 材料
1.1.1 標本來源 自然足月剖腹產的健康胎兒臍帶,獲自南京大學醫(yī)學院附屬鼓樓醫(yī)院。所用材料均嚴格遵守醫(yī)學倫理道德,經(jīng)產婦及家屬認可,并經(jīng)醫(yī)院醫(yī)學倫理委員會批準。
1.1.2 主要試劑 DMEM/F12 培養(yǎng)基和優(yōu)級胎牛血清(FBS)購自美國 Gibco 公司;膠原酶 II、中性蛋白酶、透明質酸酶購自美國 Sigma 公司;熒光標記小鼠抗人抗體 PE-CD117、PE-CD44、PE-CD29、FITC-CD31、FITC-CD45 和 APC-CD105單克隆抗體購自美國 Ebioscience公司;鼠 IgG-PE、鼠抗人紐蛋白單克隆抗體購自美國 Santan 公司;17β-雌二醇、鬼筆環(huán)肽(Phalloidin- FITC)購自美國 Sigma 公司;明膠、牛血清白蛋白(BSA)購自中國 sunshine 公司;聚乙二醇辛基苯基醚(Triton 100)購自中國 beyotime 公司。
1.1.3 儀器 FACSCalibur 流式細胞儀為美國BD 公司產品;FV10i 型激光共聚焦顯微鏡為日本Olympus 公司產品;Philipscm12 型透射電子顯微鏡為荷蘭 Philips 公司產品。
1.2 方法
1.2.1 人臍帶來源間充質細胞的分離及純化 取足月剖腹產胎兒的臍帶,在無菌狀態(tài)下用預冷的含 0.01%青霉素和鏈霉素的磷酸鹽緩沖液(PBS)沖洗,去掉臍帶內血塊。在 DMEM/F12 基本培養(yǎng)基中,將臍動脈剝除,其余部分剪成 2mm3碎塊,250 U/ml 的膠原酶 II、100 U/ml 中性蛋白酶和 10 U/ml 透明質酸酶以 1∶1∶1 的比例加入組織中,37℃振蕩消化 3 h 至組織基本消化完全。離心去上清,用基本培養(yǎng)基洗 3 次,再培養(yǎng)于含 10%FBS 的 DMEM/F12 完全培養(yǎng)基中。調整細胞密度為1×109個/L,于 37℃,5%CO2培養(yǎng)箱中培養(yǎng)。3~4 d 后,輕輕晃動培養(yǎng)板,全量換液,待細胞鋪滿度達 80%左右,用 2.5 g/L 的胰酶消化,常規(guī)傳代。取第3 代細胞,分析其表面標志,確定其為MSC 后用于試驗。
1.2.2 流式細胞儀測定細胞表面標志 消化、收集細胞,PBS 洗滌 2 次,調整細胞密度約 1×106個/ml。共 3 例臍帶 MSC,每個標記設 3 復孔,加入同型對照和相應抗體,4℃避光孵育 30min,PBS 洗滌 2 次后上機檢測。MSC 檢測標志為:CD117、CD29、CD31、CD44、CD105 及 CD45。
1.2.3 細胞爬片及免疫熒光標記 將蓋玻片用75%酒精浸泡 30 s,換到 95%酒精浸泡 30 s,燒干蓋玻片。將蓋玻片放到 12 孔培養(yǎng)板里,加覆500 μl 左右 1%的無菌明膠,37℃孵育 2 h,吸去明膠,PBS 洗,5×105個/ml 細胞懸浮于完全培養(yǎng)基中,每孔加入 1 ml 細胞懸液,分別加入10-7nmol/L 和 10-8nmol/L 的 E2 處理 12、24 和48 h。對照組相同體系培養(yǎng),以同體積的 PBS 代替 E2。將細胞爬片用 4%多聚甲醛固定 30min,PBS洗 3 次,0.1%聚乙二醇辛基苯基醚(Triton 100)室溫處理 15min,PBS 洗 3 次,用 3%牛血清白蛋白(BSA)室溫封閉 1 h,PBS 洗,加一抗鼠抗人紐蛋白單抗,4℃過夜。PBS洗 3 次,分別加抗鼠 IgG-PE 和 Phalloidin-FITC,室溫孵育1 h,PBS洗 3 次,最后 DAPI 染核 10min,PBS洗 3 次,加防熒光猝滅劑封片。
1.2.4 透射電鏡樣品制備 將 E2 處理過的臍帶MSC 200×g離心 5min,用預冷的 PBS 洗滌2 次,2.5%戊二醛(0.01 mol/L 二甲胂酸鈉配制)固定 4℃過夜。0.01 mol/L 二甲胂酸鈉緩沖液洗滌,l%鋨酸 4℃固定 l h。梯度丙酮脫水,環(huán)氧樹脂 Epon812 包埋,常規(guī)超薄切片,醋酸雙氧鈾及枸櫞酸鉛雙染色后置透射電鏡下觀察。
2 結果
2.1 MSC 的形態(tài)學觀察和表面標記物檢測
原代培養(yǎng)早期細胞形態(tài)異質性較大,以梭形、多角形為主。消化傳代后,從第3 代起開始穩(wěn)定生長,可獲得較均一的 MSC。細胞形態(tài)為梭形或成纖維樣,體積較大,單核,呈漩渦樣生長(圖1)。流式細胞儀檢測顯示,臍帶 MSC 穩(wěn)定均一地表達CD29 和 CD44(纖維蛋白和透明質酸鹽的受體,由基質細胞表達)、CD105(SH-2);不表達 CD117(多能造血干細胞標志)、CD31(內皮細胞標志)和 CD45(造血細胞標志)。經(jīng) 3 代以上傳代后,細胞成分均一,純度在 95%以上(圖2)。

圖1 人臍帶來源 MSC 的細胞形態(tài)(A:第2 代;B:第3 代)Figure 1 The morphology of human umbilical cord MSC (A:P2; B: P3)
2.2 LCM 觀察細胞骨架
正常的臍帶 MSC 細胞 F-actin Phalloidin-FITC 熒光染色為綠色,呈細絲狀,主要沿細胞長軸分布,貫穿整個 MSC 細胞(圖3A)。Vinculin 免疫染色為紅色,呈點狀,簇狀著染于肌動蛋白兩端,分布于胞漿中細胞膜側(圖3B,白色箭頭)。胞漿與細胞核中見非特異性著染,細胞核染色為藍色。10-7nmol/L E2處理 48 h 后,對肌動蛋白分布無太大影響(圖3D),Vinculin 主要分布于胞漿中靠細胞核側(圖3E)。10-8nmol/L 組各時間點細胞形態(tài)及肌動蛋白分布均無明顯變化。
2.3 TEM 觀察細胞超微結構
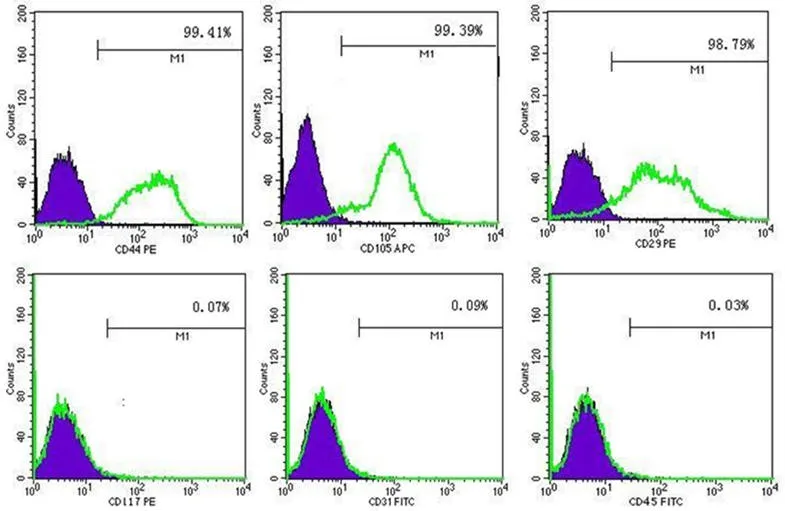
圖2 人臍帶 MSC 的表面標志(陰影部分為同型對照)Figure 2 The surface marker of human umbilical cord MSC (Shadow area was isotype control)
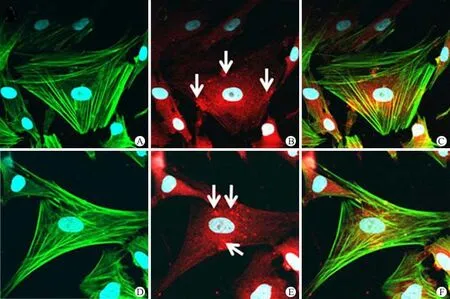
圖3 E2 作用后 MSC 細胞骨架的變化(F-actin 著染綠色熒光,白色箭頭指向的紅色亮點為vinculin) (A:對照組 F-actin--FITC 熒光染色;B:對照組 vinculin 熒光染色;C:對照組 F-actin 和 vinculin 染色疊加;D:E2 組 F-actin--FITC 熒光染色;E:E2 組 vinculin 熒光染色;F:E2 組 F-actin 和 vinculin 染色疊加)Figure 3 Changes of cytoskeleton of MSC after E2 treatment [ Cell cytoskeleton proteins F-actin (Green) and vinculin (Red, white arrows showed vinculin) ](A: Control FITC-F-actin; B: Control PE-vinculin; C: A and B overlap; D: E2 FITC-F-actin; E: E2 PE-vinculin; F: D and E overlap)
10-7nmol/L E2 處理 MSC 48 h 后,透射電鏡觀察細胞的超微結構。對照組細胞核呈圓或卵圓不規(guī)則形,雙層核膜完整,核仁大而明顯,常異染色質分布均勻,粗面內質網(wǎng)、滑面內質網(wǎng)、線粒體等細胞器數(shù)量豐富、結構清晰(圖4A、B、C)。E2 處理后的 MSC 透射電鏡下見有部分細胞開始出現(xiàn)結構異常現(xiàn)象,有的胞質內出現(xiàn)大量大小不等的空泡(圖4D)和自噬體,自噬體內含有未被完全消化的殘余細胞器和胞質成分,即髓鞘樣小體(圖4F)。
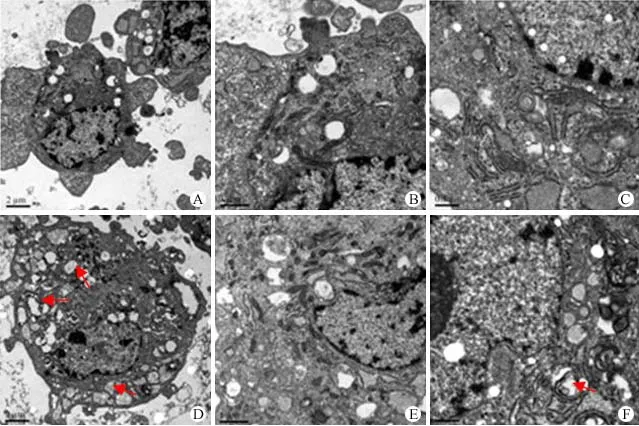
圖4 E2 作用后 MSC 細胞超微結構的變化(箭頭指向細胞空泡和自噬體) (A:對照組 10 000×;B:對照組 20 000×;C:對照組 40 000×;D:E2 組 10 000×;E:E2 組 20 000×;F:E2 組 40 000×)Figure 4 Changes of ultrastructure of MSC after treated with E2 (Arrows showed vacuoles and autophagosome) (A: Control 10 000×; B: Control 20 000×; C: Control 40 000×; D: Treat with E2 10 000×; E: Treat with E2 20 000×; F: Treat with E2 40 000×)
3 討論
細胞骨架在細胞的增殖,維持細胞形態(tài)、極性、內吞作用,胞內物質運輸,信號轉導,細胞活性,運動能力等方面起著重要作用。細胞骨架包括微管、微絲和中間絲三部分,分別與細胞膜上的蛋白質和脂分子相互連接,成為細胞運動、細胞形態(tài)和跨膜信息傳遞的基礎。F-actin 呈纖維狀,構成細胞內微絲骨架的主要部分,而 Arp2/3 復合物是構成F-actin 的結構基礎。微絲的肌動蛋白有兩種存在方式:一種是聚合態(tài)(F-actin),另一種是游離狀態(tài)(G-actin)。當細胞功能活躍時,F(xiàn)-actin 伸長通過其膜上黏著相關分子(肌動蛋白結合蛋白)介導,將肌動蛋白連接于細胞外基質,將軸突向此方向拉動。當不能與細胞外基質形成黏著類型的連接時,F(xiàn)-actin 解聚。這種解聚和聚合的變化與細胞的附著、運動、形態(tài)及細胞內外的信息傳遞等功能有關,為細胞內外信息傳遞提供分子橋梁,控制細胞形態(tài)、運動、增殖等生物效應[9]。微絲肌動蛋白的聚合和解聚隨著生理和病理條件發(fā)生改變,在本實驗中,用共聚焦顯微鏡未觀察到 F-actin 在分布和表達水平的變化。
Vinculin 是一種與黏著類型連接形成有關的細胞骨架蛋白,其作用是將 F-actin 錨著于連接點形成部位的細胞膜上。已有報道,在培養(yǎng)細胞的胞漿內有一紐蛋白池,其與膜聯(lián)的紐蛋白間形成動力學平衡[3-4]。通過這種平衡,來控制細胞的形態(tài)和運動能力。目前關于點狀連接部位紐蛋白分布及作用的報道很多,但關于胞漿內紐蛋白池在細胞超微結構的分布,至今未見報道。本實驗結果表明,正常情況下紐蛋白在靠近細胞膜側分布,認為是細胞與培養(yǎng)基質間形成黏著連接的部位,而胞漿內的紐蛋白呈均勻的網(wǎng)格狀分布,可能與微絲的分布相關。而經(jīng) E2 處理后,紐蛋白主要分布于胞漿中靠細胞核側。這種變化可能導致胞漿內紐蛋白池與膜聯(lián)的紐蛋白間動力學失衡。從而影響 MSC 的運動和趨化至病理部位的能力。
細胞的超微結構顯示了細胞中細胞器的形態(tài)、數(shù)量的變化,從而揭示了細胞的分裂、衰老和凋亡情況。透射電鏡的結果表明,正常 MSC 超微結構良好,細胞器較豐富,有完成最基本細胞功能的細胞器,如線粒體、核糖體、粗面內質網(wǎng)等。E2 處理后,MSC 超微結構則明顯出現(xiàn)了衰老和凋亡特征:細胞內出現(xiàn)了大量空泡(可能來源于線粒體腫脹變性),周圍出現(xiàn)雙層膜空泡結構,繼而雙層膜環(huán)繞成自噬體,進而與溶酶體融合、消化,形成自噬體不能消化的殘體。這些變化表明細胞的蛋白合成和有氧呼吸功能受到影響,大量細胞內具有較多的自噬體和消化未盡的髓鞘樣小體,表明這些細胞可能出現(xiàn)衰老現(xiàn)象,而其自身已經(jīng)開始了自我保護性反應。粗面內質網(wǎng)和線粒體數(shù)量反而增加,可能是細胞為了維持平衡出現(xiàn)的代償性增加。樸英杰等[10]首次提出了細胞自噬性凋亡的概念,闡明其為一種細胞自我保護反應。當細胞進入衰老階段或功能異常時,也可通過細胞凋亡來結束自身的生命。我們觀察到的細胞中也有自噬性凋亡現(xiàn)象的發(fā)生。總之,E2 存在的情況下,MSC 的超微結構和細胞骨架發(fā)生異常,這種異常可能與 E2 作用下 MSC的增殖、凋亡、貼壁以及遷移能力的變化有關。
[1]Kangaloo K, Jenkins L, Clarke N, et al.The effects of 17β-estradiol and tamoxifen on cell cycle distribution and F-actin espression in MCF-7 cells.J South Carolina Acad Sci, 2007, 4(1):1-12.
[2]Meng ZD, Pei FX, Shen B, et al.Efffects of 17β-estradiol (17β-E2) on the cytoskeleton and bone resorption of cultured osteoclasts in vitro.Chin J Bone Tumor Bone Dis, 2005, 4(2):94-98.(in Chinese)孟增東, 裴福興, 沈彬, 等.17β-雌二醇對破骨細胞骨架和骨吸收功能影響的實驗研究.中國骨腫瘤骨病, 2005, 4(2):94-98.
[3]Hong L, Krishnamachari Y, Seabold D, et al.Intracellular release of 17-β estradiol from cationic polyamidoamine dendrimer surfacemodified poly (lactic-co-glycolic acid) microparticles improves osteogenic differentiation of human mesenchymal stromal cells.Tissue Eng Part C Methods, 2011, 17(3):319-325.
[4]Zhao YL, Zhao XY, Sun LY, et al.Estrogen can alter the immuno-suppressive effects of MSC on DC via modulating MSC’s cytokine secretion.Chin J Immunol, 2010, 26(1):41-45, 50.(in Chinese)趙葉琳, 趙曉寅, 孫凌云, 等.雌激素通過調節(jié) MSC分泌細胞因子影響其對DC成熟與功能的抑制.中國免疫學雜志, 2010, 26(1):41-45, 50.
[5]Berger S, Sch?fer G, Kesper DA, et al.WASP and SCAR have distinct roles in activating the Arp2/3 complex during myoblast fusion.J Cell Sci, 2008, 121(8):1303-1313.
[6]Noegel AA, Schleicher M.The actin cytoskeleton of Dictyostelium: a story told by mutants.J Cell Sci, 2000, 113(Pt 5):759-766.
[7]Hu K, Ji L, Applegate KT, et al.Differential transmission of actin motion within focal adhesions.Science, 2007, 315(5808):111-115.
[8]Chen Y, Cho MR, Mak AF, et al.Morphology and adhesion of mesenchymal stem cells on PLLA, apatite and apatite/collagen surfaces.J Mater Sci Mater Med, 2008, 19(7):2563-2567.
[9]Koestler SA, Rottner K, Lai F, et al.F- and G-actin concentrations in lamellipodia of moving cells.PLoS ONE, 2009, 4(3):e4810.
[10]Piao YJ, Huang XX, Huo X, et al.Ultrastructura and cytochemical study of autophagic apoptosis of the rat lymphocytes.Acad J 1st Med Coll PLA, 1996, 16(3):165-171.(in Chinese)樸英杰, 黃行許, 霍霞, 等.淋巴細胞自噬性凋亡的超微結構細胞化學研究.第一軍醫(yī)大學學報, 1996, 16(3):165-171.

