烏蘇里江秋大麻哈魚(yú)生殖洄游群體結(jié)構(gòu)特征與分析
王繼隆,唐富江 ,朱 翥 ,潘志強(qiáng) ,劉 偉
(1.中國(guó)水產(chǎn)科學(xué)研究院黑龍江水產(chǎn)研究所,黑龍江 哈爾濱 150070;2.農(nóng)業(yè)部黑龍江流域漁業(yè)資源環(huán)境科學(xué)觀測(cè)實(shí)驗(yàn)站,黑龍江 哈爾濱 150070;3.黑龍江省撫遠(yuǎn)縣鮭魚(yú)放流站,黑龍江 撫遠(yuǎn) 156500)
大麻哈魚(yú)(Oncorhynchus keta Walbaum)是典型的溯河洄游魚(yú)類,幼魚(yú)春季降海、成魚(yú)秋季溯河洄游至出生地產(chǎn)卵直至生命終結(jié),終生只繁殖一次。其廣泛分布于白令海、北太平洋、鄂霍次克海、日本海及沿岸河流中[1],其中加拿大、美國(guó)、日本、俄羅斯數(shù)量分布較多。中國(guó)境內(nèi)的大麻哈魚(yú)可分為4個(gè)地方種群,即黑龍江、烏蘇里江、綏芬河、圖們江[2]。在烏蘇里江大麻哈魚(yú)幼魚(yú)春節(jié)隨水流降海,最終在黑龍江河口進(jìn)入鄂霍次克海,而后在西太平洋、白令海等進(jìn)入海洋生活階段,直至性成熟后上溯至出生地產(chǎn)卵繁殖。
國(guó)外學(xué)者對(duì)大麻哈魚(yú)洄游群體生物學(xué)特性進(jìn)行了較深入的研究[3-5],上世紀(jì)90年代學(xué)者研究發(fā)現(xiàn)太平洋大麻哈魚(yú)個(gè)體小型化及成熟年齡增大的現(xiàn)象,認(rèn)為影響因素包含環(huán)境因子、捕撈選擇性和種群壓力等[6-10]。近年來(lái)日本學(xué)者研究發(fā)現(xiàn)大麻哈魚(yú)小型化現(xiàn)象主要受到種間競(jìng)爭(zhēng)的影響[11-12]。中國(guó)對(duì)大麻哈魚(yú)資源調(diào)查也開(kāi)展了一些研究,成熟個(gè)體小型化等現(xiàn)象也逐漸被揭示[13-15]。但對(duì)大麻哈魚(yú)資源調(diào)查尚缺乏持續(xù)性和深入性,尤其是近幾十年來(lái)大麻哈魚(yú)資源增殖放流工作的不斷開(kāi)展,同時(shí)伴隨著捕撈強(qiáng)度的居高不下,大麻哈魚(yú)資源及種群結(jié)構(gòu)變動(dòng)趨勢(shì)更加難以預(yù)料。筆者對(duì)2010年烏蘇里江大麻哈魚(yú)回歸群體捕撈情況進(jìn)行了持續(xù)監(jiān)測(cè),并對(duì)其回歸群體數(shù)量結(jié)構(gòu)進(jìn)行分析,旨在了解大麻哈魚(yú)洄游群體數(shù)量結(jié)構(gòu)及生物學(xué)特征,為研究大麻哈魚(yú)資源提供參考。
1 材料與方法
1.1 調(diào)查時(shí)間及區(qū)域
該研究在大麻哈魚(yú)禁漁期(2010年10月1日到2010年10月20日)跟蹤調(diào)查6艘增殖放流親魚(yú)采捕船只作業(yè)情況。禁漁期增殖放流捕撈船只數(shù)量固定,且作業(yè)地點(diǎn)也統(tǒng)一集中在通江口江段(其他江段禁捕)。
烏蘇里江是一條中俄界河,發(fā)源于俄羅斯遠(yuǎn)東地區(qū)的錫霍特山脈,自南向北于黑瞎子島地區(qū)注入黑龍江,最終注入鄂霍次克海。洄游期大麻哈魚(yú)從黑龍江河口上溯至黑、烏交界處,然后分別游向黑龍江和烏蘇里江。研究調(diào)查地點(diǎn)位于黑龍江省撫遠(yuǎn)縣通江口江段(48.3°N,134.7°E)(圖 1),也是中國(guó)境內(nèi)大麻哈魚(yú)洄游至烏蘇里江的起點(diǎn)。
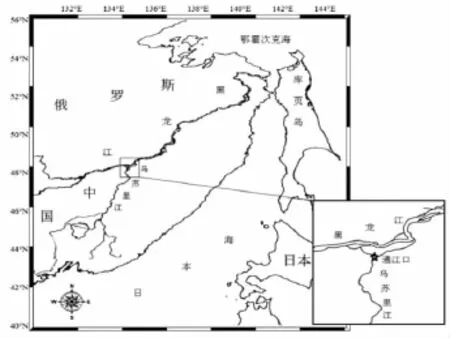
圖1 調(diào)查站點(diǎn)
1.2 數(shù)據(jù)收集
大麻哈魚(yú)捕撈網(wǎng)具為3層流刺網(wǎng),網(wǎng)目大小為12.67 cm,網(wǎng)高3.9m,長(zhǎng)約500m,作業(yè)時(shí)網(wǎng)具隨水漂流,同時(shí)網(wǎng)具下綱觸底。由于大麻哈魚(yú)捕撈船大小、主機(jī)功率及網(wǎng)具較為統(tǒng)一,所以單位捕撈努力量漁獲量(CPUE)統(tǒng)一為kg/(船·日),調(diào)查期間逐日統(tǒng)計(jì)了6艘捕撈船只捕獲雌、雄大麻哈魚(yú)質(zhì)量。在調(diào)查期間每天隨機(jī)收集一部分大麻哈魚(yú)樣本,共采集樣本505尾,其中雄魚(yú)237尾,雌魚(yú)268尾,測(cè)量體長(zhǎng)、體質(zhì)量,并采集背鰭末端至臀鰭之間且側(cè)線上方6~10枚鱗片供年齡鑒定。
1.3 處理方法
對(duì)6條漁船的雌、雄大麻哈魚(yú)產(chǎn)量進(jìn)行平均值處理,并根據(jù)雌雄個(gè)體平均質(zhì)量換算為雌雄個(gè)體數(shù)量。然后對(duì)收集的大麻哈魚(yú)樣本進(jìn)行測(cè)量,分別統(tǒng)計(jì)雌雄個(gè)體體長(zhǎng)、體質(zhì)量、年齡等生物學(xué)指標(biāo),并且通過(guò)方差分析判斷不同洄游時(shí)期的大麻哈魚(yú)的生物學(xué)指標(biāo)的差異性。
2 結(jié)果與分析
2.1 回歸群體數(shù)量特征
由于10月1日和10月20日捕撈船只的作業(yè)時(shí)間和其他日期作業(yè)時(shí)間不一致,故未將其統(tǒng)計(jì)在內(nèi)。回歸群體的數(shù)量特征反映了大麻哈魚(yú)的群體結(jié)構(gòu)特點(diǎn),具體特征如下。
從圖2可以看到禁漁期開(kāi)始時(shí)回歸群體的數(shù)量最多,10月9日處于低潮期,10月2日到9日基本成遞減趨勢(shì),10日到15日成遞增趨勢(shì),而后基本呈波動(dòng)下降趨勢(shì),直至漁期結(jié)束。該調(diào)查發(fā)現(xiàn)9月25日大麻哈魚(yú)開(kāi)始形成漁汛,隨后回歸數(shù)量增減增多。由于缺乏9月25日到10月1日的數(shù)據(jù),未能給出整個(gè)漁期的數(shù)量結(jié)構(gòu)圖,但從中也可看出大麻哈魚(yú)回歸數(shù)量出現(xiàn)兩個(gè)波峰,即10月初出現(xiàn)一次大高峰,10月15日出現(xiàn)一次小高峰。禁漁期過(guò)后大麻哈魚(yú)數(shù)量很少,已不能形成漁汛。因此,根據(jù)大麻哈魚(yú)洄游數(shù)量結(jié)構(gòu)將洄游期分為兩個(gè)階段,即10月10日前為第一階段,10月10日后為第二階段。
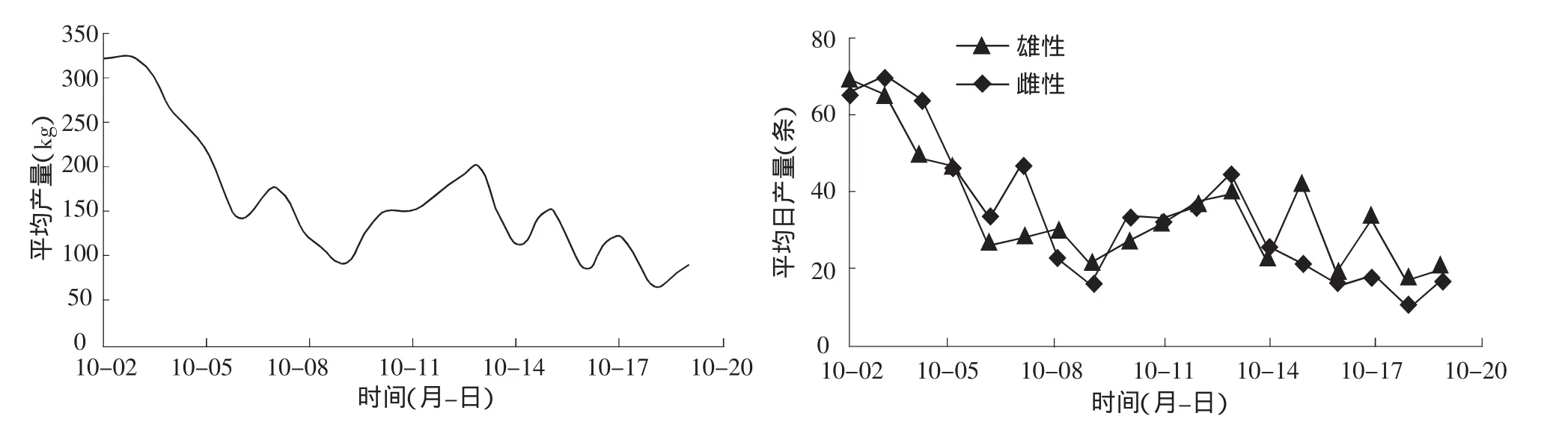
圖2 大麻哈魚(yú)日均產(chǎn)量及雌雄個(gè)體數(shù)量分布
在整個(gè)調(diào)查期內(nèi)大麻哈魚(yú)雌、雄個(gè)體數(shù)量比例為1.01∶1。從圖2也可以看出,雌、雄大麻哈魚(yú)的數(shù)量以及和總捕撈量變化趨勢(shì)基本一致,第一階段和第二階段大麻哈魚(yú)雌、雄個(gè)體間數(shù)量比例變動(dòng)是隨機(jī)的。
2.2 不同洄游期階段群體間的差異性分析
對(duì)洄游期兩個(gè)階段的大麻哈魚(yú)的各項(xiàng)生物學(xué)指標(biāo)(性比、叉長(zhǎng)、體質(zhì)量和年齡)進(jìn)行了方差分析(表1),方差分析結(jié)果p值均大于0.05,表明各指標(biāo)差異性均不顯著。
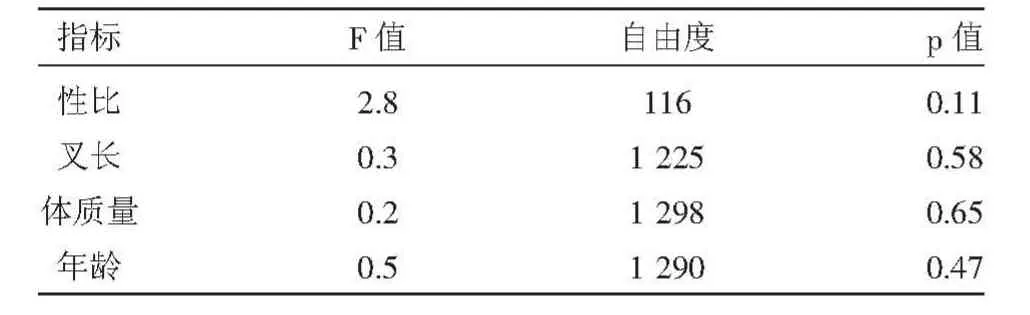
表1 兩洄游階段的大麻哈魚(yú)各項(xiàng)生物學(xué)指標(biāo)的方差分析
2.3 大麻哈魚(yú)洄游群體的生物學(xué)特征
2.3.1 年齡組成 總體上說(shuō),大麻哈魚(yú)年齡范圍為2+~4+齡,其中 2+占 42.8%、3+占 53.4%、4+占 3.8%,可見(jiàn)3+為優(yōu)勢(shì)年齡組。方差分析表明雌雄群體間的年齡組成差異顯著(p<0.01)。雄性個(gè)體中2+占53.4%、3+占 42.7%、4+占 3.8%,2+為優(yōu)勢(shì)年齡組;雌性個(gè)體中2+占 34.2%、3+占 62.1%、4+占 3.7%,3+為優(yōu)勢(shì)年齡組。可見(jiàn)雄性大麻哈魚(yú)成熟期比雌性要短。

表2 大麻哈魚(yú)的年齡組成 (%)
2.3.2 體長(zhǎng)、體質(zhì)量 大麻哈魚(yú)雌、雄性個(gè)體的叉長(zhǎng)、體長(zhǎng)、體質(zhì)量情況如表3所示,雄性個(gè)體平均叉長(zhǎng)、體長(zhǎng)、體質(zhì)量分別為60.6 cm、63.5 cm、2 309.5 g;雌性個(gè)體平均叉長(zhǎng)、體質(zhì)量分別為62.4 cm、65.5 cm、2 532.3 g。可見(jiàn),雄性個(gè)體平均體長(zhǎng)和體質(zhì)量都小于雌性個(gè)體。雄性個(gè)體叉長(zhǎng)、體質(zhì)量主要集中在 58~64 cm、2 150~2 750 g;雌性個(gè)體叉長(zhǎng)、體質(zhì)量主要集中在 59~65 cm、2 250~2 750 g。

表3 雌、雄大麻哈魚(yú)的體長(zhǎng)、叉長(zhǎng)、體質(zhì)量分布
3 討論
3.1 大麻哈魚(yú)生殖洄游群體數(shù)量特征
根據(jù)大麻哈魚(yú)回歸群體數(shù)量結(jié)構(gòu)特征,將洄游期分為10月10日前、后的兩個(gè)階段。而以往的研究將這兩個(gè)階段統(tǒng)一起來(lái),沒(méi)有深入?yún)^(qū)分[13,15],這種分期現(xiàn)象更能詳細(xì)反映實(shí)際捕撈狀況。不同洄游階段的大麻哈魚(yú)的各項(xiàng)生物學(xué)指標(biāo)方差分析表明其差異性并不顯著,這也說(shuō)明不同洄游期間的大麻哈魚(yú)只是數(shù)量結(jié)構(gòu)上的變化,生物學(xué)指標(biāo)沒(méi)有明顯差異。因此,這種數(shù)量的波動(dòng)可能是由不同洄游群體間的分散效應(yīng)造成。此外,俄羅斯在黑龍江河口對(duì)大麻哈魚(yú)回歸群體也有一定的捕撈,其對(duì)洄游至中國(guó)烏蘇里江的大麻哈魚(yú)數(shù)量有直接影響。
3.2 洄游群體生物學(xué)特征
3.2.1 成熟年齡低齡化 20世紀(jì)60年代以來(lái),洄游至中國(guó)大麻哈魚(yú)的性成熟平均年齡呈現(xiàn)是在波動(dòng)中下降趨勢(shì)(圖3),2010年大麻哈魚(yú)性成熟年齡較近幾年呈下降趨勢(shì)[13],并且達(dá)到歷史最低值。90年代國(guó)外有研究發(fā)現(xiàn)大麻哈魚(yú)性成熟年齡有升高的趨勢(shì)[16-17]。大麻哈魚(yú)種群分布的不同也會(huì)造成不同的結(jié)果[18]。對(duì)成熟年齡變化的原因研究相對(duì)較少,一直沒(méi)有明確的結(jié)論。漁業(yè)捕撈的持續(xù)選擇性會(huì)造成大麻哈魚(yú)性成熟年齡的降低[18-23],這是因?yàn)楦吣挲g魚(yú)個(gè)體大,被捕撈的風(fēng)險(xiǎn)也較大,所以漁業(yè)捕撈的長(zhǎng)期選擇性會(huì)使得性成熟年齡降低,但是成熟年齡大小的波動(dòng)卻不能完全解釋。
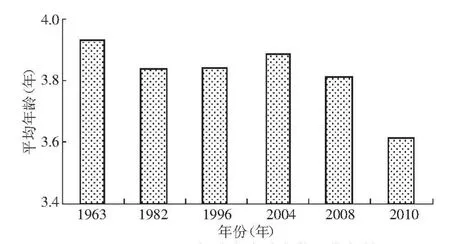
圖3 不同年份大麻哈魚(yú)的平均年齡
有學(xué)者通過(guò)模型模擬出大麻哈魚(yú)性成熟年齡和生長(zhǎng)速度之間的負(fù)相關(guān)關(guān)系[24]。20世紀(jì)90年代國(guó)外學(xué)者分析了大麻哈魚(yú)性成熟年齡變大和體長(zhǎng)減小的現(xiàn)象[10,16]時(shí),指出這是減緩生長(zhǎng)速度應(yīng)對(duì)環(huán)境變化的響應(yīng)[22]。根據(jù)這種理論,近年來(lái)烏蘇里江大麻哈魚(yú)成熟年齡的降低是由于生長(zhǎng)速度變快造成的,同樣可以解釋圖3中成熟年齡的波動(dòng)原因。然而在生態(tài)系統(tǒng)中影響大麻哈魚(yú)生長(zhǎng)速度的因素非常復(fù)雜,有遺傳因素和棲息地環(huán)境等因素共同影響。3.2.2 群體結(jié)構(gòu)小型化 2010年烏蘇里江秋大麻哈魚(yú)生殖洄游群體平均體長(zhǎng)、體質(zhì)量與歷史資料相比呈減小趨勢(shì),這也順延了20世紀(jì)60年代以來(lái)的總體下降趨勢(shì)(圖4)。一方面是因?yàn)槿后w年齡結(jié)構(gòu)的降低導(dǎo)致群體結(jié)構(gòu)小型化;另一方面就是生活環(huán)境導(dǎo)致魚(yú)類個(gè)體小型化,由于缺乏歷史資料,只能對(duì)此簡(jiǎn)單探討。
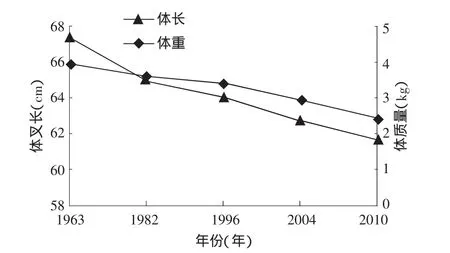
圖4 烏蘇里江大麻哈魚(yú)不同年份的平均叉長(zhǎng)和體質(zhì)量
國(guó)內(nèi)外對(duì)太平洋大麻哈魚(yú)體長(zhǎng)小型化現(xiàn)象也早有報(bào)道[16-18]。針對(duì)魚(yú)類小型化現(xiàn)象的原因,有研究發(fā)現(xiàn)和環(huán)境有相關(guān)關(guān)系,如溫度、鹽度等。但是成熟大麻哈魚(yú)體長(zhǎng)的連續(xù)下降不能完全用環(huán)境變化來(lái)解釋,捕撈選擇性所引起種群遺傳結(jié)構(gòu)的變化而造成的成熟群體小型化也是不容忽視的[7,19-20],捕撈活動(dòng)引起的高死亡率和個(gè)體大小的選擇性是引起魚(yú)類個(gè)體大小遺傳進(jìn)化的兩個(gè)因素[21-22]。隨著太平洋大麻哈增殖放流活動(dòng)力度的不斷增強(qiáng),大麻哈魚(yú)群體數(shù)量的不斷增加,由此帶來(lái)種間競(jìng)爭(zhēng)壓力的增大也是導(dǎo)致魚(yú)體小型化的因素之一。
據(jù)了解,中國(guó)在20世紀(jì)60年代曾在烏蘇里江對(duì)大麻哈魚(yú)進(jìn)行過(guò)增殖放流,之后基本上停止了這項(xiàng)活動(dòng),而俄羅斯對(duì)大麻哈魚(yú)放流也主要集中在黑龍江流域。因此,目前中國(guó)境內(nèi)烏蘇里江大麻哈魚(yú)基本上是天然種群。同時(shí)由于烏蘇里江大麻哈魚(yú)種群數(shù)量相對(duì)較少,在海洋中和其他大麻哈魚(yú)種群地理分布不同[,18],種間壓力相對(duì)較小。因此,種間競(jìng)爭(zhēng)不應(yīng)是大麻哈魚(yú)小型化的主要原因。而中國(guó)大麻哈魚(yú)的捕撈強(qiáng)度一直保持在較高水平,捕撈死亡率大于可開(kāi)發(fā)率從而造成漁業(yè)資源的衰退,同時(shí)捕撈網(wǎng)具對(duì)個(gè)體大的大麻哈魚(yú)選擇性較高,小個(gè)體魚(yú)類逃逸的可能性要大于大個(gè)體種類。因此,在中國(guó)捕撈選擇性應(yīng)該是造成大麻哈魚(yú)小型化的主要原因。
綜上所述,大麻哈魚(yú)成熟期體長(zhǎng)、體質(zhì)量、年齡的變化是環(huán)境因子、生物間的相互作用、選擇性捕撈的綜合作用的結(jié)果。在生態(tài)系統(tǒng)中,魚(yú)類小型化、成熟年齡變化可以說(shuō)是對(duì)周圍環(huán)境的一種響應(yīng),由于生態(tài)系統(tǒng)復(fù)雜性,很難確切說(shuō)明這些生物學(xué)特征變化的具體原因。因此,這方的研究需漁業(yè)生態(tài)研究學(xué)者的共同努力。
[1] Shigehiko U,Tomonori A,Penelope A,et al.Origin and Distribution of Chum Salmon in the Bering Sea during the Early Fall of 2002:Estimates by Allozyme Analysis[R].National Salmon Resources Center,Toyohira-ku,Sapporo 062-0922,Japan,2004.
[2] Chen JP,Sun D J,Dong C Z,et al.Genetic analysis of four wild chum salmon Oncorhynchus keta populations in China based on microsatellitemarkers[J].Environmental Biology of Fishes.2005,(73):181-188.
[3] Hideji T,Yasuaki T,Yasuhiko N.Behavioural thermoregulation of chum salmon during homingmigration in coastalwaters[J].The Journal of Experimental Biology.2000,(203):1825-1833.
[4] Manu E.Observations of spawning behaviour in Salmoninae:Salmo,Oncorhynchus and Salvelinus[J].Fish Biology and Fisheries.2005,(15):1-21.
[5] Manu E.Two examplesof fixed behavioural patterns in salmonines female false spawning and male digging[J].Japan Ethological Society and Springer-Verlag.2007,(25):63-70.
[6] Brian SB,David W W,John H H.A review of size trends among North PacificA review of size trends among North Pacific salmon(Oncorhynchus spp.)[J].Canadian Journal of Fisheries and Aquatic Sciences.1996,(53):455-465.
[7] Richard L.Fishing selection and phenotypic evolution[J].Journal of Marine Science.2000,(57):659-668.
[8] Shoko H M,Kentaro M,Hiroyuki S.Growth of chum salmon(Oncorhynchus keta)correlated with sea-surface salinity in the North Pacific[J].Journal of Marine Science.2001,(58):1335-1339.
[9] Ishida Y,Welch DW,Ogura M.Potential influence of North Pacific sea-surface temperatures on increased production of chum salmon(Oncorhynchus keta)from Japan[J].Climate change and northern fish populations.1995,(121):271-275.
[10] Ishida Y,Ito S,Kaeriyama M,et al.Recent changes in age and size of chum salmon (Oncorhynchus keta)in the North Pacific Ocean and possible causes[J].Fisheries and Aquatic Sciences.1993,(50):290-295.
[11] Hyunju S,Hideaki K,Masahide K.Spatiotemporal change in growth of two populations of Asian chum salmon in relation to intraspecific interaction[J].Fish Sci.2009,(75):957-966.
[12] Hyunju S,Hideaki K,Masahide K.Long-term climate-related changes in somatic growth and population dynamics of Hokkaido chum salmon[J].Environ Biol Fish.2011,(90):131-142.
[13] 董崇智,趙春剛,王 金,等.烏蘇里江大麻哈魚(yú)的溯河生殖群體結(jié)構(gòu)[J].中國(guó)水產(chǎn)科學(xué),1999,6(3):5-9.
[14] 趙春剛,潘偉志,陳 軍,等.2004年烏蘇里江大麻哈魚(yú)生殖群體結(jié)構(gòu)研究[J].水產(chǎn)學(xué)雜志,2005,18(2):59-64.
[15] 唐富江,劉 偉,徐鳳龍,等.黑龍江水系(中國(guó))秋大麻哈魚(yú)回歸群體變動(dòng)分析[J].上海海洋大學(xué)學(xué)報(bào),2010,19(1):74-79.
[16] Kaev A.Dynamics of some biological indexes of Oncorhynchus keta in connection with the formation of its numbers[J].Journal of ichthyology.1999,39(88):642-651.
[17] John H H,Margaret SH.Size decline and older age atmaturity of two chum salmon(Oncorhynchus keta)stocks in western North America[J].Fish Aquature.1995,(121):245-260.
[18] Shogo M,Shunpei S,Moongeun Y,et al.Nonrandom distribution of chum salmon stocks in the Bering Sea and the North Pacific Ocean estimated using mitochondrial DNA microarray[J].Fish Science.2009,(75):359-367.
[19] Ricker W E.Changes in the average size and average age of Pacific salmon[J].Journal of Fisheries and Aquatic Sciences.1981(38):1636-1656.
[20] David O C,Stephan BM.Sustaining Fisheries Yields Over Evolutionary Time Scales[J].Science.2002,297(5578):94-96.
[21] Terry D B,Clyde B M.A genetic analysis of body size in pink salmon(Oncorhynchus gorbuscha)[J].Genome.1988,(30):31-35.
[22] Kentaro M,Masa-aki F.Why age and size at maturity have changed in pacific salmon[J].Marine Ecology Progress Series.2007,(335):289-294.
[23] Jorgensen T.Long-term changes in age at sexual maturity of Northeast Arctic cod(Gadusmorhua L.)[J].Conseil International pour l'Exploration de la Mer.1990,(46):235-248.
[24] Morita K,Morita S,Fukuwaka M,et al.Rule of age and size at maturity of chum salmon(Oncorhynchus keta):implications of recent trends among Oncorhynchus spp.[J].Canadian Journal of Fisheries and Aquatic Sciences.2005,(62):2752-2759.

