股骨頭骨缺損表面積比與股骨頭塌陷預測的動物模型制備
蘇敬陽 侯勇 曹斌 韓永臺
股骨頭壞死(osteonecrosis of the femoral head,ONFH)是骨科一種常見病,致殘率高,挽救關節的措施非常重要[1]。早期診斷并對預后進行預測以選擇最佳治療手段,是達到保存股骨頭及髖關節功能的關鍵[2]。目前尚沒有軟骨下骨缺損表面積大小與股骨頭軟骨塌陷關系的動物模型報道。我們2005年1月至2006年5月采用環鉆鉆骨法造成軟骨下骨缺損,通過對股骨頭軟骨塌陷與軟骨下骨骨缺損表面面積大小的關系初步研究,探討股骨頭缺損的表面積與股骨頭軟骨塌陷的相關性。為臨床治療股骨頭壞死Ficat分期Ⅰ、Ⅱ期的髓芯減壓和(或)股骨頭和頸交界處開窗游離植骨治療提供理論依據,提高股骨頭壞死早期診斷,減少壞死塌陷發生率,推遲和減少股骨頭置換。
1 資料與方法
1.1 實驗動物 健康中國家兔30只,雌雄并用,兔齡5個月左右,體重(2.5±0.5)kg。
1.2 動物模型制備 麻醉(3%戊巴比妥納進行腹腔注射麻醉,劑量為25 mg/kg)生效后,取家兔右髖外側,股骨大粗隆為一縱行棘板,為參照作小切口,暴露股骨大粗隆下部,部分鑿出約5.0 mm直徑的骨窗,在C型臂引導下,分別選用不同直徑的環鉆,經骨窗沿股骨頸向股骨頭外上象限穿刺,距軟骨表面2.0 mm(切勿穿透關節軟骨)。再用1.0 mm的克氏針做一棉簽,分別蘸取12 mol鹽酸、氫氧化鈉緩慢涂抹股骨頭股缺損骨壁3遍,持續1 min,間隔15 min后,涂抹時嚴防化學物質外溢灼燒傷肌肉,觀察30 min后,依次縫合深筋膜及皮膚,術后肌內注射青霉素20萬U預防感染。
1.3 實驗分組 隨機分為A、B、C 3組,每組10只;A組,骨缺損直徑4.0 mm組;B組,骨缺損直徑5.0 mm組;C組,骨缺損直徑6.0 mm組。右側股骨頭用于復制骨缺損模型,左側為正常對照組。
1.4 觀察指標 (1)大體觀察:卡尺測量股骨頭大小,觀察股骨頭外形,關節面色澤(重點骨缺損區軟骨),光滑度,骨缺損區軟骨有無塌陷,測量塌陷的深度和范圍。(2)X線檢查:分別對術后16周實驗側肢體攝X線。(3)組織學觀察:軟骨下骨新骨生成情況及關節軟骨是否變性。按以下標準進行病理改變分級[3]:0級:無任何病理改變。Ⅰ級:骨髓壞死,骨小梁無壞死,有明顯的細胞溶解,核破裂,脂肪細胞核及邊界消失。Ⅱ級:除了Ⅱ級改變,同時有骨陷窩空陷,骨小梁及骨髓均壞死。
1.5 統計學分析 應用SPSS 10.0統計軟件,采用Spearman等級相關分析,P<0.05為差異有統計學意義。
2 結果
2.1 實驗兔的基本情況 30只兔術后均存活16周,每組10只,實驗側股骨頭直徑 6.6 ~8.8 mm,平均(7.99±0.8)mm。股骨頭截面為270°球冠,球冠面積的計算公式S=πR2(2+√2)(R為股骨頭半徑)求出股骨頭表面積,骨缺損表面(球冠)面積計算公式S1=2πR(R-√R2-r2)(r為骨缺損半徑),骨缺損壞死表面積比 =S1/S,A 組 S1/S=0.085±0.021,B組 S1/S=0.125±0.019,C 組 S1/S=0.190±0.014。見表1。
2.2 大體觀察 A、B組:股骨頭關節面光滑,軟骨瓣及周圍關節軟骨色澤基本正常,顏色近于正常軟骨面。僅3例軟骨向修復區塌陷。C組:軟骨瓣均有不同程度的塌陷,塌陷深度0.7~2.6 mm,軟骨瓣及周圍部分軟骨色澤灰白、質軟,無光澤,有細小的裂紋。
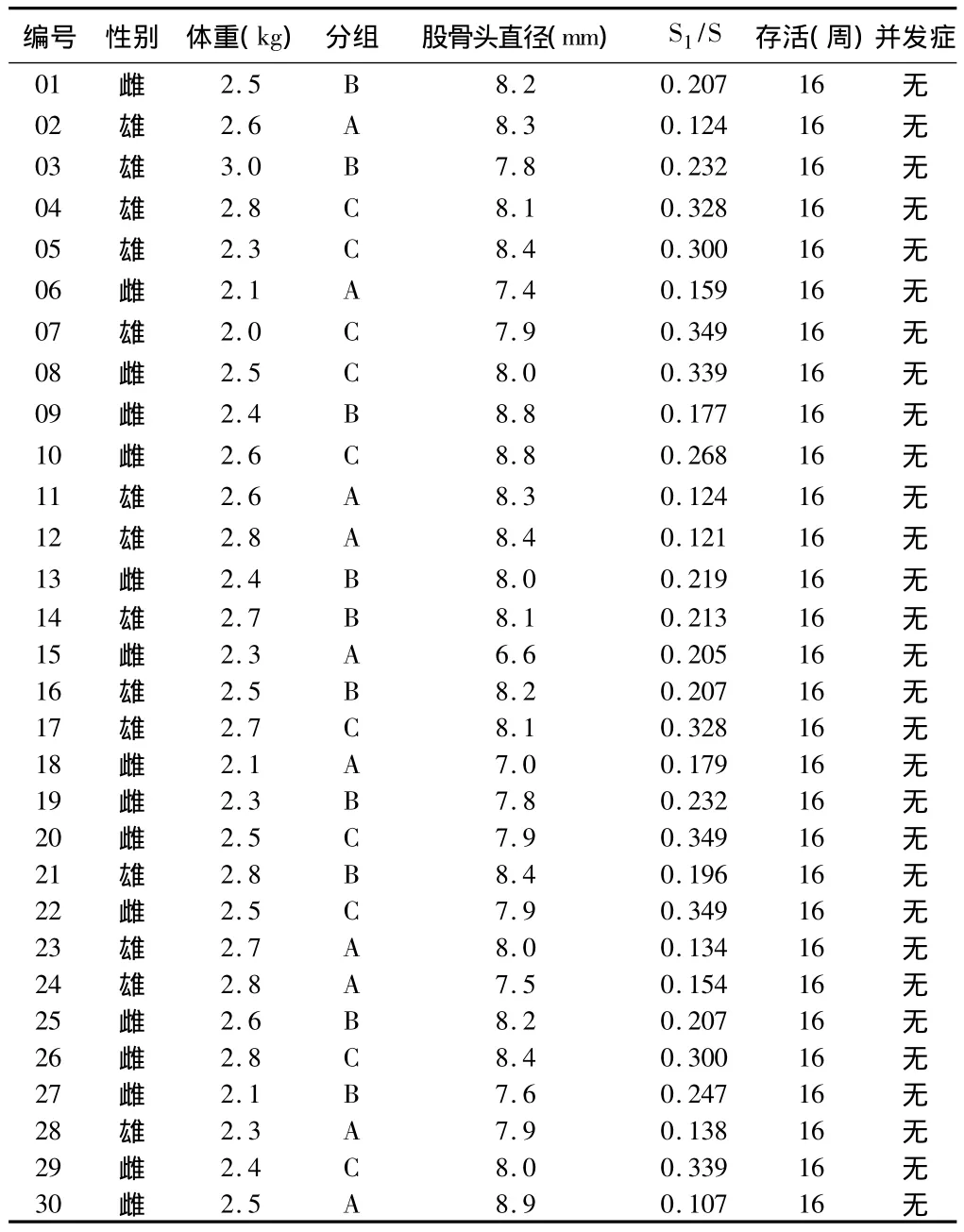
表1 實驗動物一般情況
2.3 X線觀察 16周時A組標本缺損區全部有生長的骨質填充,密度較均勻,未見軟骨塌陷。B組標本缺損仍存在,范圍已縮小。C組標本出現股骨頭軟骨下“新月征”改變。有骨小梁破壞,缺損區較前減少,出現股骨頭部分塌陷。
2.4 病理組織學光鏡檢查 A組:可見不同程度和范圍的血管-纖維結締組織增生,增生的組織中含成纖維細胞,成骨細胞和破骨細胞等。有明顯的新骨形成。B組:缺損區有軟組織填充,軟組織表面出現膠原纖維玻璃樣變,軟骨表面的纖維組織有部分變性壞死,無軟骨樣化生。骨小梁較粗,部分骨髓壞死,骨陷窩空陷存在;減壓區可見大量成纖維細胞增生,部分纖維成分長入壞死小梁間隙,軟骨表面的纖維組織變性壞死,未見毛細血管,骨陷窩空虛,骨小梁崩潰。C組:組織成分稀疏,骨小梁斷裂。壞死骨小梁見Howship陷窩,哈氏系統結構破碎、崩裂、骨板排列紊亂。關節軟骨增生區可見軟骨細胞壞死。陷窩內骨細胞消失,陷窩擴大。在軟骨細胞區有軟骨內化骨形成,有的軟骨增生肥厚,有的全層軟骨細胞消失,有的全層軟骨脫落骨面外露。見表2。
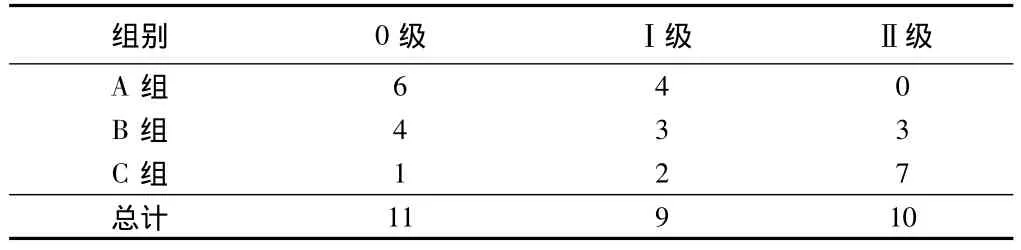
表2 股骨頭光鏡組織學病理分級結果 n=10,例
2.5 統計結果 RAB=0.241,RAC=0.757,RBC=0.692。A 組與B組差異無統計學意義(P>0.05);A組與C組,B組與C組比較差異有統計學意義(P<0.05)。分級與面積呈負相關,且分級加深則面積明顯增大。
3 討論
3.1 建立股骨頭軟骨下骨缺損及塌陷模型 近30年來,國內外學者為建立理想的骨壞死模型作了大量的工作[4-6]。可惜的是,沒有一種動物模型的組織學和形態學改變能夠完全模擬人的病理學改變。目前還缺乏一個滿意的模擬人類非創傷性骨壞死的模型。Mont等[7]“活門法”建立股骨頭壞死模型。選用健康成年雜交犬,切開關節囊,在股骨頭頸交界處鉆洞,刮除頭內大部分松質骨,模擬ONFH的動物模型進行研究。這一模型適合于開窗刮除死骨和髓芯減壓后植骨療法的治療研究。楊明亮等[8]采用12 mol/L鹽酸,12 mol/L氫氧化鈉依次注入家兔股骨頭內滅活骨細胞,骨髓組織及破壞股骨頭內的微循環,結果6周即可出現典型的骨壞死病理。因此,采用環鉆鉆骨法,造成不同直徑大小的軟骨下骨骨缺損,不直接損傷軟骨及軟骨下骨,克服“活門法”的不足,建立軟骨下骨修復時觀察軟骨塌陷的動物模型,并應用化學方法使頭內骨壞死,是一成功的模型。可以探討正常活動負重狀態下缺損區軟骨塌陷與骨壞死表面積定量的關系。
3.2 股骨頭壞死的定量測定,預測塌陷 目前診斷股骨頭壞死,預測塌陷主要依靠MRI。公認的壞死指數計算法[9]是在冠狀位正中和矢狀位正中斷面T1WI壞死邊緣劃線,測量壞死角,認為壞死指數33以上為塌陷危險,>66為塌陷高危。但此方法缺陷有:(1)將股骨頭截面最大角度定為180°,但實際為270°左右;(2)股骨頭壞死并非同心圓形壞死,多數壞死灶位于股骨頭前上部,而正中層面并非是最大的壞死面;(3)測量值仍為一個截面,未能真正反映壞死灶的全貌;(4)未與標本對照,僅憑回顧性分析,準確性值得懷疑[10]。Hernigou等[11]利用連續MRI圖像計算股骨頭壞死的體積,雖然計算出的壞死體積與實際標本的壞死體積相符,但壞死體積大,壞死區域較深者,并沒有出現塌陷。國內學者采用連續MRI圖像計算壞死表面積及壞死表面積比[12],與病理標本實際測量對照,結果一致,提出該法計算是準確的。并且生物力學研究顯示,股骨頭是否塌陷與承重面的壞死灶表面積大小密切相關。因此,提出測定股骨頭壞死表面積及壞死表面積比更有臨床價值。壞死表面積比33%為塌陷臨界值,>50%為塌陷高危。對壞死表面積比<33%者可采取非手術治療或進行觀察。而本實驗應用兔股骨頭內分別不同缺損壞死下觀察關節面塌陷,發現股骨頭缺損壞死表面積比<12.5%時軟骨下骨有很強的修復能力,有毛細血管及成骨細胞形成。而>19.0%時,明顯骨陷窩空陷存在,軟骨表面無軟骨樣化生,發生軟骨塌陷和壞死。與前者研究存在一定差別,可能與術中操作準確性有關。
3.3 股骨頭壞死骨周圍的應力集中是病情進展的主要原因應力集中可導致股骨頭內骨折,不僅影響局部力學性能,而且可阻斷壞死骨組織的修復,使負重區軟骨下骨難以得到骨性修復[6]。修復能力越強,生物力學變化越明顯,塌陷率越高[13]。特別是負重區軟骨下骨力學性能的降低與股骨頭壞死塌陷有直接的關系[14]。因此,認為判斷股骨頭壞死表面積<19.0%時,應密切觀察病情轉歸,保守治療;對>19.0%的 Ficat分期Ⅰ、Ⅱ期股骨頭壞死及時進行外科干預,采用髓芯減壓和(或)股骨頭和頸交界處開窗游離植骨治療,刮出頭下死骨時,應以刮出囊性變部分為主,盡可能減少軟骨下骨應力集中,薄弱軟骨下骨的機械支撐力,并大量植骨,術后避免股骨頭負重,減少壓力因素。是預防頭塌陷的關鍵。由于本實驗動物物種差異,數量有限,存在個體差異,手術過程減壓時造成骨缺損的位置偏移性,動物活動強度,人為造成頭下骨缺損等因素,有可能影響研究結果,這一結果是否有普遍意義,有待進一步研究證實,并為臨床治療起一定指導意義。
1 Mont MA,Hungerford DS.Nontraumatic avascular necrosis of the femoral head.J Bone Joint Surg(Am),1995,77:459-474.
2 Babis GC,Soucacos PN.Effectiveness of total hip arthroplasty in the man agement of hip osteonecrosis.Orthop Clin North Am,2004,35:359-364.
3 Brown TD,Baker KJ,Brand RA.Structural consequences of subchondral bone involvement in segemental osteonecrosis of the femoral head.J Orthop Res,1992,10:79-87.
4 Plenk HJr,Gstettner M,Grosss chmidt K,et al.Magnetic resonance imaging and histology of repair in femoral head osteonecrosis.Clin Orthop,2001,386:42-53.
5 Steinberg ME,Larcom PG,Strafford B,et al.Core decompression with bone grafting for osteonecrosis of the femoral head.Clin Orthop,2001,386:71-78.
6 Brown TD,Baker KJ,Brand RA.Structural consequences of subchondral bone involvement in segemental osteonecrosis of the femoral head.J Orthop Res,1992,10:79-87.
7 Mont MA,Jones LC,Elias JJ,et al.Strut-autograft with and without osteogenic protein-1:a preliminary study of a canine femoral head defect model.J Bone Joint Surg(Am),2001,82:1013-1022.
8 楊明亮,羅先正,王正明.實驗性動物股骨頭壞死模型的制備及其病理生理機制.中國骨傷,2000,13:207-208.
9 Koo KH,Kim R.Quantifying the extent of osteonecrosis of the femoral head.A new method using MRI.J Bone Joint Surg(Br),1995,77:875-880.
10 盧國強,喬義嶺,段瓊,等.成人股骨頭壞死塌陷前期的治療現狀.河北醫藥,2010,32:1625-1627.
11 Hernigou P,Lambotte JC.Volumetric analysis of osteonecrosis of the femur.Anatomical correlation using MRI.J Bone Joint Surg(Br),2001,83:672-675.
12 趙鳳朝,李子榮,張念非,等.股骨頭壞死表面積測量及在股骨頭塌陷預測中的應用.中國修復重建外科雜志,2005,19:687-691.
13 徐小良,王坤正,牒軍,等.實驗性股骨頸骨折修復過程的生物力學研究.中國矯形外科雜志,2001,8:680-682.
14 Kim YM,Lee FY,Lee SH,et al.Morphologic and biomechanical study of avascular necrosis of the femoral head.Orthopardic,1991,24:1111-1116.

