鋰離子電池電解液新型鋰鹽的研究進展
任永歡,吳伯榮,楊春巍,吳 鋒,2,陳飛彪
(1.北京理工大學化工與環境學院,北京 100081;2.國家高技術綠色材料發展中心,北京 100081)
如今鋰離子電池得到廣泛應用,由手機、筆記本電腦等電器所用電池而逐步應用到潛艇、航天及電動車等領域。鋰鹽作為電解液組成之一,使用性能優良的鋰鹽是獲得高比能量、高比功率、寬電化學窗口、長循環壽命和存儲壽命、良好安全性能及低溫性能的鋰離子二次電池的關鍵。它不僅是電解質中鋰離子的提供者,其陰離子也是決定電解質物理和化學性能的主要因素。目前商品化應用的LiPF6對水敏感,低溫生成的SEI膜阻抗過大,并由于其在80℃開始分解,導致鋰離子電池的高溫性能更是差強人意。因此國內外展開了大量對新型鋰鹽的研究。
鋰鹽可分為無機鋰鹽和有機鋰鹽。無機鋰鹽如LiPF6、LiBF4、LiClO4;有機鋰鹽包括螯合 B 類如 LiB(C2O4)2,螯合 P類如 LiP(C6H4O2)3,全氟膦類如 Li(RfPF5),烷基類如 LiC(CF3-SO2)3,磺酸鹽類如 CnF2n+1SO3Li,鋁酸鹽類如 Li3Al(CSO3Cl4),亞胺鋰如LiN(CF3SO2)2[1]。
鋰離子電池電解質對鋰鹽的要求有以下幾點:(1) 鋰鹽極性要強,以促進其在有機溶劑中的溶解;(2)陰離子與Li+的結合能要小,要為負電荷分散程度較高的基團,晶格能越小,鋰鹽越容易離解;(3)陰離子基團質量不能過大,否則會影響電池的比能量;(4)陰離子參與反應形成的SEI膜阻抗要小,并能夠對正極集流體實現有效的鈍化,以阻止其溶解;(5)鋰鹽本身有較好的熱穩定性和電化學穩定性;(6)可行的生產工藝以及有競爭力的性價比,對環境友好。
1 無機鋰鹽
1.1 LiBF4
在常溫電解液中LiBF4的應用較少,因其電化學穩定性低于LiPF6。由于其陰離子半徑小,易締合,由LiBF4組成的電解液電導率較小,在(EC+DMC)混合溶劑中的電導率也只有LiClO4電解液電導率的一半。
但研究表明LiBF4低溫性能良好。與LiPF6相比,以LiNiO2/石墨為電極的1 mol/L LiBF4/(PC+EC+EMC)(質量分數為1∶1∶3) 在低溫-30℃和-50℃分別可放出常溫放電容量的86%和20%;后者在-30℃只能放出76%,-50℃時已經無法放電。LiBF4熱穩定性高,對水不敏感,低溫電荷轉移電阻小,適合低溫和高倍率放電。基于這些低溫特性,研究人員又開始了對LiBF4的大量研究。由于LiBF4成膜性不好,常與成膜性能好的鋰鹽共同作用。
1.2 LiBF3Cl
用Cl取代LiBF4中的一個-F后,陰離子半徑會有所增大,由此可降低陰離子締合度,增大鋰鹽的溶解度,從而提高溶液的電導率;另外,由于結構的不對稱性增強,LiBF3Cl的熔點會更低。B-Cl比B-F更容易斷裂,釋放出的Cl-可以參加成膜反應,克服了LiBF4成膜性能不好的缺點。Zhang[2]通過X射線衍射(XRD)圖譜分析看出LiBF3Cl跟LiBF4具有相似的晶體結構。其研究表明,在質量比為3∶7的EC∶EMC組成的溶劑中,LiBF3Cl作為鋰鹽的Li/石墨電池的首次庫侖效率可以從LiBF4的82%提高到89.6%。同時還發現LiBF3Cl可以鈍化鋁箔保護其不受腐蝕。
由此可見,LiBF3Cl性能優于LiBF4,克服了后者溶解度低、成膜性不好等缺點,有望成為新型低溫鋰鹽應用于鋰離子電池電解液中。
1.3 LiX
LiF、Li2O和Li2O2合成簡單,成本低。但因其在碳酸酯類溶劑中幾乎不溶,一直被排除作為鋰離子電池的鋰鹽。但當三(五氟苯基)硼烷(TPFPB)或三(六氟異丙基)硼酸酯(THFPB)作為陰離子受體時,會大大增加LiX的溶解度,大約能達到2×10-3S/cm。其鋰離子的遷移數高達0.7,比同樣情況下用LiPF6、LiClO4或LiBF4作為鋰鹽都幾乎高出一倍[3]。鋰離子遷移數的提高可能會減小極化和改善庫侖效率。LiF、Li2O和Li2O2與正極都有很好的相容性和循環性。Li2O和Li2O2具有能在正極表面反應的獨特成膜性能,由此比LiF更優異。如在LiMn2O4為正極0.4 mol/L TPFPB+0.2 mol/L LiX/(PC+DMC)(體積比1∶1)的半電池中庫侖效率分別可達到92%和89%[4]。另外,以此三種鹽作為鋰鹽,也拓寬了電化學窗口范圍。LiF在(PC+EC+DMC)(體積比1∶1∶1)中的分解電壓超過了5.1 V。
但不足在于與負極的相容性不是很好,尤其是PC存在時不能在負極上生成穩定的SEI膜。解決辦法:(1)在溶劑中添加LiBOB作為成膜劑,實驗取得了很好的成果,負極可逆比容量可達到308 mAh/g左右[5];(2)PFPBO作為BBAR,因其結合了TPFPB與LiBOB的優點,也可解決PC共嵌的問題[6]。
由此可見,BBAR的出現,極大地提高了LiX類鹽用于電解液中的可能性。
2 有機鋰鹽
2.1 硼基類鋰鹽
硼基類鋰鹽對環境友好,其種類比較多,大致可以分為兩類:芳基硼酸鋰和烷基硼酸鋰。在諸多硼基類鋰鹽中,芳香硼酸鋰鹽電導率較低,分解電壓也較低,由此影響了其實際應用。烷基硼酸鋰鹽中最有應用前景的當屬LiBOB和LiDOFB。
2.1.1 LiB(C2O4)2(LiBOB)
LiBOB以硼原子為中心,呈現獨特的四面體結構。硼原子具有強烈的吸電子能力,由于B上的負電荷被周圍兩個草酸根上的八個氧原子高度分散,使陰陽離子鍵的作用力減小,由此使得LiBOB在有機溶劑中的溶解性增大。LiBOB高溫性能很好,LiPF6在50℃時已經不能正常循環,但換用LiBOB會在60、70℃依舊循環良好[7]。LiBOB的最大優點在于成膜性好[8]。
盡管具有諸多優點,但由于LiBOB研究年限比較短,其不足還有待研究。目前研究發現[7],LiBOB在線性碳酸酯中的溶解度不大;LiBOB對水比較敏感[9],目前批量生產的LiBOB的純度不達標。雜質的存在會增大SEI膜的阻抗,影響電池倍率放電功能[9],還會影響電池的循環使用壽命[10]。并且單獨使用LiBOB時電池低溫性能并不好,在-50℃已經無法放電[11]。由于LiBOB具有很強的吸濕性,所以大多數情況下都作為添加劑與其他鋰鹽共同使用。
(1)LiBOB與LiClO4
PC是很好的低溫共溶劑,但在PC存在的情況下單獨使用LiBOB或LiClO4作為鋰鹽效果都不理想[12]。圖1表明單獨使用LiBOB時,還原峰強度相對較弱,表明電池容量不足,研究認為這是由于Rct太大造成的。單獨使用LiClO4時PC發生了共嵌造成嚴重的石墨脫落,電池無法正常工作。

但如果在LiClO4中添加LiBOB后(摩爾比1∶50),在碳負極可有效形成SEI膜抑制分解,LiClO4的使用可以減小RSEI和Rct,保證電池容量不遜于常規電池。但不足之處在于循環性能有所降低[12]。
(2)LiBF4-LiBOB
LiBOB的添加可以有效地形成SEI膜,穩定電池性能。高溫下LiBOB生成的表面膜可以阻止Fe的溶解,由此可以提高鋰離子電池工作的高溫范圍[11]。使用石墨/LiNiO2電池配合1.0 mol/L(0.98LiBF4-0.02LiBOB)/(PC+EC+EMC)(質量比1∶1∶3)的電解液在-30℃和-40℃分別可以放出常溫容量的83%和63%[13]。應用Li/LiFePO4電極,相比于單獨使用Li-BOB在-50℃無法放電的情況,1.0 mol/L的0.9LiBF4-0.1Li-BOB/(PC+EC+EMC)(質量比1∶1∶3)的電解液仍可以放出常溫容量的30%。
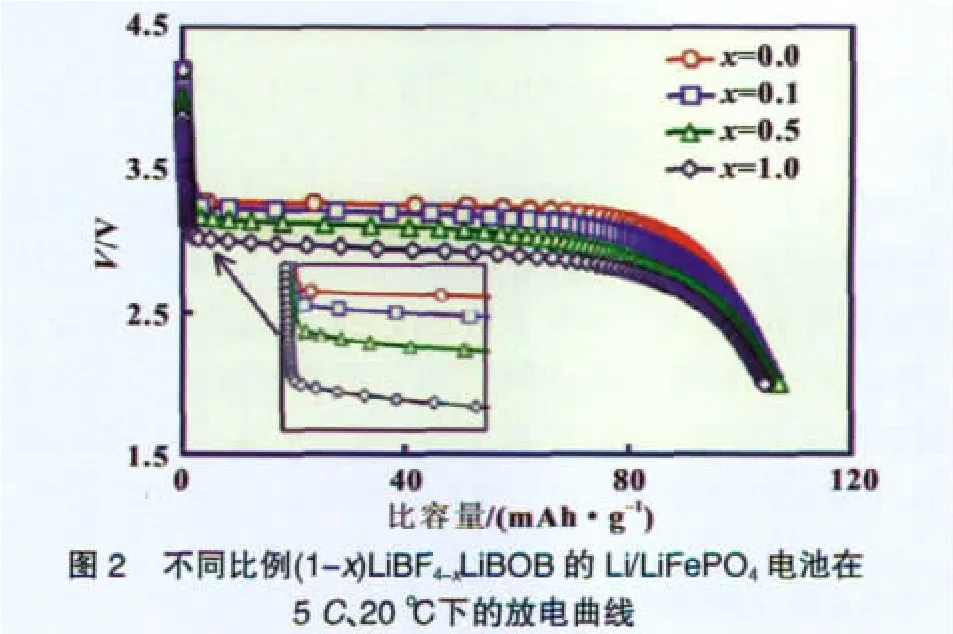
但LiBOB的含量不能過多。通過圖2放電曲線可以看出,隨著LiBOB的比例的增加雖然電池比容量沒有變化,但是放電平臺卻在降低。研究認為是LiBF4的減少導致Rct增大。不足之處的克服有待進一步研究。
2.1.2 LiBF2(C2O4)(LiODFB)
LiODFB結合了LiBOB成膜性好和LiBF4低溫性好的優點[14],在1.5 V左右會發生還原反應在碳負極生成SEI膜[15]。Zhang[16]的研究發現,草酸硼酸類鋰鹽的充放電曲線幾乎都在1.5 V左右有個平臺。Zhang分析認為平臺的出現是由于-CO-COOLi基團的還原,而雜質以及水的存在會造成ODFB-的開環形成更多的-CO-COOLi,會延長1.5 V這個平臺。Li-ODFB跟LiBOB相比,因只有一個草酸根,1.5 V的平臺會較短,這是用F-取代一個草酸根后的一個優點。
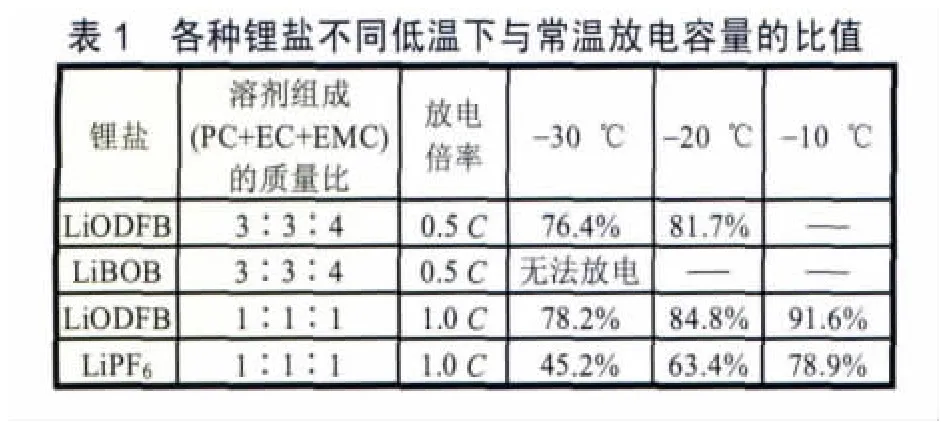
如表1所示,LiODFB的低溫放電性能明顯優于LiPF6和LiBOB[17]。LiDOFB跟正極也有很好的相容性,不僅能鈍化鋁箔而且能夠很好地抑制電解液的氧化。M.H.Fu等人[18]研究發現ODFB-陰離子可以捕獲溶解的Mn2+離子,生成致密的表面膜從而進一步阻止Mn2+的溶解。LiODFB的高溫性能也優于LiPF6。1.0 mol/L LiODFB溶于PC/EC/EMC(質量分數為30∶30∶40)的LiNiO2/石墨電池在60℃下循環200次后容量衰減<10%。LiODFB可提高電池的安全性能。其分解溫度為240℃,分解之后產生的CO2,可以在電池過充的情況下增大電池內壓,在熱涌發生前提供一個安全出口[16]。
LiODFB的這些優良性能展示了其替代LiPF6的可能性。但其常溫下的放電比容量相對較低,并且LiODFB的產業化也有一定的難度,作為新型鋰鹽還有待進一步探究。
2.2 磺酸鋰鹽
LiCF3SO3(LiTf)基的鋰鹽在有機液體電解液的應用中會出現腐蝕集流體的現象。但LiTf比較適合作為高溫鋰離子電池的離子液體電解液組成[19]。CF3SO3Li(LiTf),CF3SO3Na(NaTf),CF3SO3K(KTf)以0.5∶1∶1的摩爾比混合時,在250℃時的電化學窗口為4.7 V,在230~270℃電導率可達到10-2S/cm。TG/DTA研究表明,400℃下此種電解液依然保持著熱穩定性。與鹵化物和碘化物相比,LiTf顯示了作為電解質鹽的優越性。
2.3 烷基鋰鹽
LiC(SO2CF3)3不腐蝕集流體,熔點為271~273℃,熱分解溫度高達340℃以上。其電導率比其它有機陰離子鋰鹽均要高,在1 mol/L電解質溶液中可達1.0×10-2S/cm,溶于EC/DMC的電解質在-30℃都不發生凝固,且電導率仍可達到10-3S/cm以上,這主要歸結于其陰離子半徑較大,約0.375 nm,較易電離,其電化學窗口也在4.0 V以上。但是由于其合成困難、價格昂貴,限制了其廣泛應用。
2.4 亞胺鋰鹽
LiN(SO2CF3)2(LiTFSI)陰離子中的中酰胺N與強吸電子基團相連,使得N上的負電荷更加分散,更容易脫離出Li+。LiTFSI熱分解溫度超過360℃。LiTFSI能夠在MCMBs上形成低電阻、穩定的SEI膜,除第一次循環外幾乎每次充放電循環的庫侖效率都接近100%。在石墨/Li2FeSiO4電池中,LiTFSI在正極可以生成鈍化膜,不會像LiPF6一樣生成HF導致Fe的溶解[20]。盡管TFSI的大型陰離子會導致溶液的粘度升高,但電導率與LiPF6相當[21]。LiTFSI低溫情況下的電荷傳遞電阻小,相比LiPF6小一個數量級[21]。較小的電荷傳遞電阻保證了LiTFSI良好的低溫性能。
由于其腐蝕集流體,具體應用性能有待進一步研究。其他亞胺鋰鹽理論研究較多,但實際應用并不常見。
2.5 含P有機鋰鹽
該類鋰鹽的陰離子為含氟烷基及-F與P形成六配位的絡合物,或者為鄰苯二酚衍生物與P形成六配位的五元環螯合物。LiPF3(C2F5)3(簡稱LiFAP),-C2H5基團中的H被F取代后,形成強的吸電子基團,由此LiFAP會具有較低的HOMO,從而會有較好的抗氧化的穩定性。LiFAP具有同LiPF6相當的電導率和電化學穩定窗口,并且有比LiPF6好的穩定性不易水解,即使在10-3H2O的環境下依然穩定。隨著循環次數加大LiFAP的庫侖效率優勢更加明顯。研究表明,含LiPF3(C2F5)3的電解液的閃點會提高,可增大鋰離子電池的安全性,如在(EC+DEC+DMC)(質量分數40∶20∶40)組成的溶劑中,LiPF3-(C2F5)3作為鋰鹽的閃點可達到37.8℃,而LiPF6只有24℃。
3 展望
鋰鹽在鋰離子電池中作用非常重要,新型鋰鹽的開發仍是一個重要的研究方向。新型鋰鹽的研究一方面集中于對LiPF6的改進,嘗試研究新的取代基對LiPF6各種性能的改善情況。另一方面是尋找替代LiPF6的新型鋰鹽。以B為中心的硼基鹽類對環境友好,高低溫性能也良好,LiODFB是最有希望改善鋰離子電池性能的鋰鹽。
[1]薛照明,陳春華.鋰離子電池非水電解質鋰鹽的研究進展[J].化學進展,2005,17(3):399-405.
[2]ZHANG S S.LiBF3Cl as an alternative salt for the electrolyte of Li-ion batteries[J].Journal of Power Sources,2008,180:586-590.
[3]LI L F,LEE H S.New electrolytes for lithium on batteries using LiF salt and boron based anion receptors[J].Journal of Power Sources,2008,184:517-521.
[4]XIE B,LEE H S,LI H,et al.New electrolytes using Li2O or Li2O2oxides and tris-(pentafluorophenyl)borane as boron based anion receptor for lithium batteries[J].Electrochemistry Communications,2008,10:1195-1197.
[5]LI L F,XIE B,LEE H S,et al.Studies on the enhancement of solid electrolyte interphase formation on graphitized anodes in Lix-carbonate based electrolytes using Lewis acid additives for lithium-ion batteries[J].Journal of Power Sources,2009,189:539-542.
[6]LI L F,LEE H S,LI H,et al.A pentafluorophenylboron oxalate additive in nonaqueous electrolytes for lithium batteries[J].Electrochemistry Communications,2009,11:2296-2299.
[7]XU K,ZHANG S S.LiBOB:Is it an alternative salt for lithium ion chemistry?[J].Journal of Power Sources,2005,146:79-85.
[8]ZHANG S S,XU K,JOW T R.Enhanced performance of Li-ion cell with LiBF4-PC based electrolyte by addition of small amount of LiBOB[J].Journal of Power Sources,2006,156:629-633.
[9]YANGA L,FURCZONB M M,XIAO A,et al.Effect of impurities and moisture on lithium bisoxalato-borate(LiBOB)[J].Journal of Power Sources,2010,195:1698-1705.
[10]XU K,DEVENEY B,NECHEV K,et al.Evaluating LiBOB/Lactone electrolytes in large-format lithium-ion cells based on nickelate and iron phosphate[J].Electrochem Soc,2008,155(12):959-964.
[11]ZHANG S S,XU K.An improved electrolyte for the LiFePO4cathode working in a wide temperature range[J].Journal of Power Sources,2006,159:702-707.
[12]HIROAKI K,KYOICHI S,TAKAMURA T.Power capability improvement of LiBOB/PC electrolyte for Li-ion batteries[J].Journal of Power Sources,2005,146:142-145.
[13]ZHANG S S,XU K,JOW T R.Enhanced performance of Li-ion cell with LiBF4-PC based electrolyte by addition of small amount of LiBOB[J].Journal of Power Sources,2006,156:629-633.
[14]ZHANG S S,XU K.A new approach toward improved low temperature performance of Li-ion battery[J].Electrochemistry Communication,2002,4:928-932.
[15]GAO H Q,LAI Y Q.Electrochemical behaviors of new lithium salt LiBC2O4F2in EC+DMC solvents[J].Acta Physico-Chinmica Sinica,2009,25(5):905-910.
[16]ZHANG S S.An unique lithium salt for the improved electrolyteof Li-ion battery[J].Electrochemistry Communications,2006,8(9):1423-1428.
[17]鄧凌峰,陳洪.鋰電池用草酸二氟硼酸鋰有機電解液的電化學性能[J].無機化學學報,2009,25(9):1646-1650.
[18]FUA M H,HUANGA K L.Lithium difluoro(oxalato)borate/ethylene carbonate+propylene carbonate+ethyl(methyl)carbonate electrolyte for LiMn2O4cathode[J].Journal of Power Sources,2010,195:862-866.
[19]TU X H,CHU Y Q.New ternary molten salt electrolyte based on alkali metal triflates[J].Ionics,2010,16:81-84.
[20]ENSLING David.A comparative XPS surface study of Li2FeSiO4/C cycled with LiTFSI-and LiPF6-based electrolytes[J].Journal of Materials Chemistry,2009,19:82-88.
[21]MANDAL B K.New low temperature electrolytes with thermal runaway inhibition for lithium-ion rechargeable batteries[J].Journal of Power Sources,2006,162:690-695.

