腦卒中后抑郁癥臨床探討
查德喜
安徽銅陵市有色職工總醫院神經內科 銅陵 244000
腦卒中后抑郁(PSD)是腦血管病常見并發癥之一,其核心癥狀為情緒低落、興趣缺乏、樂趣喪失[1],并有焦慮、自責、妄想、自殺觀念等心理癥狀或出現軀體癥狀,如睡眠紊亂、食欲紊亂、精力喪失、晨輕夜重、性功能障礙等。它延長康復時間,加重認知功能損害,嚴重影響腦卒中患者的生活質量,增加腦血管疾病的致殘率和病死率,給患者家人和社會帶來沉重負擔。為探討腦卒中后抑郁癥的發生率及相關因素,筆者對2006-03~2010-03我院收治的腦卒中患者181例進行了臨床研究,現分析報道如下。
1 資料與方法
1.1 一般資料 入選患者為2006-03~2010-03我院收治的腦卒中患者181例,男100例,女81例;年齡54~76歲,平均(61.83±12.36)歲。其中腦梗死 110例,腦出血 71例。入選標準:①腦卒中的診斷:本組病人均參照全國第四屆腦血管病學術會議制定的腦血管疾病診斷標準,并均經頭顱CT、MRI證實;②抑郁癥的診斷標準:所有抑郁癥患者均符合中國精神疾病分類方案與診斷標準第3版修訂本(CCMD-3-R)及國際疾病分類第10版(ICD-10)和美國精神障礙診斷手冊第4版(DSM-W)的抑郁診斷標準。排除標準:腦卒中后病情嚴重或伴有意識障礙不能配合檢查者;伴明顯失語、失用不能配合檢查者;有嚴重認知功能障礙不能配合檢查者;有精神障礙者;合并嚴重心、肺功能衰竭或其他嚴重軀體疾病不能配合檢查者。
1.2 方法 采用抑郁自評量表(SDS)進行評定分組,SDS總分<30分為非抑郁組,≥30分為抑郁組。抑郁組應用漢密爾頓抑郁量表(HAMD)進行抑郁程度評定,總分<8分為正常,8~20分為可能抑郁,>20~28分為輕度抑郁,29~34分為中度抑郁,≥35分為重度抑郁。采用改良的愛丁堡斯堪的那維亞卒中量表(MESSS)進行神經功能缺損評定,0~15分為輕度,16~30分為中度,31~45分為重度[2]。
1.3 統計學處理 應用SPSS 12.0軟件進行單因素方差分析、F檢驗、χ2檢驗。腦卒中抑郁程度與神經功能缺損程度的關系做雙向有序資料Kendall等級相關檢驗。
2 結果
2.1 PSD的發生率 181例患者合并PSD 83例,發生率45.9%,其中輕度抑郁20例(11.05%),中度抑郁 28例(15.47%),重度抑郁 35例(19.34%)。
2.2 PSD的發生率與患者臨床資料關系比較 見表1。

表1 患者臨床資料與PSD的關系
2.3 PSD的發生率與卒中情況比較 見表2。

表2 病變情況與PSD的關系
2.4 腦卒中抑郁與神經功能缺損程度的關系 見表3。由表3可見神經功能缺損程度與卒中后抑郁程度有明顯相關性(χ2=4.531,P<0.01)。
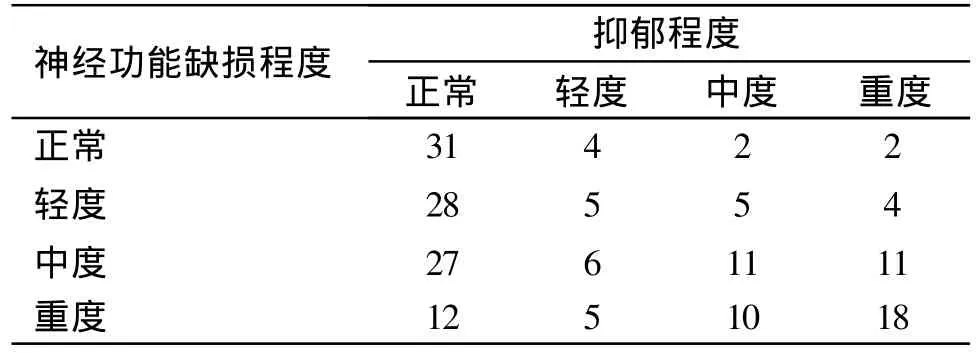
表3 腦卒中抑郁與神經功能缺損程度的關系
3 討論
腦卒中后抑郁(post-stroke depression,PSD)是腦卒中急性期后常見的并發癥,是腦卒中患者常見的心理障礙,在影響患者生活質量的同時,也在一定程度上延緩神經功能缺損的恢復,延緩日常生活活動能力和認知功能的恢復,延長患者住院時間,增加住院費用,且增加了卒中患者的病死率,此外還是病情加重或復發的獨立危險因素[3]。一直受到國內外學者的廣泛關注。
有關PSD的發病率,各研究差異很大,美國為20%~79%,但多數研究為30%~50%[4]。文獻報道PSD發生率有所差異,可能與病例選擇、病程、診斷標準不同有關。本研究發現腦卒中急性期PSD的發生率45.9%,與國內報道基本一致[5]。
腦卒中后抑郁的發病機制目前尚不清楚,多數研究認為與社會因素、神經生物學因素及神經內分泌因素有關[6]。以下兩種觀點受到多數學者認可:(1)源性學說認為,神經結構的各種功能活動主要是通過神經遞質實現的,腦卒中時,腦血流異常變化,神經細胞缺血缺氧,腦組織水腫軟化壞死,如引起邊緣系統、下丘腦及額極等控制自主神經系統和復雜情緒、認知功能、睡眠、覺醒的部位受損,并出現神經內分泌改變,特別是5-羥色胺(5-HT)類神經遞質、去甲腎上腺素遞質系統的失調,導致腦卒中后出現睡眠障礙、焦慮、抑郁等臨床表現。(2)反應性機制學說認為,卒中后家庭、社會、生理等因素綜合作用,導致生理和心理平衡失調,從而產生反應性抑郁。且腦卒中后遺留有不同程度的軀體功能障礙,帶來工作及生活能力的喪失,對PSD的發生起催化劑作用。兩種學說分別從神經生物學及心理學角度闡述了PSD的發病機制,但兩者并不沖突,在PSD的不同階段,兩者可同時存在,并相互影響,應予以綜合考慮。
PSD與腦卒中部位的關系一直充滿著爭議[7]。普遍認為與左半球,特別是額部的病變關系更為密切[8-9]。有研究提出左側半球前部損傷較其他部位損傷更易引發PSD,且抑郁程度更重,認為是損害了調節情緒的額葉-紋狀體-蒼白球-丘腦-皮質環路所致[10]。Starkstein等[11]認為 5-羥色胺(5-HT)和去甲腎上腺素(NE)能神經元位于腦干,其軸突向上輻射經過下丘腦、基底節和放射冠最終到達皮質時,纖維由前向后排列,故腦卒中時,病灶位于大腦半球前部,較后部更易損傷這些神經元而發生抑郁。Starkstein等[12]據此還推測,左側額葉和基底節腦卒中引起的5-HT能和NE能神經元破壞較右半球腦卒中輕,其相對較少的5-HT和NE水平的下降不足,以引起代償性的5-HT受體水平上調,故左側腦卒中較右側更易發生抑郁。Brody等[13]在利用PET對合并局部腦功能障礙的抑郁患者進行臨床試驗后發現,與邊緣系統相關的結構,尤其是左側額葉和左側基底節的代謝活動和血流明顯減慢。Kimura等[14]應用功能影像學(如SPECT、PET)對PSD患者進行研究發現,無論在抑郁發作期還是緩解期,PSD患者的局部腦血流均較非PSD患者減少,尤其在左前額區;PSD患者抑郁緩解期腦血流均較發作期增加,尤其在左前顳區。表明左額區持續低灌注可能導致抑郁發作期延長或復發率增加,左顳區活動也許是與抑郁發作有關的標志之一。本研究發現,大腦皮質額葉及皮質下基底節、丘腦的病灶更易出現抑郁,而左側病灶并更易發生PSD。據報道,重度抑郁與左側額葉和基底核的病變有關,輕度抑郁與枕葉和頂葉的病變有關,異常的興奮與右額葉病變有關。抑郁是一種情感障礙,大腦邊緣系統是情感活動的解剖生理學基礎,紋狀體-蒼白球-丘腦-皮質回路的功能障礙可能導致了抑郁癥。這條通路損害引起抑郁癥的機制是[15]:(1)直接損害額葉、背外側額葉和前扣帶回通路;(2)損傷了腦干上行到紋狀體-蒼白球-丘腦-皮質回路的單胺類神經遞質纖維;(3)基底神經節的損害導致眶額通路和前額葉的5-羥色胺功能紊亂。
神經功能缺損程度與抑郁的發生有明確的相關性,PSD是中、重度神經功能缺損的反映[16],腦卒中患者神經功能障礙程度越高越易發生抑郁。本研究結果顯示,神經功能缺損越重,日常生活自理能力越差,抑郁程度也越重,同時病情越重,對患者的刺激也越大,如果患者的心理應激能力差,則更易加重或誘發抑郁。與Anderson等[17]的報道與此相一致,這可能是由于軀體功能喪失,直接影響了大腦皮質對下丘腦內分泌系統的調節,造成遞質代謝紊亂而致病,這種患病后患者生理、心理平衡的失調被認為是PSD發生的“反應性機制”。
影響PSD的相關因素很多,本研究表明腦卒中危險因素中,高血壓、糖尿病、大動脈粥樣硬化對認知和情感活動的影響較大。伴該類危險因素的卒中患者PSD發病率明顯高于無危險因素患者(P<0.05)。性別差異與抑郁相關,女性更易抑郁,可能與女性心理負擔過重、生理因素及社會活動功能喪失或降低有關。宋文娟等報道<50歲患者的PSD發生率比50~65歲的卒中患者發生率高,與患病后喪失了原有的地位、職業、經濟來源,心理負擔增加有關。吸煙與PSD的發生關系不大(P>0.05)。PSD的發生嚴重影響了患者生活,給患者家庭社會帶來了嚴重后果,盡早認識PSD及其相關致病因素,并及早進行干預,可減少抑郁的發生和減輕抑郁的癥狀,以利患者神經缺損功能的康復,改善預后。
[1]吳江,賈建平,崔麗英.神經病學[M].北京:人民衛生出版社,2005:375-376.
[2]周穎,李宗友,陸景紅.中青年腦卒中后抑郁相關因素分析[J].蚌埠醫學院學報,2007,32(5):126.
[3]Tharwani HM,Yerramsetty P,M annelli P,et al.Recent advances in post-stroke depression[J]. Curr Psychiatry Rep,2007,9(3):225-231.
[4]吳宇浩,王少石.卒中后抑郁[J].國外醫學腦血管病分冊,2005,13(9):699-702.
[5]李志彬.老年期腦卒中后抑郁與病灶關系[J].臨床精神醫學雜志,2004,14(1):23.
[6]Gao Z,Lin QG,Jiang C. Study on the relative factions of poststroke depression in stroke acute phase[J].zhongguo linchuang kangfu(Clin JClin Rehabil),2002,6(13):1 890-1 893.
[7]Dafer RM,Rao M,Shareef A,et al.Poststroke depression[J].Top Stroke Rehabil,2008,15:13-21.
[8]Vataja R,Leppavuori A,Pohjasvaara T,et al.Post-stroke depression and lesion location revisited[J].J Neuropsychiatry Clin Neurosci,2004,16:156-162.
[9]Narushima K,Kosier JT,Robinson RG.A reapp raisal of post stroke depression,intra-and inter-hemispheric lesion location using meta-analysis[J]. J Neuropsychiatry Clin Neurosci,2003,15:422-430.
[10]Ny s GM,van Zandvoort MJ,van der Worp HB,et al.Early depresssive symp toms after stroke:neuropsy chological correlates and lesion characteristics[J].J Neurol Sci,2005,228:27-33.
[11]Starkstein SE,Mizrahi R,Power BD.Antidepressant therapy in p ost-stroke depression[J]. Expert Opin Pharmacother,2008,9:1 291-1 298.
[12]Stark stein SE,Manes F.Apathy and depression following stroke[J].CNSSpectr,2000,5:43-50.
[13]Brody AL,Saxena S,Mandelkem MA,et al.Brain metabolic changes associated with symptom factor imp rovement in major depressive disorder[J]. Biol Psychiatry,2001,50:171-178.
[14]Kimura MShimoda K,Mizumura S,et al.Regional cerebral blood flow in vascular depression assessed by 123I-IMP SPECT[J].J Nippon Med Sch,2003,70:321-326.
[15]王立偉,趙慶蓮.血管性抑郁癥臨床特征的比較研究[J].中國神經精神疾病雜志,2000,26(3):176-178.
[16]Pohjavaara T,Leppavuori A,Siifa I,et al. Frequency and clinical determinants of poststroke depression[J].Stroke,1998,29:2 311.
[17]Anderson G,Vestergaard K,Ingeman-Nielson MW,et al.Risk factors for dep ression after apoplexy[J].Ugeskr Laeger,1996,158(43):6 107-6 110.

