腦卒中急性期胃腸功能障礙患者血漿VIP水平變化的相關性研究
唐 明,楊秀麗,安朋朋,李玲玲,姜韞赟,李 倩
腦卒中急性期并發癥的涉及范圍很廣,其中胃腸功能障礙是腦卒中的常見并發癥之一[1]。隨著“腦腸相關”理論的提出,腦與胃腸相關性的研究已日益深入[2]。在消化道與腦之間,可能存在著未知的反饋與負反饋的聯絡網[3]。消化系統的功能除了受神經系統調節外,還與胃腸激素的調控有密切關系。近年來,血管活性腸肽(vasoactive intestinal peptide,VIP)作為一種腦腸肽,對神經系統及消化系統疾病的重要作用不斷被人們所認識。目前,對腦卒中胃腸功能障礙時血管活性腸肽水平及其變化研究報道較少,而且多為動物實驗研究,由于動物和人的種屬差異,血管活性腸肽對腦卒中急性期胃腸功能障礙的確切作用有待于更進一步的研究及探討。
1 資料與方法
1.1 臨床資料 觀察2009年3月—2009年10月入院的急性腦卒中患者192例(卒中組),均為發病6 h內入院并經CT或MRI確診。男性120例(62.5%),女性72例(37.5%),年齡25歲~96歲(69.02±0.93歲)。1周內出現胃腸癥狀者159例,無胃腸癥狀表現者33例。對照組為健康查體中老年人51名,無應激性胃腸癥狀表現,年齡43歲~79歲(60.41歲±1.14歲),男 30名,女 21名。
1.2 病例選擇
1.2.1 診斷標準 診斷符合1995年中華醫學會第四次全國腦血管病學術會議修訂的腦卒中診斷標準[4]。
1.2.2 納入標準 符合腦卒中診斷標準,觀察組病例均在發病6 h內入院。
1.2.3 排除標準 未經頭顱CT或M RI確診;發病24 h后入院;入院前病史資料不詳;入院前一周內服用過影響胃腸動力或胃酸分泌的藥物;合并癡呆或精神異常患者;合并帕金森氏病;既往有胃腸道疾病史;有嚴重的心、肝、腎等臟器及系統性疾病;合并惡性腫瘤;觀察期內出現病情明顯改變,或中途轉科、出院、不再同意參加本研究者。
1.3 檢查方法 觀察組于入院后翌日和1周后清晨空腹狀態下抽取靜脈血2 mL。注入預冷的含30 μ L 7.5%草酸鈉(EDTA-2Na)和40 μ L抑肽酶的試管中,充分混勻后4℃離心20 min,吸取血漿后置-70℃冰箱內保存待測VIP;應用測量儀器美國德普公司生產的 DPC-GAM MA-C12型γ計數器測定。VIP放免試劑由北方生物技術研究所提供。
1.4 統計學處理 應用SPSS 13.0軟件包進行分析,計量資料以均數±標準差(±s)表示,兩樣本均數比較采用成組設計的t檢驗,成組設計的多個樣本均數比較采用單因素方差分析。
2 結 果
2.1 卒中組不同時期VIP水平變化 與對照組相比,卒中組入院24h和入院1周時空腹血漿VIP水平均顯著升高(P<0.01)。卒中組患者入院1周時VIP水平較入院24 h呈降低趨勢(P>0.05)。詳見表 1。
表1 觀察組不同時期VIP水平變化(±s)pg/mL

表1 觀察組不同時期VIP水平變化(±s)pg/mL
組別 n 入院24 h 入院1周卒中組 192 206.01±9.861) 177.63±8.821)對照組 51 138.76±8.96 138.76±8.96與對照組相比,1)P<0.01
2.2 卒中組不同性別VIP水平 卒中組患者空腹血漿VIP水平男女對比無統計學意義。男性患者入院1周時VIP水平較入院24 h明顯降低(P<0.05)。女性患者不同時間VIP水平相比均未見明顯升高或降低。詳見表2。
表2 卒中組不同性別VIP水平對比(±s)pg/mL

表2 卒中組不同性別VIP水平對比(±s)pg/mL
性別 n 入院24 h 入院1周男性 120 216.29±14.03 167.72±11.171)女性 72 188.86±11.83 185.82±14.41與入院24 h相比,1)P<0.05
2.3 胃腸癥狀組、無胃腸癥狀組及正常組VIP水平 與無胃腸癥狀組相比,胃腸癥狀組VIP水平不同時間均無統計學意義。胃腸癥狀組入院1周時VIP水平較入院24h明顯降低(P<0.05)。與正常組相比,胃腸癥狀組VIP水平各時間均顯著增高(P<0.01);無胃腸癥狀組僅入院24 h VIP水平較胃腸組顯著偏高,入院1周與正常組相比無統計學意義。詳見表3。
表3 3組VIP水平(±s)pg/mL
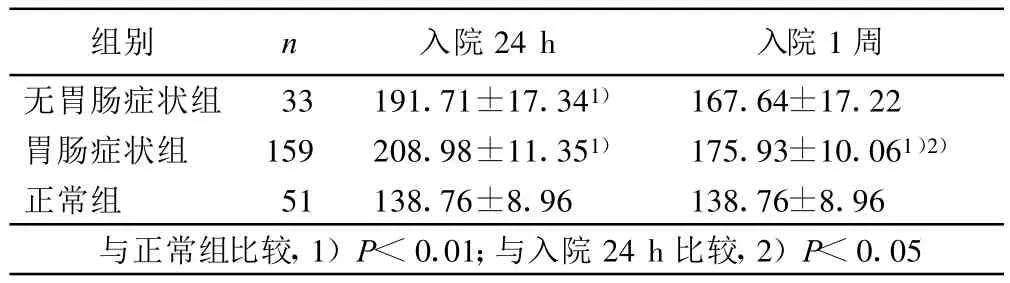
表3 3組VIP水平(±s)pg/mL
組別 n 入院24 h 入院1周無胃腸癥狀組 33 191.71±17.341) 167.64±17.22胃腸癥狀組 159 208.98±11.351) 175.93±10.061)2)正常組 51 138.76±8.96 138.76±8.96與正常組比較,1)P<0.01;與入院24 h比較,2)P<0.05
2.4 胃腸出血組、非胃腸出血組及正常組VIP水平對比 與正常組相比,非胃腸出血組入院24 h及入院1周時VIP水平均明顯增高,而胃腸出血組僅入院24 h VIP水平較正常組有明顯增高(P<0.01)。胃腸出血組與非胃腸出血組相比不同時間VIP水平未見明顯差異;此外,胃腸出血組入院1周時較入院24 h VIP水平呈下降趨勢。詳見表4。
表4 3組VIP水平(±s)pg/mL

表4 3組VIP水平(±s)pg/mL
組別 n 入院24 h 入院1周胃腸出血組 19 232.85±41.521) 156.97±14.48非胃腸出血組 140 205.74±11.631) 178.50±11.251)正常組 51 138.76±8.96 138.76±8.96與正常組比較,1)P<0.01
3 討 論
正常情況下胃腸道神經遞質通過神經-免疫-內分泌網絡與胃腸激素、細胞因子等相互調控,使胃腸道功能處于動態的平衡中。VIP作為一種存在于胃腸道神經元中的非膽堿能非腎上腺素能神經介質[5],在胃腸消化吸收及內分泌功能中起重要的調節作用。VIP是腸神經系統的抑制性傳遞介質,對胃腸動力起抑制性調節作用,可通過直接作用于胃腸平滑肌上的VIP受體發揮作用,特別是抑制腸的緊張性。它是參與腸蠕動調控的重要成分之一[6],同時亦對胃腸黏膜具有保護作用;此外,在一些氧化性損傷和細胞毒損傷中,VIP具有很強的營養神經和促進細胞存活作用[7,8],可能與其促進腦源性神經營養因子mRNA的表達有關。VIP除通過促進活性依賴性神經營養因子(ADNF)的分泌[9]、蛋白激酶 A等途徑發揮作用外[10],還可提高神經細胞對應激反應的耐受性[11]。體外實驗顯示VIP能提高培養的星形膠質細胞(AS)攝取谷氨酸的能力,對抗谷氨酸誘導的細胞死亡[12,13],提示VIP在腦缺血性損傷中具有神經保護作用,其作用可能是通過AS的介導來實現的,但仍缺少足夠的活體實驗證據,具體作用機制有待闡明。
本結果顯示,腦卒中急性期患者入院24 h血漿VIP水平較正常組明顯升高,1周時VIP較前下降。腦卒中急性期VIP含量升高,其機制尚不清楚。腦卒中急性期在自身保護機制的啟動下,VIP釋放與特異受體結合發揮生理功能,可增加促腎上腺皮質激素(ACTH)分泌[14];增強舒張血管作用,參與休克、再灌注損傷、急性缺氧等病理過程的發生發展[15],以調節腦及胃腸血管壓力的應激性反應;提高神經細胞對應激反應的耐受性。
無胃腸癥狀組1周時VIP水平與正常組無統計學意義,胃腸癥狀組1周時VIP水平卻仍明顯偏高于正常組,可推測腦卒中急性期患者胃腸功能障礙可能與VIP的高水平有關。VIP作為一種胃腸運動抑制性遞質,急性腦卒中時,VIP異常分泌增多,胃的運動受到抑制,胃排空減慢,胃酸在胃內存儲時間延長,增加了胃酸對胃壁的消化作用,從而相對削弱了胃黏膜防御能力,使胃酸的消化作用與胃黏膜防御能力之間失去平衡,從而加速了應激性潰瘍等胃腸疾病的形成。
此外,胃腸出血組入院1周時VIP水平已降到正常水平,而非胃腸出血組入院1周時VIP水平仍高于正常組。可見胃腸出血組VIP下降趨勢較非胃腸出血組明顯,即不同的胃腸癥狀表現形式可能與VIP升降的幅度有關。
本研究表明,急性腦卒中可使VIP水平分泌增加,發病1周后,繼發胃腸功能障礙患者血漿VIP仍處于高水平。提示血漿高VIP水平與腦卒中及繼發胃腸功能障礙具有一定的相關性。因此,早期動態監測血漿VIP水平變化,對腦卒中急性期繼發胃腸功能障礙的診斷、評估均有重要的參考價值。同時VIP影響腦與胃腸的發病機制有待進一步深入研究。
[1]Kitamura T,Ito K.Acute gastric changes in patients with acute stroke[J].Stroke,1976,7(5):464-468.
[2]Bonaz B.Brain-gut interactions[J].Rev Med Interne,2010,31(8):581-585.
[3]Lechin F,van der Dijs B.Central nervous system plus autonomic nervous system disorders responsible for gastrointestinal and pancreatobiliary diseases[J].Dig Dis Sci,2009,54(3):458-470.
[4]中華神經科學會,中華神經外科學會.各類腦血管疾病診斷要點[J].中華神經科雜志,1996,29(6):379-380.
[5]Tomita R.Regulation of vasoactive intestinal peptide and substance P in the human pyloric sphincter[J].Hepatogastroenterology,2009,56(94-95):1403-1406.
[6]Chandrasekharan B,Anitha M,Blatt R.Colonic motor dy sfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress[J].Neurogastroenterol M otil,2010,10(1111):1365.
[7]Koh SW,Waschek JA.Corneal endothelial cell survival in organ cultures under acute oxidative stress:Effect of VIP[J].Invest OphthalmoⅣis Sci,2000,41(13):4085-4092.
[8]Gressens P.VIP neuroprotection against excito toxic lesions of the developing mouse brain[J].Ann NYA Cad Sci,1999,89:7109-7124.
[9]Gozes I,Brenneman DE.A new concept in the pharmacology of neuroprotection[J].J Mol Neurosci,2000,14(1-2):61-68.
[10]Li L,She H,Yue S,et al.Vasoactive intestinal peptide induces surfactant protein A expression in ATⅡcells through activation of PKC/c-Fos pathway[J].Peptides,2010,31(11):2046-2051.
[11]Abad C,T an YV,Lopez R,et al.Vasoactive intestinal peptide loss leads to impaired CNS parenchymal T-cell infiltration and resistance to ex perimental autoimmune encephalomyelitis[J].Proc Natl Acad Sci USA,2010,107(45):19555-195560.
[12]Brown DR.Neuronal release of vasoactive intestinal peptide isimportant to astrocytic protection of neurons from glutamate toxicity[J].M ol Cell Neurosci,2000,15(5):465-475.
[13]Onoue S,Endo K,Yajima T,et al.Pituitary adenylate cyclase-activating polypeptide and vasoactive intestinal peptide attenuate glutamate-induced nNOS activation and cytotoxicity[J].Regul Pept,2002,107(1-3):43-47.
[14]Whitworth EJ,Kostio,Renshaw D,et al.Adrenal neuropeptides:Regulation and interaction with ACTH and other adrenal regulators[J].Microse Res T ech,2003,61:259.
[15]羅曉陽,張翔,王嘉軍,等.納洛酮對腦損傷大鼠血漿及海馬勻漿中VIP的影響[J].中國危重病急救醫學,1996,8(11):641-642.

