TiO2納米管陣列光電催化氧化處理氨氮廢水
李丹丹 劉中清 顏 欣 鄭 劍 劉 旭
(四川大學化學工程學院,成都 610065)
TiO2納米管陣列光電催化氧化處理氨氮廢水
李丹丹 劉中清*顏 欣 鄭 劍 劉 旭
(四川大學化學工程學院,成都 610065)
用電化學陽極氧化法制備了高度有序的鈦基二氧化鈦納米管陣列薄膜。用場發射掃描電鏡(FE-SEM)、X射線衍射(XRD)表征樣品的形貌與晶型特征。以二氧化鈦納米管陣列為光陽極,石墨為對電極,測試了不同pH值和外加偏壓條件下的光電流響應和光電催化氧化降解NH4Cl水溶液(以N計,100 mg·L-1)的效率。結果表明:所制備的TiO2納米管陣列具有銳鈦礦和金紅石的混晶結構,且主要晶型為銳鈦礦。光電流響應的強弱與光電催化氧化效率的高低相對應,降解氨氮廢水的最佳條件為pH= 11,偏壓為1.0 V。
TiO2納米管陣列;光電催化氧化;光電流響應;氨氮廢水
來源于工業廢水以及生活廢水中的氨氮正影響著我們人類以及動植物的正常生活。大量的氨氮廢水未經處理或未達到標準直接排放到江海湖泊中,會造成水體富營養化,發生目前越來越常見的赤潮現象。大量的藻類植物的生長還使得水中溶解氧的濃度降低,這無疑對水體中生長的魚類及水生生物構成嚴重的威脅。同時,在污水處理過程中,氨氮會對某些金屬管道,尤其是銅管道產生腐蝕作用。另外,管內還容易形成生物垢,這不僅容易堵塞管道,還影響了熱交換的效率[1-3]。
常見的處理氨氮廢水的方法主要有物化法、化學法和生物法。近年來新興了一種將光化學氧化和電化學氧化方法相結合的一種高級氧化技術[4-10]。TiO2因其性質穩定、安全無毒、容易制備以及具有優良的光電催化性能,常用作光電催化的半導體材料。但是,目前的研究主要基于TiO2粉體或者多孔薄膜的光催化或光電催化處理技術[4,7-8-11]。 如果要提高TiO2粉體或者多孔薄膜的利用率,就需要用載體將其固定,因此增加了重復利用的難度。
TiO2納米管陣列比TiO2納米粉體具有更大的比表面積和更優良的光電催化性能,用陽極氧化法在鈦基底上制備出的TiO2納米管陣列不存在與載體難分離的難題。因此具有更好的應用前景和工業價值。目前將TiO2納米管陣列應用于氨氮廢水處理的報道還很少見[11]。本工作以陽極氧化法制備的TiO2納米管陣列薄膜為光陽極,采用光電催化氧化技術來處理實驗室模擬的氨氮廢水,研究了光電催化氧化過程中溶液的pH值以及偏壓對催化效果的影響。
1 實驗部分
1.1 TiO2納米管陣列的制備
陽極氧化法制備TiO2納米管陣列參照前期工作[12-14]。以0.5wt%NH4F+0.2wt%HF+2wt%H2O的丙三醇溶液為電解液,以經打磨、拋光等處理過的工業純鈦片(99.9%,120 mm×60 mm×0.5 mm)為陽極,高純石墨為陰極,采用恒壓氧化方法,在兩電極的有機玻璃電解槽中進行,條件為:(10±2)℃,50 V,6 h;將所得陽極反復用無水乙醇和蒸餾水清洗,隨后在馬弗爐中350℃熱處理2 h,接著將超聲波的功率設置為40 W,在10%H2O2的清洗液中超聲清洗1 h,然后在馬弗爐中以10℃·min-1的升溫速率升溫至500℃熱處理2 h,得到鈦基二氧化鈦納米管陣列。
1.2 TiO2納米管陣列的表征
用FEI公司的Inspect F型場發射掃描電鏡(FESEM)觀察TiO2納米管陣列的形貌;用Philips XPert pro MPD型X衍射儀(XRD)(激發光源為Cu Kα(λ= 0.154 06 nm)靶電壓40 kV,電流40 mA,連續掃描方式,掃描范圍為2θ=20°~80°,入射光發散狹縫為0.5°,未使用平行光單色器,無衍射光路防反射狹縫,接收狹縫為0.3 mm,使用位敏探測器)表征TiO2納米管陣列的物相組成;光電流響應在兩電極的矩形石英槽中進行,400 W高壓汞燈為光源,光源距離工作電極20 cm,溫度25±2℃,100 mg·L-1NH4Cl(以N計)為電解液,用5%NaOH調整溶液的pH值,使用LC-100 A/L型智能測控儀記錄光電流響應。
1.3 氨氮廢水的光電催化降解
光電催化降解在長方形(75 mm×35 mm×120 mm)的石英玻璃槽中進行,GY-400型400 W的高壓汞燈為光源,光源與工作電極的距離為20 cm,以所制備的鈦基二氧化鈦納米管陣列為工作電極,石墨為對電極,WYK-603型直流穩壓穩流電源為工作電源,100 mg·L-1NH4Cl(以N計)水溶液為目標污染物溶液,控制降解過程溫度25±2℃,并用空氣攪拌,流量為2.5 L·min-1。采用納氏試劑分光光度法測定溶液中總氮的濃度。研究偏壓和pH值對光電催化降解效果的影響。
2 結果與討論
2.1 TiO2納米管陣列膜的表征
圖1為丙三醇體系中陽極氧化法制備的TiO2納米管陣列在空氣中經500℃熱處理2 h后的FESEM圖片。由此看出,在此實驗條件下制備的TiO2納米管陣列排列高度有序、管徑均勻、管口未被堵塞。管徑(外徑)約160 nm、管壁約40 nm、管長約為15 μm,其中長徑比可達937。
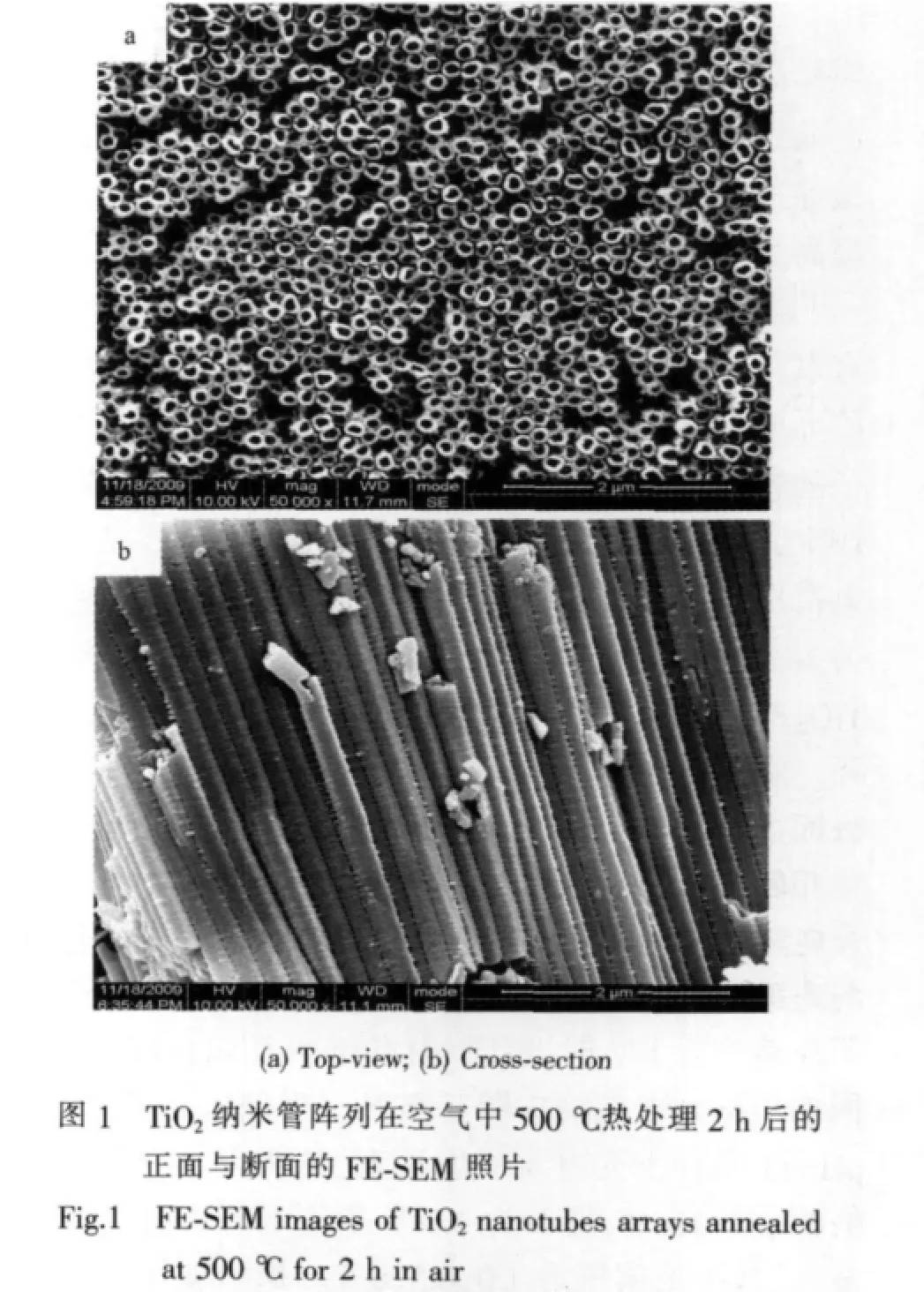
圖2為TiO2納米管陣列在空氣中500℃下熱處理2 h后的XRD圖。由圖2可見,除了明顯的鈦基底峰外,還有銳鈦礦和金紅石的衍射峰共同存在,且相對于銳鈦礦相,金紅石的衍射峰強度很弱。根據公式[15]:
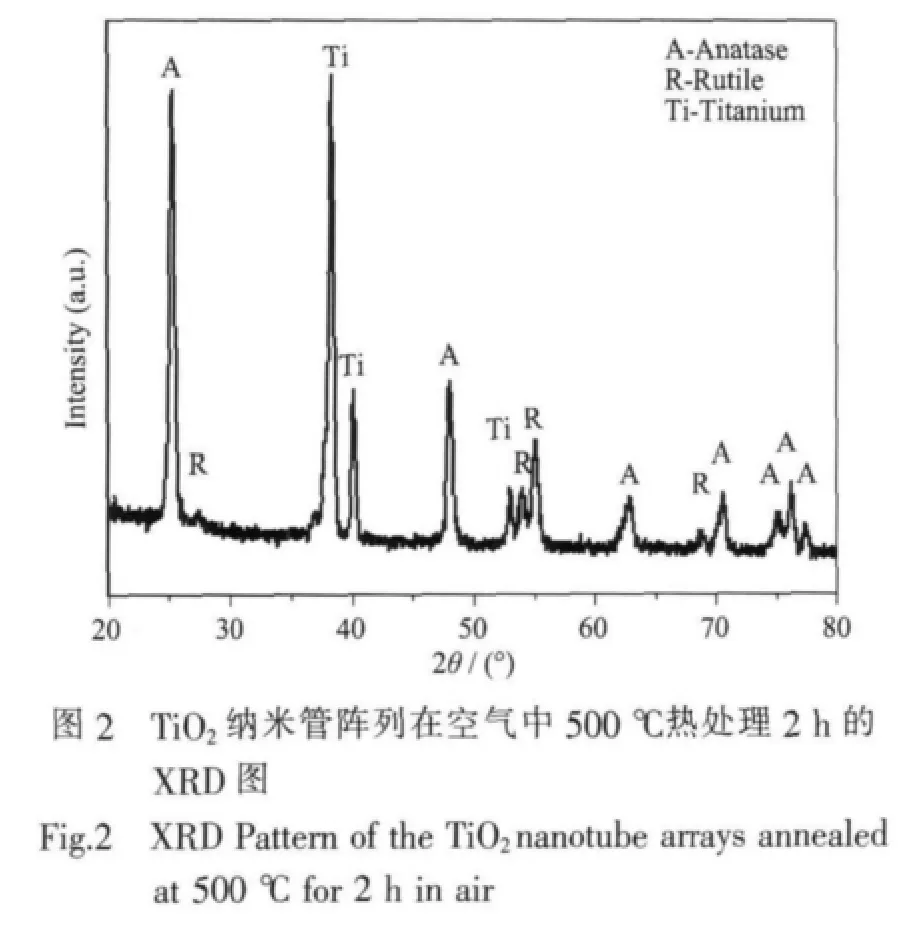
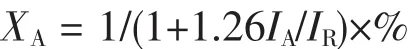
計算得到樣品中金紅石相含量為12.12wt%,表明樣品具有主要晶型為銳鈦礦并有少量金紅石相的混晶結構。這種銳鈦礦和金紅石的混晶結構,能有效地促進銳鈦礦晶型中光生電子、空穴電荷分離,從而提高光催化活性[16-18]。
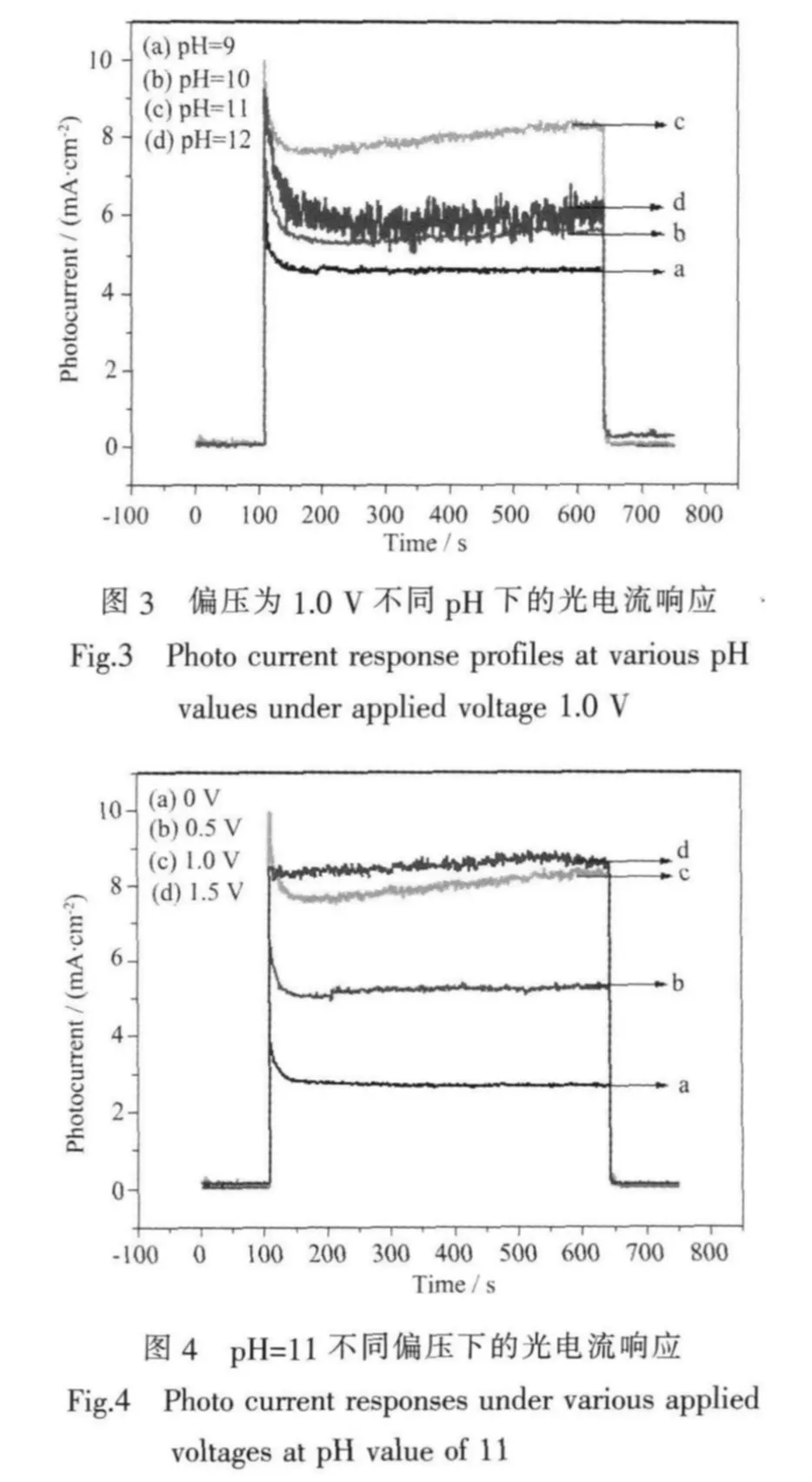
當具有不同費米(Fermi)能級的半導體材料與含有氧化還原電對的電解液相接觸時,電子會在兩者的界面發生轉移,直到電荷達到平衡。這樣,由于電子的轉移作用,使得電荷在半導體表面的分布發生改變,半導體的能帶在表面發生彎曲,從而形成空間電荷層。對于未摻雜的半導體來說,是靠空間電荷層的自建場來分離光生電子和空穴的。n型半導體TiO2的空間電荷層內的自建場的方向由本體指向表面。在光照條件下,光生空穴由體相遷移到TiO2的表面進行化學反應。光生電子就由半導體的表面向體相轉移,進而轉移到外電路形成光電流[19]。因此,光電流的強度在一定程度上反應了體系中光生電子與表面吸附物質間的相互作用。圖3、圖4分別給出了在偏壓為1 V時,不同pH值下以及pH=11時,不同偏壓下光電流響應圖。顯然,當偏壓為1 V時,pH=11條件下光電流強度最大,其次為pH=12、10、9;當pH=11時,偏壓為1.5 V條件下的光電流強度最大,其次是偏壓為1.0、0.5、0 V。預示著在偏壓為1.5 V,pH=11時光生電子-空穴對的復合幾率最低,意味著在此條件下光電催化效率最高。
2.2 氨氮廢水的光電催化降解
溶液的pH值是影響光電催化反應的一個重要因素。一般認為,在光電催化反應中,TiO2界面電荷的性質隨著溶液pH值的改變而改變,因而影響著電解質在TiO2表面的吸附行為。如果加上一定的外加電壓或外加電流,pH值對降解動力學的影響更為復雜。TiO2的零點電位通常在5.5~6.4之間,在高pH值和低pH值下均能提高光催化降解率。
圖5所示為外加偏壓為1 V,pH值分別為9、10、11、12條件下光電催化處理氨氮廢水的降解率隨時間的變化關系圖。可以看出,pH值對降解效果的影響較為明顯。在pH=9時,幾乎無降解效果;pH=11時,降解效果最好,2 h降解率可達74.17%,明顯優于pH=9(13.12%)、pH=10(48.73%)、pH=12 (50.14%)的降解率。
氨氮在水體中主要以NH3·H2O分子和離子兩種形態存在,其光電催化過程中主要發生如下歷程[20]:
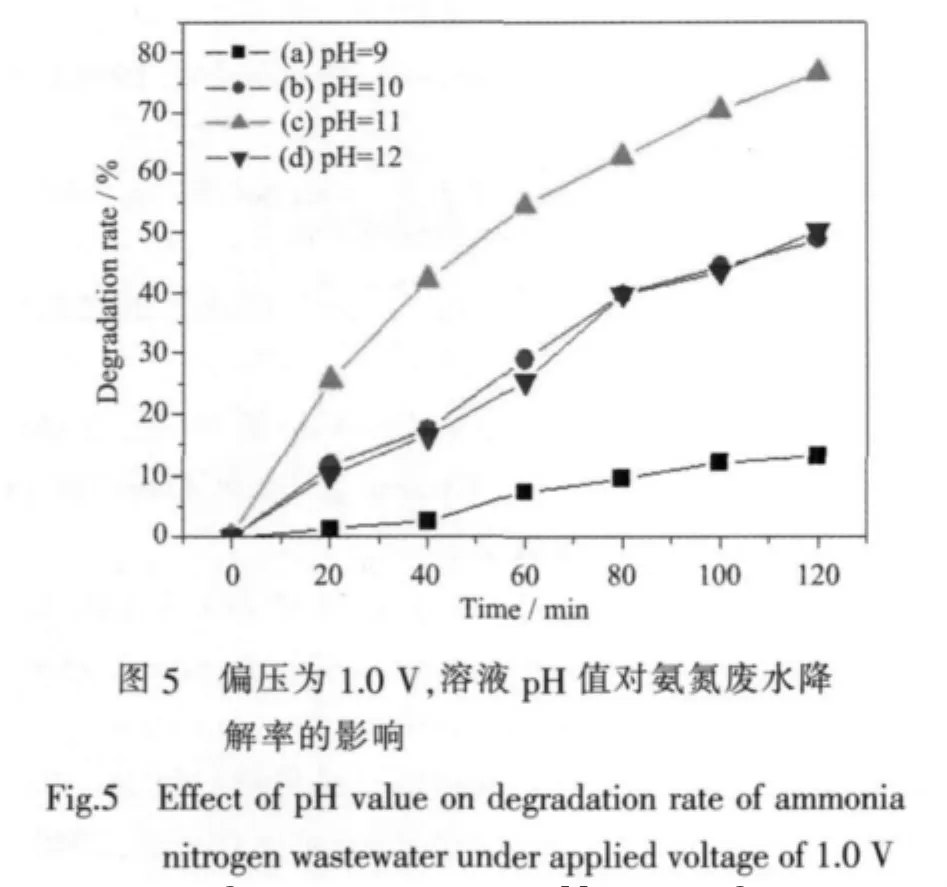
光致電子-空穴對的產生:

載流子的重新復合:

光生空穴從體相遷移到表面并與吸附在表面的羥基反應生成·OH,而光生電子在外電場作用下從外電路遷移到對電極,與吸附在表面的O2反應生成·離子:在陽極表面,離子被光生空穴或·OH氧化分解為和接著和被溶液中的光生電子還原成N2:

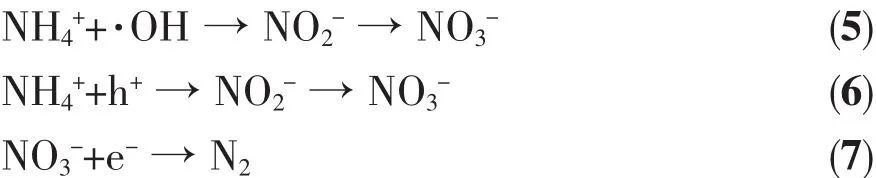
此外,當偏壓大于水的氧化電位時,在光陽極和對電極上還可能發生如下副反應:在光陽極表面:
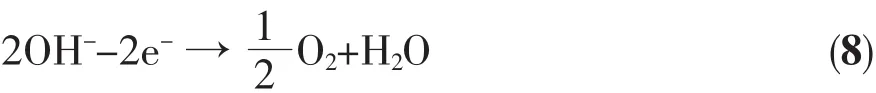
在對電極表面:

光電催化效率并不是隨著溶液pH值的增大而增大。一方面,隨著pH值升高,溶液中OH-的濃度增高,在催化劑的表面,OH-與光生電子反應生成活性物質·OH(反應3),提高了光催化反應的效率;但另一方面,隨著溶液中OH-濃度進一步增大,促進了反應8的進行。圖3顯示在pH=12時光電流強度與pH=9、10、11時相比很不穩定,且明顯低于pH= 11時的光電流,這是由于在pH=12時,反應8明顯加劇,在光陽極上析出大量氣體,光陽極與溶液界面電阻波動所致,其結果使得光陽極表面的OH-被貧化,從而增大了光生電子-空穴的復合幾率,降低了遷移到外電路的電子數量。實驗所測定的光電流強弱與光電催化降解效率的高低相對應,光電流在pH=11時最大,相應的降解效率最高。因此,反應的最佳pH=11。
光生電子極易直接跳躍回到價帶與光生空穴復合(反應2),或者光生電子和空穴先被陷阱捕獲,再發生復合現象。而一旦發生復合,就喪失了氧化還原的能力。降低光生電子和空穴的復合率是提高半導體材料催化性能的有效途徑之一。根據能帶理論[21],通過施加外加電壓增大TiO2的能帶彎曲,能更有效的實現光生電子向對電極方向移動,使得光生電子與光生空穴發生分離,延長空穴的壽命,從而大大提高催化劑的氧化能力。
為了探究偏壓對氨氮廢水降解效果的影響,本課題組討論了在不加偏壓下的光催化降解以及0偏壓(陰、陽極直接短接)、0.5 V偏壓、1.0 V偏壓以及1.5 V偏壓下的光電催化降解效率,結果如圖6所示。
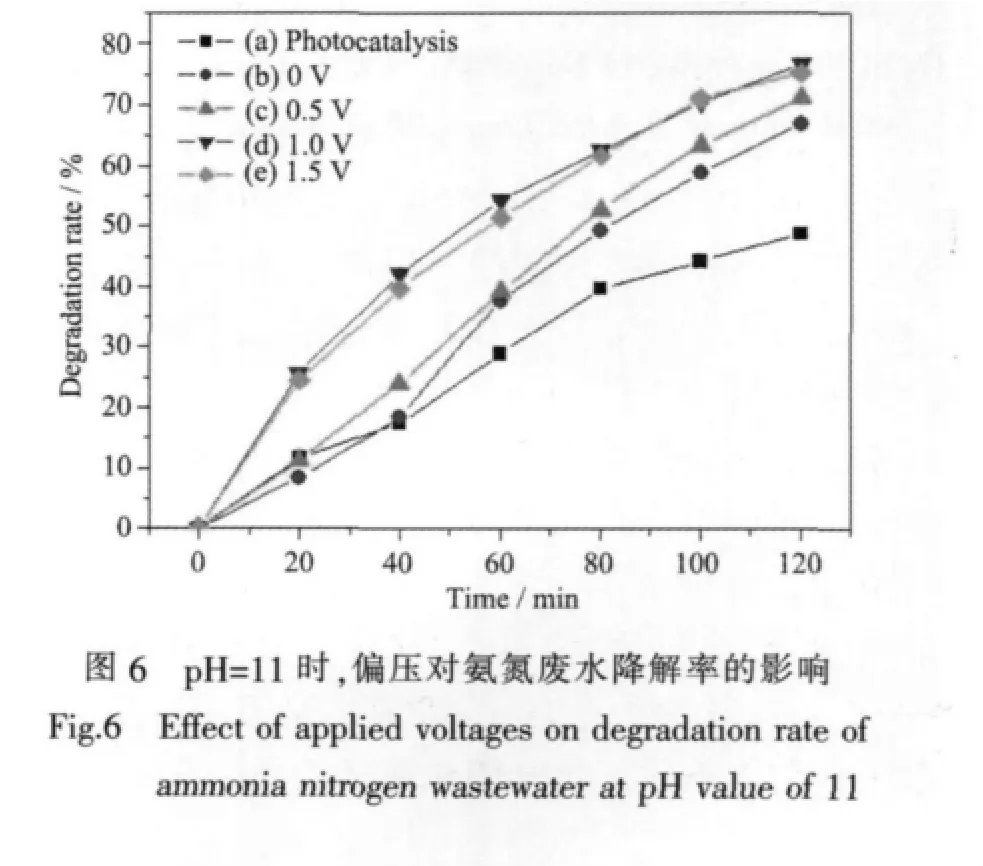
由圖6可知,與不加偏壓相比,加偏壓時的光電催化降解效率明顯提高,而且隨著偏壓的增加而增強,但是1.0 V偏壓與1.5 V偏壓下的數據接近,沒有明顯的提高。由圖4可知,光電流的強度隨著偏壓的增加逐漸增大,而當偏壓大于1.0 V時,光電流隨偏壓的增大變化不明顯。這是因為,對某一半導體,當光強一定時,光生載荷的總量是固定的,當外加偏壓為1.0 V時,光電流響應已達到飽和值,這時再增大偏壓,有效分離并遷移到外電路的光生電子數量不再繼續增加[22]。這與在pH=11時不同偏壓條件下的實驗結果完全吻合(如圖6)。因此,確定光電催化降解氨氮廢水的最佳偏壓為1.0 V。
3 結論
采用陽極氧化法在丙三醇體系中制備出排列高度有序,管徑(外徑)約160 nm、管壁約40 nm、管長約為15 μm,其中長徑比可達937.5的TiO2納米管陣列。基于光電催化氧化技術,以TiO2納米管陣列為光陽極,石墨為對電極降解100 mg·L-1(以N計) NH4Cl水溶液,討論了溶液pH值、偏壓對光電催化氧化降解效率的影響。得出光電催化氧化處理氨氮廢水的最佳條件是pH=11,偏壓為1.0 V,光電流響應的強弱與光電催化氧化效率的高低相對應。
[1]Dachs J,Eisenreich S J,Hoff R M.Environ.Sci.,2000,34: 1095-1102
[2]Li L,Yuan S H,Chen J,et al.J.Hazard Mater.,2009,161: 1063-1068
[3]ZHOU Tong(周彤).Water&Waste Water Engineering(Gishui Paishui),2000,26(2):37-39
[4]Macedo L C,Zaia D A M,Moore G J,et al.J.Photo Chem. Photobiol.A,2007,185:86-93
[5]Mikko Heikkil?,Esa Puukilainen,Mikko Ritala,et al.J.Photo Chem.Photobiol.A,2009,204:200-208
[6]Wang X,Zhao H M,Xie Q,et al.J.Hazard Mater.,2009, 166:547-552
[7]SUN Lan(孫嵐),LI Jing(李靜),WANG Cheng-Lin(王成林), et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009 (2):334-338
[8]Li Y X,Wasgestian F.J.Photochem.Photobiol.A,1998,112: 255-259
[9]Shinde S B,Sadale P S,Patil P N,et al.Sol.Energy Mater. Sol.Cells,2008,92:283-290
[10]Michael L,Hitohman F T.Electroanal.Chem.,2002,538: 165-172
[11]LIU Li-Fen(柳麗芬),DONG Xiao-Yan(董曉艷),YANG Feng-Lin(楊鳳林),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(2):211-217
[12]LI Gang(李剛),LIU Zhong-Qing(劉中清),WANG Lei (王磊),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao), 2009,25(6):1031-1037
[13]YAN Xin(顏欣),LIU Zhong-Qing(劉中清),LI Dan-Dan (李丹丹),et al.Funct.Mater.(Gongneng Cailiao),2010,7 (4):1278-1280
[14]Liu Z Q,Yan X,Li D D,et al.Appl.Surf.Sci.,2010,257: 1295-1299
[15]Song G B,Liang J K,Liu F S,et al.Thin Solid Films, 2005,491:110-116
[16]Bacsa R R,Kiwi J.Appl.Catal.,B,1998,16:19-29
[17]Bickley R I,Gonzalez-Carreno T,Lees J.Solid State Chem., 1991,92:178-190
[18]WANG Jun(王君),PAN Zhi-Jun(潘志軍),ZHANG Chao-Hong(張朝紅),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,21(10):1566-1570
[19]Piscator J,Engstr?m O.Physica E-Low-Dimensional Systems &Nanostructures,2008,40:2508-2512
[20]WU Jie(武婕),CUI Jian-Guo(崔建國).Sci-Tech Information Development&Economy(Keji Qingbao Kaifa Yu Jingji), 2005,15(5):174-176
[21]Rodríguez G M,Niklasson G A,et al.J.Mater.Sci.,2001, 36(8):3699-3705
[22]WU Lun-Peng(武倫鵬),ZHAO Lian-Hua(趙蓮花),ZHANG Hai-Ming(張海明),et al.Acta Phys.Chim.Sin.(Wuli Huaxue Xuebao),2007,23(5):765-768
Photo-electro Catalytic Oxidation of Ammonia Nitrogen Wastewater on TiO2Nanotube Arrays
LI Dan-Dan LIU Zhong-Qing*YAN Xin ZHENG Jian LIU Xu
(School of Chemical Engineering,Sichuan University,Chengdu 610065,China)
Highly ordered TiO2nanotube arrays on titanium substrate were prepared by electrochemical anodization. Field emission scanning electron microscopy(FE-SEM)and X-ray diffraction(XRD)were used to characterize the morphology and crystal form of the samples.Photo current response and photo-electro catalytic oxidation efficiency of ammonium chloride aqueous solution were evaluated with nitrogen content of 100 mg·L-1at various pH values and applied voltages,using TiO2nanotube arrays as a photo anode and graphite as a counter electrode.The results show that the as-prepared TiO2nanotube arrays possess co-crystal structure with rutile and anatase phases,mainly anatase phase.Strong photo current response corresponds to high photo-electro catalytic oxidation efficiency,and weak response to low efficiency.The optimum conditions for ammonia nitrogen wastewater decomposition are pH value of 11 and applied voltage of 1.0 V.
TiO2nanotube array;photo-electric oxidation;photo current response;ammonia nitrogen
0614
A
1001-4861(2011)07-1358-05
2011-01-19。收修改稿日期:2011-03-18。
國家自然科學基金(No.50774053),四川省科技廳科技支撐計劃(No.2009GZ0224)資助項目。
*通訊聯系人。E-mail:301qzl@vip.sina.com

