肺孢子蟲(菌)p55抗原嵌合基因的克隆及表達產物分析*
王雪蓮,欒和芝,劉 彤,趙雨杰,安春麗
2.秦皇島港口醫院檢驗科,秦皇島 066000;
3.中國醫科大學基礎醫學院細胞生物學教研室,沈陽110001;
4.中國醫科大學基礎醫學院生物芯片中心,沈陽 110001
肺孢子蟲(菌)肺炎(Pneumocystis pneumonia,PCP)是由肺孢子蟲(菌)引起的一種機會感染性肺炎[1]。常見于艾滋病(AIDS)、惡性腫瘤、器官移植及其他免疫功能不全的人群[2-3]。最新的流行病學資料顯示:PCP的發病率在發展中國家呈明顯增長趨勢,而在美國等一些發達國家,由于普遍開展了高效抗逆轉錄病毒療法(HAART)之后,PCP的發病率有所下降[4],但仍然是這些國家AIDS流行第3個十年里面臨的嚴重問題[2,5-6]。自AIDS流行以來,國內外有許多學者一直致力于PCP防治策略以及疫苗方面的研究,但是至今尚無理想的防治措施。
肺孢子蟲55 kDa蛋白(p55)是肺孢子蟲的主要抗原成分之一,能刺激宿主產生抗肺孢子蟲的保護性免疫反應[7]。Smulian等研究發現,天然p55蛋白能刺激宿主產生明顯的細胞免疫和體液免疫反應,重組p55蛋白也能對肺孢子蟲感染提供保護作用[8]。Zheng等研究發現用 p55抗原制備的非CD4+T細胞依賴疫苗能夠預防小鼠 PCP[9]。綜上,p55是最有希望的疫苗候選抗原。由于肺孢子蟲體外培養困難,導致p55抗原來源受到限制,而多個p55蛋白變異體的存在又使得免疫效果受到了影響,這些都嚴重地阻礙了利用p55抗原進行PCP免疫防治研究的進展。
本研究通過生物信息學手段,預測人源p55抗原及變異體的抗原表位,選擇可能有效抗原表位,設計包含多個抗原表位的多肽,根據遺傳中心法則及大腸桿菌密碼子偏好性進行密碼子優化,將氨基酸序列轉化為核苷酸序列,人工合成該核苷酸片段,構建原核表達載體,在大腸桿菌中表達重組蛋白,并對此表達產物進行分析鑒定。研究結果不僅解決p55來源困難和p55單價抗原免疫范圍小的難題,為PCP疫苗的研究奠定基礎,而且還為PCP的免疫學診斷提供可靠的依據。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 大腸桿菌(Escherichia coli,E.coli)DH5α購自上海生工生物工程技術服務有限公司,質粒載體pGEX-6p-1(含GST標簽)為本實驗室保存。
1.1.2 主要試劑 限制性內切酶BamH I和NotI購自大連寶生物工程有限公司,質粒DNA提取試劑盒,DNA標記物、蛋白標記物、蛋白上樣緩沖液、異丙基-β-D硫代半乳糖苷(IPTG)、蛋白胨、酵母粉、購自上海生工生物工程技術服務有限公司,Anti-GST-Ab,H RP標記羊抗兔IgG,PVDF膜購自大連寶生物工程有限公司。其他常規試劑購自沈陽化學試劑采購供應站。
1.1.3 數據庫和預測軟件 采用http://www.ncbi.nlm.gov/BLAST提供的BLAST軟件、網絡共享軟件Antigenic Peptide Prediction以及 Laser gene DNASTAR軟件,進行蛋白質序列及性質分析。
1.2 實驗方法
1.2.1 抗原表位預測 自NCBI網站的蛋白數據庫中獲取p55抗原及4個變異體信息(登記號分別為 AAQ06669、AAQ06670、AAX14020、AAQ06672、AAQ06673)。利用哈佛大學提供的網絡共享Antigenic Peptide Prediction 軟件(http ://bio.dfci.harvard.edu/Tools/antigenic.pl)及 Lasergene DNASTAR軟件,分析p55抗原及變異體的結構,預測可能的抗原表位。綜合預測結果,設計抗原表位肽串聯多肽。根據遺傳中心法則及大腸桿菌密碼子偏好性進行密碼子優化,將氨基酸序列轉化為核苷酸序列,即編碼多個抗原表位的嵌合基因。
1.2.2 嵌合基因的合成和測序鑒定 嵌合基因全長1 180 bp,在基因片段上下游分別引入BamH I和NotI酶切位點(圖 1中粗體部分),命名為CAG,由上海生工生物工程技術服務有限公司合成并測序驗證。
1.2.3 pGEX-6p-1/CAG原核表達載體的構建及鑒定 將CAG基因連接在原核表達載體pGEX-6p-1上,插入位點為BamH I和NotI,與標簽GST連接,構建重組質粒pGEX-6p-1/CAG,并將其轉化感受態菌E.coliDH5α。用含重組質粒的E.coli涂布于含有氨芐青霉素(Amp,100μ g/mL)的LB培養基(1%蛋白胨,0.5%酵母提取物,1%NaCl),于37℃培養箱中過夜培養。挑取孤立菌落接種于2 mL LB培養基(Amp,100μ g/mL)中,37℃培養過夜。提取質粒,限制性內切酶BamH I和NotI酶切,測序鑒定。
1.2.4 重組融合蛋白的誘導表達及純化 將上述過夜培養的菌液按1∶100的比例接種到含300 mL LB液體培養基(Amp,100μ g/mL)中,37℃振蕩培養至菌液吸光度(A550)為0.8~1.0時,IPTG(1 mmol/L)37℃誘導表達。4℃12 000×g離心10min,蛋白裂解液重懸沉淀。分別用 1、2、4、6 mol/L尿素充分振蕩、洗滌,4℃12 000×g離心15min,重復上述步驟一次。沉淀重懸于含8 mol/L尿素的包涵體溶解緩沖液中,充分溶解包涵體后,4℃12 000g離心 15min,收集上清,沉淀用 PBS重懸。取不同濃度尿素洗滌純化的上清、沉淀進行SDS-PAGE電泳分析融合蛋白存在形式。
1.2.5 Western Blotting分析表達產物 分別取IPTG誘導后0 h、2 h、4 h和6 h菌液1 mL,10 000×g離心15min,將沉淀重懸于50 μ L蛋白裂解液中,液氮 3 min,37℃水浴3 min,重復 3次,超聲裂解后加等體積的2×SDS載樣緩沖液,100℃變性5 min,8%SDS-PAGE蛋白電泳,轉印PVDF膜。洗膜后用5%脫脂奶粉封閉2 h。加入Anti-GST-Ab抗體(1∶500稀釋),4℃孵育過夜。PBS洗膜4次,再加入羊抗兔IgG(1∶5 000稀釋),室溫孵育2 h,DAB顯色。
2 結 果
2.1 包含多個p55抗原表位的多肽選擇 根據蛋白數據庫中獲取的p55抗原氨基酸序列,利用軟件對p55蛋白抗原性相關的參數進行預測分析,從已報道的p55抗原及4個變異體中選擇可能有效的抗原表位,各表位串聯后進一步分析,各表位相對獨立,具有較高的抗原性參數指標。此多肽的氨基酸序列為:Mgfhkamlicaiigvtlgvwhrkgfqemlicaiigmtl gvwiekmgslfiifaviarvffktdhecnnlkehckdilaesckkvqg kcldlglltpmelpselkesvhivikryqndtedqclitetvtvtavpek tletedqcsitetvtvtvtpek eslcsitetvtvtfsrdsrslciksiscds iskylkemdftkkdcvdlaaevcsfakenftkthtlltistvtvtemaq ftkthtilsvstvlvtelapethftkthtvltvstvvvtetaqmaqdiyt hikiliktktcclgrptketaqythtyirtliktenivkraflaglkpdfg kgvrvegfhkagkgvrverfhkagkgvrvegfqkefesgsyyqp mdlas。
2.2 嵌合基因序列 我們選擇了大腸桿菌偏好的密碼子,以提高短肽串聯基因在大腸桿菌內的表達效率,將上述氨基酸序列轉化為核苷酸序列(圖1),在基因的上下游分別加入BamH I和NotI酶切位點(粗體部分)。

圖1 嵌合基因序列圖Fig.1 The sequence of the chimeric antigen gene
2.3 重組質粒pGEX-6p-1/CAG的鑒定
2.3.1 重組質粒pGEX-6p-1/CAG的雙酶切鑒定
pGEX-6p-1載體片斷長度約4 900bp,CAG基因片段長度為1 180bp。重組質粒pGEX-6p-1/CAG經BamHI和NotI雙酶切的電泳結果出現了約4,900 bp及 1 180 bp的特異性條帶(圖 2),表明pGEX-6p-1/CAG表達載體構建成功。
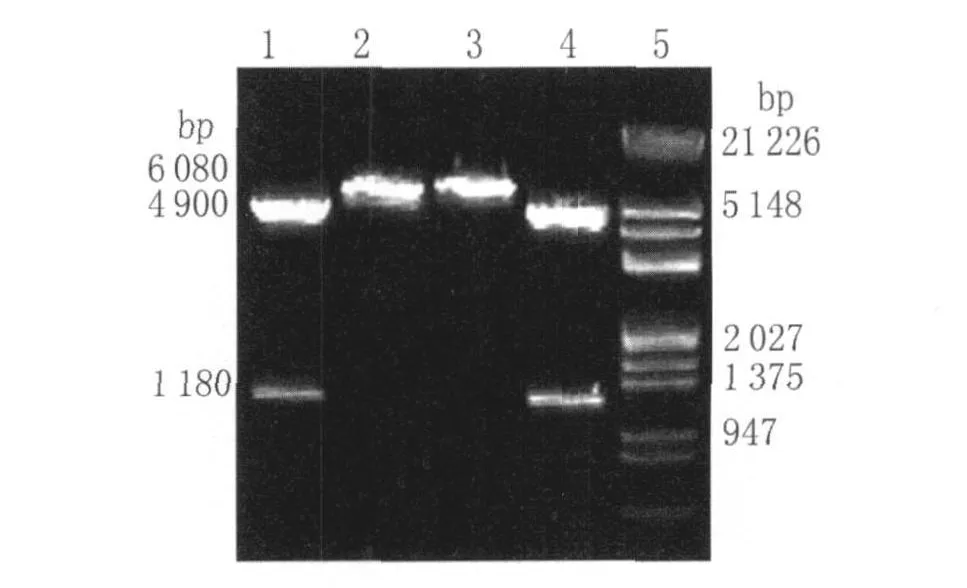
圖2 重組質粒pGEX-6p-1/CAG的限制性內切酶酶切鑒定Fig.2 Identification of recombinant plasmid pGEX-6p-1/CAG by Restriction enzyme digestion
2.3.2 重組質粒pGEX-6p-1/CAG的測序結果重組質粒pGEX-6p-1/CAG由上海生工生物工程有限公司作序列測定,結果證實了其堿基序列及讀碼框架與設計完全相符(圖3)。
2.4 重組融合蛋白的誘導表達及Western Blotting鑒定結果 攜帶質粒 pGEX-6p-1/CAG和pGEX-6p-1的E.coli表分別達出分子量約69 000的GST-CAG融合蛋白和26 000 GST蛋白。SDSPAGE電泳結果顯示,誘導的pGEX-6p-1/CAG菌體蛋白在相對分子質量(Mr)69 000處有GST融合蛋白條帶(圖4),與生物信息學分析預測的分子量相符。各濃度尿素洗滌后的沉淀及上清中在Mr69 000處可見目的條帶,沉淀中目的條帶均較上清明顯(圖4),結果表明此重組融合蛋白是以包涵體及溶解2種形式存在,但主要以包涵體形式存在。4mol/L尿素洗滌包涵體效果較好(圖4)。
Western Blotting結果顯示此融合蛋白能被Anti-GST-Ab識別,在Mr69 000處形成特異性反應條帶(見圖5)。IPTG誘導4h后融合蛋白表達量大(圖5)。結果表明嵌合基因CAG在原核細胞中得到了有效的表達。
3 討 論
資料表明,PCP是艾滋病患者最常見的并發癥,有超過90%的AIDS患者是因PCP而確診,因而被視為AIDS的“標志性疾病”[2]。臨床資料顯示:PCP一旦發生,病情進展迅速,若不及時治療,病死率高達100%。迄今既沒有理想的治療藥物,也無有效的疫苗問世。因此,開發有效的防治PCP等機會感染性疾病的新策略對HIV感染者以及其他免疫機能低下人群的健康和生存質量都具有深遠影響。

圖3 pGEX-6p-1/CAG質粒測序結果Fig.3 The result of plasmid pGEX-6p-1/CAG sequencing

圖4 pGEX-6p-1/CAG表達產物的SDS-PAGE分析1-8為不同濃度(1 mol/L,2 mol/L,4 mol/L,6 mol/L)尿素洗滌的重組蛋白CAG-GST的上清與沉淀。9為蛋白質標記物Fig.4 SDS-PAGE analysis of the expression products of pGEX-6p-1/CAG1-8 Supernatant and precipitation containing recombinant protein CAG-GST washed by different urea concentrations(1 mol/L,2 mol/L,4 mol/L,6mol/L).9 protein M arker

圖5 免疫印跡法對重組蛋白的鑒定1為蛋白標記物;2-6為IPTG誘導(0~4h)的重組蛋白Fig.5 Identification of recombinant protein by Western Blot 1 protein marker;2-6 induced(0-4h)recombinant protein
p55抗原是最有希望的疫苗候選抗原,在預防PCP的疫苗研究中比肺孢子菌的主要表面糖蛋白(MSG,gpA)更受青睞。由于p55抗原來源困難及存在變異體和致病因子等問題限制了以p55蛋白為抗原的疫苗研制。本研究以多個抗原表位為基礎設計基因工程疫苗,選擇p55抗原作為目的蛋白,最大限度的刪除致病因子,保留可有效誘導保護性免疫反應的成分。將p55抗原及4種變異體抗原表位進行串聯后,各表位仍相對獨立,具有較高的抗原性參數指標。因此,表達出的重組CAG蛋白應該具備更好的抗原性,且可實現單價疫苗多價免疫的效果。
本實驗是通過生物信息學技術,網絡數據庫結合生物軟件分析的方法預測p55蛋白二級結構,親水性,穿膜螺旋,N-糖基化位點,氨基酸序列的親疏水性,表面可及性,分子柔韌性及抗原性指數等,確定可能在肺孢子蟲感染過程中起重要作用的并具有較好抗原性參數的結構區域作為抗原表位。從5個p55蛋白變異體中選取了十二個B細胞表位,這十二段短肽通過軟件預測沒有穿膜螺旋和N-糖基化位點,具有很好的親水性和可及性,進入宿主體內應處于伸展狀態,易于接近宿主細胞受體。短肽的這些特性使其適用于基因工程疫苗的進一步研制。通過密碼子優化和不同的線性排列組合篩選,選取了具有最好抗原性參數的排列,根據遺傳中心法則轉變為核苷酸序列。實驗結果顯示多表位嵌合基因片段在接入pGEX-6p-1原核表達載體后能夠有效表達出預期大小的蛋白片段。將多表位嵌合基因應用于疫苗研制從理論上比單表位短肽疫苗具有更好的免疫原性以及更好的抗蛋白變異體的能力。但是實驗中我們發現CAG-GST融合蛋白的表達率低、包涵體復性率低以及純化費用較高,這些問題尚需進一步研究解決。重組融合蛋白的抗原性以及其預防感染的效果還需要進一步的研究及驗證。
[1]Stringer JR,Beard CB,Miller RF,et al.A New Name(Pneumocystis jiroveci)for Pneumocystis from Humans[J].Emerging Infectious Diseases,2002,8(9):891-896.
[2]Duchini A,Goss JA,Karpen S,et al.Vaccinations for adult solid-organ transplant recipients:current recommendations and protocols[J].Clin Microbiol Rev,2003,16(3):357-364.
[3]Fauci AS.HIV and AIDS:20 years of science[J].Nat Med,2003,9(7):839-843.
[4]Lian YL,Heng BS,Nissapatorn V,et al.AIDS-defining illnesses:a comparison between before and after commencement of highly active antiretroviral therapy(HAART)[J].Curr HIV Res,2007,5(5):484-489.
[5]Autran B,Carcelain G,Li TS,et al.Positive effects of combined antiretroviral therapy on CD4+T cell homeostasis and function in advanced HIV disease[J].Science,1997,277(5322):112-116.
[6]Morris A,Lundgren JD,Masur H,et al.Current epidemiology ofPneumocystis pneumonia[J].Emerg Infect Dis,2004,10(10):1713 1720.
[7]Smulian AG,Stringer JR,Linke MJ,et al.Isolation and Characterization of a Recombinant Antigen ofPneumocystiscarinii[J].Infect Immun,1992,60(3):907-915.
[8]Smulian AG,Sullivan DW,T heus SA.Immunization with recombinantPneumocystis cariniip55 antigen provides partial protection against infection:characterization of epitope recog nition associated with immunization[J].Microbes Infect,2000,2(2):127-136.
[9]Zheng M,Ramsay AJ,Robichaux M B.CD4+T cell independent DNA vaccination against opportunistic infections[J].T he Journal of Clinical Investigation,2005,115(12):3536-3544.

