溶氧調控策略對Alcaligenes sp.NX-3產威蘭膠發酵過程的影響*
萬萍,李會,徐浩,陳飛,徐虹
1(成都大學生物產業學院,四川 成都,610106)2(南京工業大學食品與輕工學院,材料化學工程國家重點實驗室,江蘇南京,210009)
溶氧調控策略對Alcaligenes sp.NX-3產威蘭膠發酵過程的影響*
萬萍1,李會2,徐浩2,陳飛2,徐虹2
1(成都大學生物產業學院,四川 成都,610106)2(南京工業大學食品與輕工學院,材料化學工程國家重點實驗室,江蘇南京,210009)
主要研究了發酵過程中溶氧調控策略對Alcaligenes sp.NX-3產威蘭膠的影響。在7.5 L發酵罐中,首先考察了不同通氣量對菌體生長、威蘭膠濃度、葡萄糖消耗、威蘭膠黏度等的影響。結果表明,通氣量為1 vvm時,有利于威蘭膠濃度的提高。通過研究不同供氧水平對威蘭膠發酵的影響,發現較高的溶氧水平有利于威蘭膠的合成,但是不利于威蘭膠黏度的提高。因此提出了低供氧-中供氧-高供氧、高供氧-中供氧-低供氧2種不同溶氧調控策略。實驗結果表明:采用高供氧-中供氧-低供氧策略,能夠使威蘭膠濃度達到25.4 g/L,葡萄糖對威蘭膠的轉化率提高到0.51 g/g,威蘭膠黏度達到2.700 Pa·s。
威蘭膠,Alcaligenes sp.NX-3,溶氧調控策略
威蘭膠(welan gum)是一種分子量高達數百萬的原核生物雜多糖[1],它的主鏈結構骨架由D-葡萄糖、D-葡糖醛酸、D-葡萄糖和L-鼠李糖重復單元組成,側鏈由單一的L-鼠李糖或L-甘露糖構成[2]。威蘭膠具有稠化、懸浮、熱穩定、絮凝和耐酸堿等性能,在石油、混凝土、食品、油墨、醫藥等行業中有著廣泛的應用前景[3-6]。
威蘭膠可由產堿桿菌好氧發酵生產,屬于高黏度發酵類型。隨著發酵的進行,威蘭膠的積累,發酵液粘度迅速增大,高達幾千甚至上萬厘泊,嚴重影響發酵液中營養物質、溶氧的傳遞和吸收利用,抑制菌體生長代謝,嚴重阻礙產物的累積。溶氧一直以來都是高粘度發酵體系中一個重要的研究因素,溶氧對好氧發酵的影響主要分為兩方面:一是溶氧濃度影響與呼吸鏈有關的能量代謝,影響微生物生長代謝;二是氧直接參與產物合成[7]。雖然國內外對威蘭膠生產工藝有著諸多的研究[8-10],但溶氧對威蘭膠發酵的影響鮮有報道,而同是微生物多糖的黃原膠在這方面卻被深入研究。林劍[11]等研究了攪拌與溶氧對黃原膠發酵的影響,發現溶氧濃度對黃原膠產生菌的生長速率、黃原膠的生成率以及其質量都有明顯的影響。花璟薇[12]在6 L的生物反應器上研究了溶氧對黃原膠發酵的影響。結果表明發酵液中的溶氧濃度對菌體生長速率影響不大,但對發酵過程穩定期的長短有顯著影響;溶氧越高,黃原膠持續合成的時間越長。Fernado等[13]研究發現,發酵液中的溶氧水平對黃原膠平均分子質量的大小有著重要影響。黃原膠的分子量隨發酵液中的溶解氧的濃度增加而增大。黃原膠同威蘭膠一樣都屬于微生物胞外多糖,它由D-葡萄糖、D-甘露糖、D-葡萄糖醛酸、乙酸和丙酮酸聚合而成,分子量達到百萬[14]。發酵過程中隨著發酵時間的增長,發酵液變黏稠,發酵體系都為高黏發酵,因此借鑒黃原膠此方面的研究將為開展溶氧水平對威蘭膠發酵的影響研究提供很好的借鑒意義。
1 材料和方法
1.1 菌株
本實驗室自主篩選的產堿桿菌Alcaligenes sp.NX-3,保藏于中國微生物菌種保藏管理委員會普通微生物中心,保藏號為 CGMCC2428[9]。經分析鑒定,多糖產物為威蘭膠[15]。
1.2 培養基與培養方法
1.2.1 種子液培養基與培養方法
種子培養基(g/L):葡萄糖 20,酵母膏 1,K2HPO42,MgSO40.1,pH 值 7.2~7.4,121 ℃ 滅菌15 min。
培養方法:挑取接種活化后的斜面菌苔2環于種子培養基中,裝液量200 mL/1 000 mL,30℃,200 r/min搖瓶培養16 h。
1.2.2 發酵液培養基與培養方法
從西王的創業路徑可以看出,這是一家在傳統產業色彩頗為濃厚的企業。像大多數的魯企一樣,他們在不知不覺中成為行業巨頭,他們將更多的精力放在深耕產業鏈條上,很少輕易涉足陌生行業。他們更愿低調潛行,不像互聯網英雄那樣擁有極高的曝光度,其產品的知名度要遠遠大于創始人的知名度。
發酵培養基(g/L):葡萄糖 50,蛋白胨 4,K2HPO43,MgSO40.1,pH 值 7.2~7.4,121 ℃ 滅菌15 min。
7.5 L發酵罐培養(BioFlo110,美國NBS公司):溫度30℃,裝液量4.5 L,接種量5%。當研究不同通氣量的影響時,將攪拌轉速固定在600 r/min,通氣量分別控制在:0.5 vvm、1.0 vvm、1.5 vvm。當研究不同攪拌轉速的影響時,將通氣控制在最佳,轉速分別控制為400、600、800 r/min。發酵過程中流加3 mmol/L的NaOH,將pH值控制在7.0。
1.2.3 不同供氧的控制
在7.5 L發酵罐中,將通氣控制在最佳,調控攪拌轉速400、600、800 r/min,分別定義為低供氧、中供氧和高供氧。
1.3 分析方法
1.3.1 葡萄糖含量的測定
生物傳感分析儀(SBA-40C,山東省科學院生物研究所)。
1.3.2 威蘭膠含量測定
威蘭膠含量測定:稱取適量體積的發酵液,蒸餾水稀釋,12 000 r/min離心30 min,去除菌體細胞沉淀。上清液加入1/5體積的V(三氯甲烷)∶V(異戊醇)=24∶1混合液,12 00 r/min 離心30 min,去除蛋白質,反復去除2次。上清液用乙醇沉淀威蘭膠,60℃烘干,稱重[16]。
1.3.3 菌體干重的測定
取5 mL發酵液并適當稀釋,于已預先稱重的干燥離心管中,8 000 r/min離心20 min,棄上清,用去離子水洗滌2次,105℃烘箱內烘至恒重,稱量即可。
1.3.4 威蘭膠粘度的測定
威蘭膠1% 水溶液,NDJ-1型旋轉黏度計(上海恒平科學儀器有限公司),4號轉子,60 r/min,25℃測得。
1.3.5 相對溶氧水平(D℃)(%)的測定
由溶氧探頭在線測定。
以上實驗平行重復3次,誤差范圍在±4%之間。
2 結果與討論
2.1 7.5 L發酵罐中,不同通氣量對威蘭膠發酵的影響

圖1 不同通氣量對威蘭膠發酵的影響
在7.5 L發酵罐中,根據威蘭膠發酵的實際情 況,選取了一個比較適中的轉速600 r/min,分別研究了0.5 vvm、1.0 vvm、1.5 vvm不同通氣量對威蘭膠發酵的影響。由圖1可以看出,當通氣量為0.5 vvm時,發酵液中的溶氧水平較低,一直持續在5%左右,相應的菌體干重,威蘭膠濃度和黏度都較低。隨著通氣量的增加,發酵液中的溶氧水平也有明顯的增加,當通氣量為1 vvm時,溶氧水平明顯提高到10% 以上,菌體生長最快,威蘭膠的濃度也最高,達20.6 g/L;葡萄糖的消耗量較通氣量0.5 vvm、1.5 vvm高,葡萄糖對威蘭膠的轉化率提高到0.41 g/g,威蘭膠黏度達到2.540 Pa·s(表1)。但當通氣量增加到1.5 vvm時,溶氧水平繼續增高,但菌體干重、威蘭膠濃度和黏度都略有所降低,可能是過高的通氣量對菌體的生長產生了不利影響。綜上所述,在發酵過程中溶氧水平對威蘭膠的發酵有較明顯的影響,該過程對氧氣的要求是適中的,過低或過高的通氣量都會對發酵產生消極的影響。

表1 不同通氣量下的葡萄糖轉化率、威蘭膠黏度比較
2.2 5 L發酵罐中,不同供氧水平對威蘭膠發酵的影響
在7.5 L發酵罐中,選定最優通氣量1 vvm,分別研究了攪拌轉速為400、600、800 r/min 3種供氧水平對威蘭膠發酵的影響,實驗結果如圖2所示。結果顯示,當攪拌轉速為400 r/min時,菌體生長明顯受到低溶氧水平的影響,生物量較低,威蘭膠的合成速率也較慢,濃度為 17.5 g/L,威蘭膠黏度僅有1.510 Pa·s(表2)。隨著攪拌轉速的提高(600 r/min),發酵過程中的溶氧水平明顯提高,菌體生長速率增大,威蘭膠的濃度提高到20.6 g/L,威蘭膠黏度也明顯增大到2.540 Pa·s。其可能的原因是:攪拌轉速高時,發酵液傳質、溶氧及氧傳遞性能得到改善,有利于菌體生長和產物的合成。進一步提高攪拌轉速到800 r/min,威蘭膠濃度繼續增加到22.8 g/L,葡萄糖轉化率進一步提高到0.46 g/g,但發酵中后期的菌體濃度有所降低,威蘭膠黏度較600 r/min低,降到了2.100 Pa·s。可能是過高的攪拌轉速產生了過高的剪切力,對菌體細胞產生了損傷;并且可能把威蘭膠延伸鏈打斷,使分子量降低,從而導致發酵液黏度降低。

圖2 不同攪拌轉速對威蘭膠發酵的影響

表2 不同攪拌轉速條件下葡萄糖轉化率、威蘭膠黏度情況
2.3 7.5 L發酵罐中,不同溶氧調控策略對威蘭膠發酵的影響
基于以上實驗可以發現,在威蘭膠發酵過程中溶氧水平對威蘭膠的合成有著十分重要的影響,在發酵前期(0~24 h),較高的供氧(800 r/min)有利于菌體的生長和威蘭膠的合成。而在發酵中期(24~48 h),供氧(600 r/min)有利于高黏發酵液的形成。在發酵后期(48~72 h),由于發酵液變的更加黏稠,低的轉速能夠防止高轉速對威蘭膠分子鏈的破壞。因此為了同時提高威蘭膠的濃度和黏度,比較了2種不同的溶氧調控策略對威蘭膠發酵的影響。策略1(前24 h低供氧,24~48 h采用中供氧,48 h至發酵結束采用高供氧);策略2(前24 h高供氧,24~48 h采用中供氧,48 h至發酵結束采用低供氧)。
結果表明,策略1隨著發酵時間的增長,菌體濃度增大,溶氧水平急劇下降。當發酵時間為12 h時,溶氧的水平降到最低2.9%,之后溶氧水平一直在5%以下,雖然24 h和48 h提高轉速來提高發酵液中的溶氧水平,但菌體的生長速率還是受到明顯影響,威蘭膠濃度為22 g/L,黏度為2.300 Pa·s(表3)。采用溶氧策略2后,菌體的對數生長期(6~48 h)溶氧水平較策略1有明顯的提高,整個發酵過程的溶氧水平一直持續在10%以上,菌體成長速率明顯提高,威蘭膠的濃度提高到25.4 g/L,葡萄糖殘留量為5.5 g/L(圖3b),葡萄糖對威蘭膠的轉化率提高到0.51 g/g,威蘭膠黏度明顯提高為2.700 Pa·s(表3)。該結果較之前的分批發酵研究水平有所提高[16-17]。
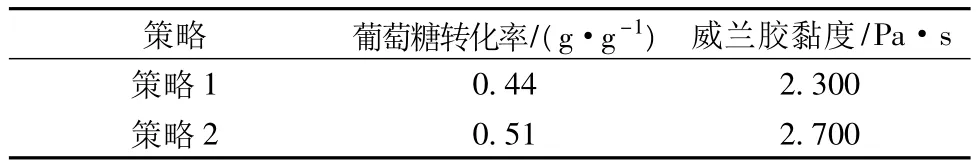
表3 不同溶氧策略下葡萄糖轉化率、威蘭膠黏度情況
分析可能原因是:先高溶氧,為細胞的生長提供了充足的氧氣,這時菌體能量供應充足,菌體生長較快且代謝旺盛,細胞內各種初級代謝物質和次級代謝產物得以充分累積,有利于威蘭膠的合成;后期主要以威蘭膠的累積為主,對氧氣的需求量減少,在不影響威蘭膠累積的基礎上,后期降低攪拌速度,避免了威蘭膠延伸鏈被過高的攪拌速率產生的過大剪切力打斷,有利于威蘭膠分子量的提高,提高產品的黏度。

◆菌體干重;●葡萄糖濃度;▲威蘭膠濃度;○溶氧水平圖3 不同溶氧策略對威蘭膠發酵的影響
分析以上結果發現,對數生長期初期(6~24 h)的溶氧水平對威蘭膠的發酵有著重要的影響。此時期菌體大量增長,菌體代謝比較旺盛,對溶氧的需求急劇增加,致使發酵液中溶氧水平迅速降低;但是如果此時溶氧水平過低,會嚴重限制菌體的增殖,并造成不可逆的不利影響。可能是過低的溶氧嚴重影響了菌體的能量代謝和正常生理代謝,進一步影響了威蘭膠合成途徑中部分關鍵酶的合成,從而對威蘭膠的累積造成了不可逆的影響。
3 結論
(1)通氣量1 vvm有利于威蘭膠濃度的提高,過低或過高的通氣量都會對發酵產生消極影響。
(2)提高攪拌轉速可以提高威蘭膠的濃度,攪拌轉速800 r/min時,威蘭膠濃度達到22.8 g/L,但是此時的威蘭膠黏度較 600 r/min時低,僅為2.100 Pa·s。
(3)在Alcaligenes sp.NX-3發酵生產威蘭膠中,溶氧水平對其有著重要的影響,尤其是對數生長期尤為重要;采用高供氧-中供氧-低供氧調控方法,使威蘭膠的濃度和黏度都有了明顯的提高:濃度提高到25.4 g/L,葡萄糖對威蘭膠的轉化率提高到0.51 g/g,威蘭膠黏度提高到2.700 Pa·s。
溶氧對威蘭膠合成的影響的深層機理還不清楚,但該研究為下一步借助于代謝工程和酶工程的方法,深入研究溶氧水平對威蘭膠合成代謝途徑及威蘭膠分子量的影響奠定了基礎。
[1] Kang K S,Veeder G T,Cottrell I W.Some novel bacterial polysaccharides of recent development[J].Porg Ind Microbial,1983,18:231 -253.
[2] Chandrasekaran R,Radha A,Lee E J.Structural roles of calcium ions and side chains in welan:an xray study[J].Carbohydr Res,1994,252:183 -207.
[3] Pollock T J.Gellan related polysaccharides and the genus Sphingomonas[J].Gen Microbiol,1993,139:1939 -1945.
[4] Floyd L,Allen,Glen H.Welan gum in cement compositions[P].US,4963668,1990.
[5] Takahashi,Kozo,Sugiura,et al.Oil absorption retarder[P].US,6497910,2002.
[6] Hoskin D H,Mitchell T O,Shu P.Oil reservoir permeability profile control with crosslinked welan gum biopolymers[P].US:4991652,1991.
[7] 趙東峰,梁春艷,任翔,等.溶氧對生物轉化泰樂菌素為其酰化物的影響[J].中國醫藥工業雜志,2006,37(3):162-164.
[8] 徐虹,李莎,郭朝江,等.一種產堿桿菌及其在制備威蘭膠中的應用[P].CN,1888054,2007.
[9] 郭朝江.低能N+注入威蘭膠生產菌誘變選育及發酵工藝優化[D].南京:南京工業大學,2007.
[10] 李會,李莎,徐虹,等.Alcaligenes sp.NX-3產威蘭膠的補料分批發酵工藝研究[J].食品與發酵工業,2009,35(1):1 -4.
[11] 林劍,鄭舒文,徐世艾.攪拌與溶氧對黃原膠發酵的影響[J].中國食品添加劑,2003(2):63-65.
[12] 花璟薇.黃原膠發酵條件的研究[J].浙江食品工業,2000,2(2):16 -221.
[13] Flores F,Tores L G,Galindo E.Effect of the dissolved oxygen tension during cultivation of X.Campestris on the production and quality of xanthan gum [J].J Biotechnol,1994,34(2):165 -173.
[14] Rosalam S,England R.Review of xanthan gum production from unmodified starches by Xanthomonas comprestris sp.[J].Enzyme Microb Techno,2006,39(2):197 -207
[15] 李莎,徐虹,姜岷.產堿桿菌NX-3胞外多糖的結構與性能[J].微生物學通報,2005,32(6):37 -41.
[16] 李會,李莎,馮小海,等.Alcaligenes sp.NX-3產威蘭膠的補料分批發酵工藝研究[J].食品與發酵工業,2009,35(1):1-4.
[17] 郭建軍,李建科,陳琳,等.韋蘭膠生產菌的選育[J].食品工業科技,2009,30(2):126-128.
Effect of Dissolved Oxygen Control Strategies on Welan Gum Fermentation by Alcaligenes sp.NX-3
Wan Ping1,Li Hui2,Xu Hao2,Chen Fei2,Xu Hong2
1(Faculty of Biotechnology Industry,Chengdu University,Chengdu 610106,China)2(State Key Laboratory of Materials-oriented Chemical Engineering,Nanjing University of Technology,Nanjing 210009,China)
The dissolved oxygen control in the production of welan gum by Alcaligenes sp.NX-3 was investigated.Firstly,based on the analysis of the effect of various aeration rate on cell growth,welan gum concentration,glucose consumption,dissolved oxygen level,and welan gum viscosity,we confirmed that in a 7.5 L bioreactor 1 vvm aeration rate was beneficial for welan gum production.After that,the effect of different oxygen supply levels on the welan gum fermentation was studied.The results indicated that high oxygen supply level could improve the welan gum production,but it was not helpful for welan gum viscosity.Therefore,the two oxygen supply strategies:low-moderatehigh oxygen supply level and high-moderate-low oxygen supply level were proposed.The results showed that the latter was better for the welan gum fermentation.Finally,the maximum concentration of welan gum reached 25.4 g/L with a yield of 0.51 g/g and the welan gum viscosity of 2.700 Pa·s .
welan gum,Alcaligenes sp.NX -3,dissolved oxygen control strategy
副教授(徐虹教授為通訊作者)。
*江蘇省普通高校研究生科技創新計劃(CX10B_183Z);江蘇省農業科技自主創新基金(CX(10)226);國家科技支撐項目“十二五”農村領域(2011BAD23B00)。
2010-07-07,改回日期:2011-03-01

