一株非發酵反硝化聚磷菌的篩選及其代謝模式研究
劉 暉,孫彥富,賈曉珊,李 軍,周康群,熊蒂程,區向東 (1.中山大學環境科學與工程學院,廣東廣州 51075;.仲愷農業工程學院環境科學與工程系,廣東 廣州 5105;.北京工業大學建工學院,北京 10014)
一株非發酵反硝化聚磷菌的篩選及其代謝模式研究
劉 暉1,2,3,孫彥富2,賈曉珊1*,李 軍3,周康群2,熊蒂程3,區向東2(1.中山大學環境科學與工程學院,廣東廣州 510275;2.仲愷農業工程學院環境科學與工程系,廣東 廣州 510225;3.北京工業大學建工學院,北京 100124)
利用活性污泥與生物膜復合系統富集反硝化聚磷菌(DPB)并進行了功能菌的篩選及反硝化聚磷實驗,考察了乙酸、PO43--P和NO3--N、PHB和糖原的變化,分析了厭氧和缺氧代謝模式以及PHB在此過程中所起的作用.結果表明,分離到的YB菌株與脫氮副球菌屬最相似,是一類非發酵的反硝化聚磷菌.厭氧階段,YB菌株合成1mg的PHB釋放0.11mg的P,作為非發酵菌,合成PHB所需要的能量ATP大部分來自聚磷酸鹽的釋放.缺氧階段,YB菌株分解1mg的PHB聚集0.15mg的P,PHB分解產生的ATP多用于聚磷過程;與以前報道的聚磷菌在厭氧和缺氧條件下的代謝模式不同.厭氧階段聚磷酸鹽的釋放將影響PHB的合成,進一步影響反硝化聚磷效果,因此認為應重點跟蹤△P/△PHB和△NO3--N /△PHB,而不是△P/△COD、△NO3--N /△COD或者△P/△NO3--N.
反硝化聚磷菌;脫氮副球菌屬;非發酵菌;代謝模式
反硝化聚磷菌(DPB)是一種非常具有工程應用價值的微生物.生物反硝化聚磷技術是污水處理研究領域的重點和熱點.其原理是反硝化聚磷菌在厭氧條件下,利用有機物同時合成為細胞內儲備營養物聚 β-羥基丁酸(PHB)并釋放正磷酸鹽,而在缺氧環境下利用硝酸鹽作為電子受體,進行反硝化作用的同時超量聚磷,使得聚磷和反硝化脫氮這 2個生物過程在缺氧環境下由同一類微生物一并完成[1-4].
目前國內外研究多集中于反硝化工藝和聚磷污泥對不同基質醋酸、丙酸的利用[5-12],但是污泥中的各種細菌多,不能準確反映反硝化聚磷代謝過程.有關單菌株特別是非發酵菌所起的作用,其代謝模式與常規聚磷菌的不同之處,單菌株的釋磷、聚磷,與PHB和糖原合成與分解的關系等方面的文獻報道較少.
本研究通過活性污泥與生物膜復合系統的運行及富集,篩選出了一種未見報道過的反硝化聚磷菌新菌株(YB).采用傳統與現代分子生物學鑒定相結合的手段,確定YB菌株的分類地位,同時進行厭氧釋磷和缺氧反硝化聚磷實驗,考察過程中乙酸、PO43--P和NO3--N、PHB和糖原的變化,并分析厭氧和缺氧代謝模式以及PHB在釋磷和聚磷過程中所起的作用,以期為開發高效、節能、低耗的同步反硝化聚磷工藝,改良傳統工藝提供科學依據.
1 材料與方法
1.1 試驗裝置

圖1 活性污泥與生物膜復合系統示意Fig.1 Activated sludge and bio-membrane combined system
活性污泥與生物膜復合(SB)同步脫氮除磷系統見圖 1.進水流量為 1m3/d,各處理單元區的工作條件分述如下:厭氧活性污泥釋磷區: HRT為2.3h,ORP<-100mV.快速沉淀區:HRT為0.32h.生物膜區:HRT為 2.2h, ORP>200mV.兼性脫氧區:HRT為0.6h,ORP< 50mV.缺氧活性污泥反硝化聚磷區:HRT為2.7h,ORP為0~-100mV.微曝氣區:HRT為0.15h.
反硝化聚磷試驗裝置見圖 2.在有效容積為1L的密封瓶中并用氬氣進行攪拌以保持充分的混合,厭氧階段結束后投加硝酸鹽作為電子受體以保證缺氧環境并開展同步反硝化聚磷試驗.
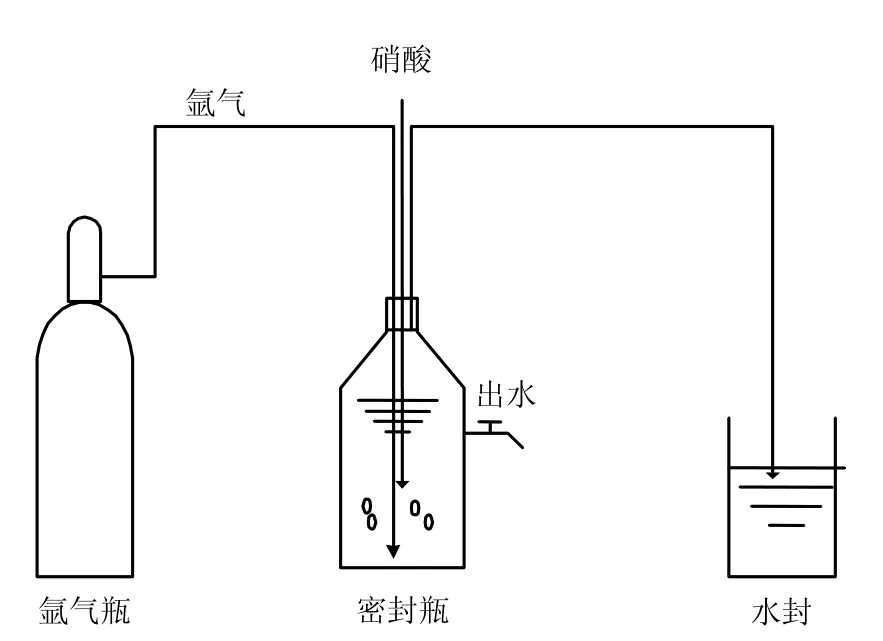
圖2 YB菌株的反硝化聚磷試驗裝置示意Fig.2 Denitrifying phosphorus accumulating equipment of strain YB
1.2 供試材料
試驗污水采自廣州市某污水處理廠的實際污水,其水質情況如下:COD為 200~350mg/L; BOD為80~120mg/L;N(NH4Cl)為25~30mg/L;TN為 30~35mg/L;P(PO43--P)為 3.5~5.0mg/L;SS為100~160mg/L;pH7~7.5.
本試驗采用SB同步脫氮除磷系統反應過程的第 3階段末期反硝化聚磷區的污泥為研究種泥,將其分離純化后的純菌株YB作為研究對象.
聚磷菌培養液:無水乙酸鈉5.0g,KH2PO40.025g, MgSO4?7H2O 0.5g,CaCl2?H2O 0.2g, (NH4)2SO42.0g,微量元素1.0mL,蒸餾水1000mL, pH7.0.
1.3 實驗方法
1.3.1 SB同步脫氮除磷系統的運行方案 A2/O厭氧段活性污泥取自運行良好的廣州瀝滘污水處理廠.種泥與試驗污水混合(MLSS為 3500~4000mg/L),以生物膜區氨氧化反應后產生的硝酸鹽為電子受體富集反硝化聚磷菌.運行方案分3個階段,先分段運行,后連續運行.
第1階段為膜硝化池的啟動階段,目的是對系統中的硝化菌進行富集從而將污水中的氨氮轉化為硝酸鹽氮,為后2階段富集反硝化聚磷菌提供硝酸鹽氮的電子受體,將種泥與污水混合,ORP控制在80~100mV,共運行3個月.
第2階段為反硝化聚磷菌的富集、設備調試階段.該階段的目的是去除常規的反硝化菌(僅有反硝化作用而無聚磷作用).通過對厭氧釋磷池和同步反硝化吸磷池交替運行,利用接觸氧化池產生的硝酸鹽為電子受體,調節設備對反硝化聚磷菌進行選擇和富集,該段是整個試驗的關鍵.當第 1階段的好氧膜硝化池中氨氮轉化為硝酸鹽氮的轉化率穩定在 90%以上后,設備進入第 2階段,即同時啟動厭氧釋磷池、快沉淀池、膜硝化池、兼性脫氧池、同步硝化聚磷菌池、微曝氣池和沉淀池.其過程為厭氧釋磷池(3.3h)→快沉淀池(0.32h)→接觸氧化池(2.2h)→兼性脫氧池(0.2h)→同步反硝化吸磷池(2.7h)→微曝氣池(0.15h)→二次沉淀池(0.34h)方式運行,初始污泥濃度控制在 2000~2500mg/L,缺氧 ORP在-100~-120mV,厭氧ORP在-150~-220mV,共運行6個月.
第3階段體系的穩定階段,該階段目的是反硝化聚磷菌已經富集到一定量后,進一步保持體系的穩定性,裝置一共運行了40d.
當反硝化聚磷菌在第 3階段運行到 39d時,TP濃度為0.65mg/L,總氮濃度為12.6mg/L,氨氮濃度為 3.8mg/L,COD為 34mg/L,均低于GB18918-2002標準[13]的要求.而且TP、總氮、氨氮、COD變化幅度都較小,進一步說明體系進入穩定運行.
1.3.2 YB菌的分析與鑒定 YB菌株菌落進行革蘭氏染色,在 100×10倍光學顯微鏡下觀察顏色和形態.對 YB菌株進行產氨試驗、氧化酶試驗、接觸媒試驗、葡萄糖氧化發酵試驗、吲哚、耐鹽等主要生化特性試驗[14].
對獲得的 YB菌株培養物進行離心收集,用TE緩沖液(pH 8.0)洗滌,通過溶菌酶裂解和凍融步驟裂解細胞,以 SDS和酚/氯仿提取基因組DNA.16S rDNA基因擴增采用寡聚核苷酸引物27f和 1522r.PCR擴增程序:94℃預變性 4min, 94℃變性1min,55℃復性1min,72℃延伸2min,30個循環,最后 72℃延伸 7min.擴增產物送上海英駿生物技術有限公司測序.所得16S rDNA基因序列,在GenBank數據庫中進行BLAST序列的相關性搜索.同時利用相關種屬的16S rDNA序列,構建系統發育樹.序列對排用MEGA 4.0進行多序列匹配排列,進化樹的構建用Neighbor-joining方法.進化樹分枝模式的穩定性用MEGA 4.0進行bootstrap分析,重復1000次,計算各分支的支持度[15].
1.3.3 反硝化聚磷實驗 在無菌條件下將 YB菌株活化后洗入圖 1裝置中(裝置中溶液組成為:乙酸0.3g, KH2PO40.025g,MgSO4?7H2O 0.5g, CaCl2?H2O 0.2g,(NH4)2SO42.0g,蒸餾水1000mL, pH7.0).反應液的OD600值調整為0.3;向裝置內通入氬氣,當ORP降到-80mV以下時,厭氧釋磷2h,然后投加一定量的KNO3作為電子受體.繼續通氬氣進行同步反硝化聚磷試驗,一定時間間隔取樣,離心分離后,測定濾液中的乙酸、PO43--P和NO3--N、PHB和糖原的濃度.
1.4 分析方法
PHB的測量采用氣相色譜法,將20mL菌液冷凍干燥后,稱取到裂解瓶中,加入 2mL氯仿, 2mL硫酸甲醇,0.2mL苯甲酸-甲醇,于100℃裂解4h,待裂解樣品冷卻后加 1mL蒸餾水離心,取有機相(下層)進行氣相色譜分析[9].磷酸鹽測定采用鉬酸銨分光光度法;HAC的測定采用中和滴定法測定;硝酸鹽氮的測定采用紫外分光光度法;糖原的測定采用蒽酮法;MLSS采用濾紙稱重法;生物利用光學和電子顯微鏡觀察;pH值、ORP采用電極法.
2 結果與討論
2.1 YB菌株的鑒定結果
2.1.1 形態和培養特征 YB菌株的細胞為革蘭氏陰性,球形或近球形,直徑為(0.4~0.7)μm×(0.9~1.2)μm.呈單個、成對或堆狀.不運動,無芽孢,無鞭毛.在營養瓊脂固體培養基平板上培養24h后,菌落形態為圓形,直徑為 2~4mm,表面光滑、微凸,邊緣整齊,初期無色至淡黃色,半透明,表面有光澤.
2.1.2 生理生化特征 YB菌株能在37~41℃生長,
最適宜溫度為 30℃.好氧呼吸代謝,葡萄糖氧化發酵實驗為氧化型產酸,即非發酵菌.能利用檸檬酸鹽等有機化合物作為碳源異養生長.當硝酸鹽、亞硝酸鹽或氧化氮存在時,能以它們為電子受體進行厭氧生長,并且在厭氧條件下將硝酸鹽還原為亞硝酸鹽到 N2,因此表現出反硝化功能,是一類好氧或兼性厭氧非發酵革蘭氏陰性桿菌.YB菌株能形成聚-β-羥基丁酸鹽顆粒.不能水解淀粉,不能液化明膠、V.P.實驗、苯丙氨酸脫氨酶實驗均呈陰性;硝酸鹽還原實驗、檸檬酸鹽實驗均為陽性.
2.1.3 16S rDNA基因的序列、系統發育分析 采用BLAST將YB長1376bp的16S rDNA基因序列與GenBank中已登錄的基因序列進行比對,根據YB菌株的16S rDNA序列與副球菌屬中的6個模式菌株的 16S rDNA序列[16]構建系統進化樹(圖3),用DNASTAR的Megalign比對獲得序列同源性.結果可見, YB(序列號:HQ386911)所處位置與 Paracoccus denitrificans ATCC-17741T同源性分別為 99.4%>97%,再結合生理化特征,YB 菌株與脫氮副球菌屬(Paracoccus denitrificans)相似度最高.
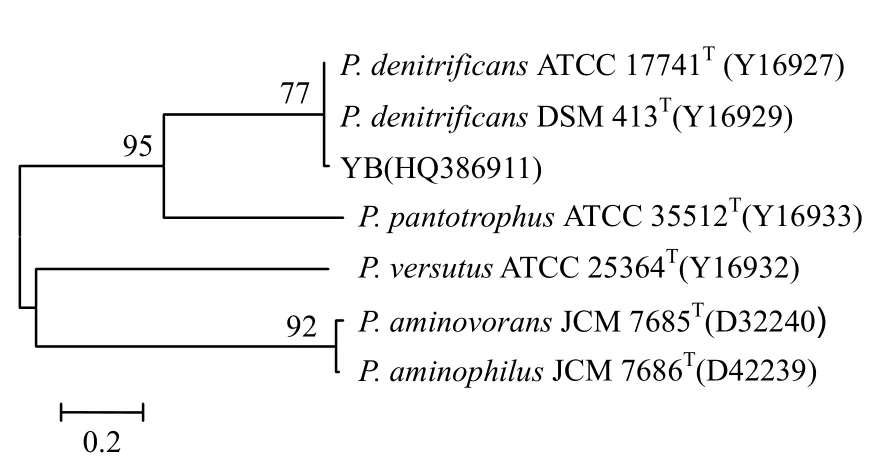
圖3 依據16S rDNA序列構建的YB菌株及相關種的系統發育樹Fig.3 The phylogenic tree construction of strain YB based on 16S rDNA sequence analysis
2.2 YB菌株與副球菌屬的關系
YB菌體形態、生理生化特性、化學分類特征和 16S rDNA基因序列等方面均與副球菌屬(Paracoccus)具有較高的相似性,如:細胞為革蘭氏陰性,長短不一的桿狀,無芽孢、兩端鈍圓,無泳動;氧化酶為陰性,接觸酶為陽性;葡萄糖氧化發酵實驗為開管產酸,閉管不產酸,即氧化產酸,為非發酵菌;能夠利用硝酸鹽和酒石酸鹽為氮源;能形成聚-β-羥基丁酸鹽顆粒.由圖3中YB菌株及相關種的 16S rDNA序列構建的系統發育樹可知,YB菌株(序列號:HQ386911)與脫氮副球菌屬(Paracoccus denitrificans) ATCC17741T親緣關系最為接近,支持度為 77%,遠遠大于 50%,16S rDNA序列的同源性比較為99.4%.由此可見,YB與脫氮副球菌最為相似.
2.3 YB菌株與反硝化聚磷的關系
YB菌株在菌種來源及功效等方面具有一定的特殊性.從菌種來源來看,副球菌屬中的菌株一般來源于病人、醫院、農藥廢水[16],從生理生化指標來看,能形成聚-β-羥基丁酸鹽顆粒,同時能將硝酸鹽還原到亞硝酸鹽再到 N2,還具有反硝化功能,以往報道的副球菌具有致病性和降解農藥廢水的作用,它們的功能不同.YB菌株的吸放磷實驗進一步證明其具有反硝化和聚磷功能,因此是一類非發酵的反硝化聚磷菌.
2.4 YB菌株在厭氧/缺氧條件下的釋/聚磷特性
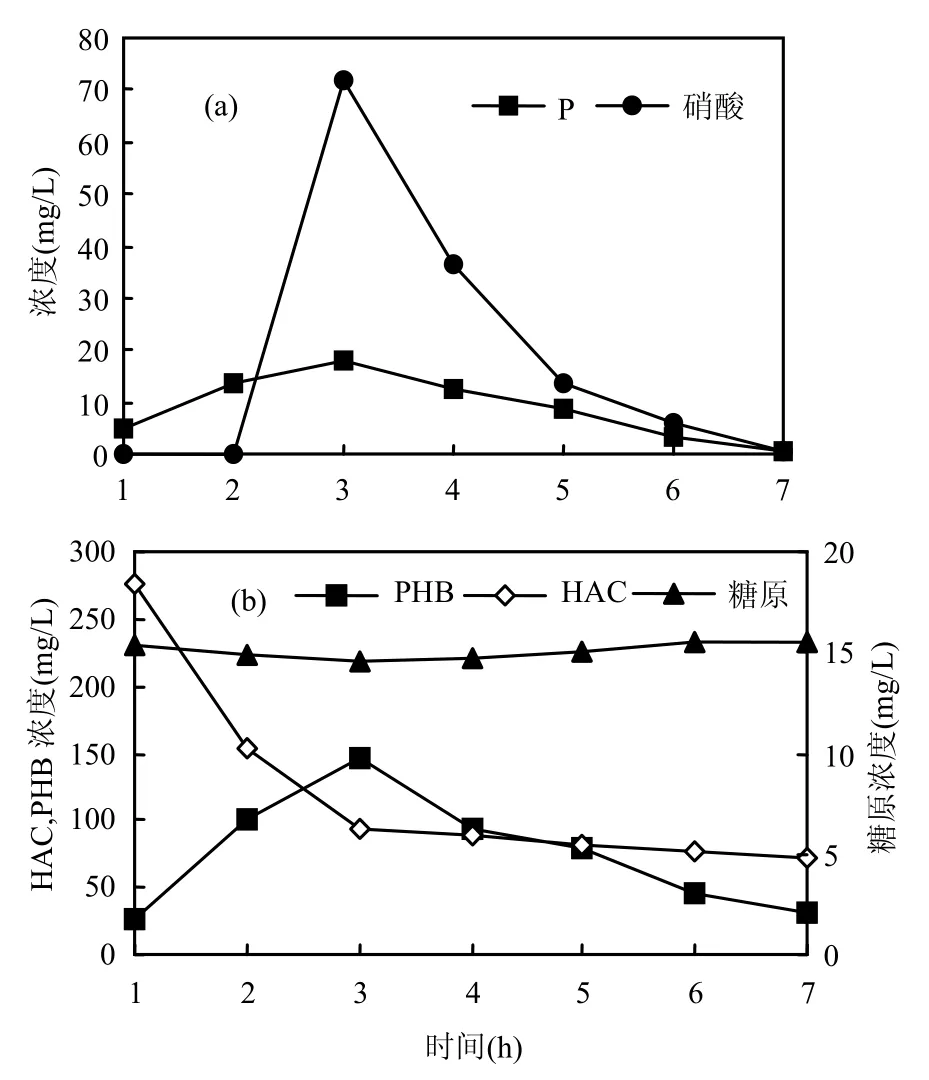
圖4 YB菌株在厭氧和缺氧條件下P、HAC、PHB、糖原、硝酸的變化Fig.4 The change of P、HAC、PHB、glycogen、nitrate under anaerobic and anoxic condition of strain YB
反硝化聚磷菌在厭氧環境下須利用水中揮發性的脂肪酸合成PHA(以PHB為主),以提供能量保證缺氧條件下過量聚磷.以乙酸為基質,研究YB菌株厭氧和缺氧條件下磷酸、乙酸、PHB、糖原、硝酸的關系特性.
厭氧2h后,投加硝酸鹽后的進入缺氧反硝化聚磷階段,結果如圖4所示.
2.5 YB菌株的厭氧和缺氧代謝模式
2.5.1 YB菌株的厭氧代謝模式 厭氧2h后,磷酸鹽(PO43以乙酸為外加碳源,污泥的缺氧反硝化聚磷效果如圖 4a所示.厭氧 2h后,磷酸鹽(PO43--P)的濃度上升了13.2mg/L,PHB濃度上升了 119.8mg/L.根據 CH1.5O0.5(PHB)+1.125O2→CO2+0.75H2O,可知PHB與COD的換算比為1.67,則△PHB= 200.1mg/L (以COD計),同時HAC的濃度下降了181.8mg/L,以COD計為194.0mg/L,因此△COD/△PHB=0.97.糖原的濃度下降了0.9mg/L.根據(1/6)C6H12O6可知, PHB與COD的換算比為1.67,則△PHB=200.1mg/L(以COD計),同時HAC的濃度下降了181.8mg/L,以COD計為 194.0mg/L,因此△COD/△PHB=0.97.糖原的濃度下降了 0.9mg/L.根據(1/6)C6H12O6+O2→CO2+0.75H2O,可知糖原與COD的換算比為1.07,即△糖原=0.96mg/L (以 COD 計),△糖原/△PHB=0.005.這說明生成 PHB的絕大部分(97.0%)來源于水的乙酸基,這是因為YB菌株為非發酵菌,無法通過糖原的酵解來獲得ATP和合成 PHB,只有通過聚磷酸鹽的釋放,將胞內的ADP轉化為ATP獲得足夠的能量同時生成PHB,如圖5所示.而以前報道的聚磷菌在厭氧條件下通過糖原酵解和聚磷酸鹽釋放的雙重途徑來獲得能量[17-21],而YB作為非發酵菌株,只能通過聚磷酸鹽的釋放這單一途徑來獲得能量,兩者的代謝模式不同.
2.5.2 非發酵菌-YB菌株的缺氧代謝模式 缺氧條件下△P/PHB=0.15>厭氧時△P/PHB=0.11,因此 YB菌株吸收過量的磷.以前報道的聚磷菌代謝模式中PHB分解產生的ATP有2種利用途徑:大部分用于運輸磷酸鹽并合成聚磷,另一部份用于合成糖原[22],而YB菌株屬于為非發酵菌,此時合成的糖原很少(△糖原/△PHB= 0.006), PHB分解產生的ATP多用于聚集外部的磷酸鹽并合成體內的聚磷,因此表現出良好的聚磷性能,如圖6所示,因此YB菌株在缺氧狀態下的代謝模式與以前報道的聚磷菌[4]不同.
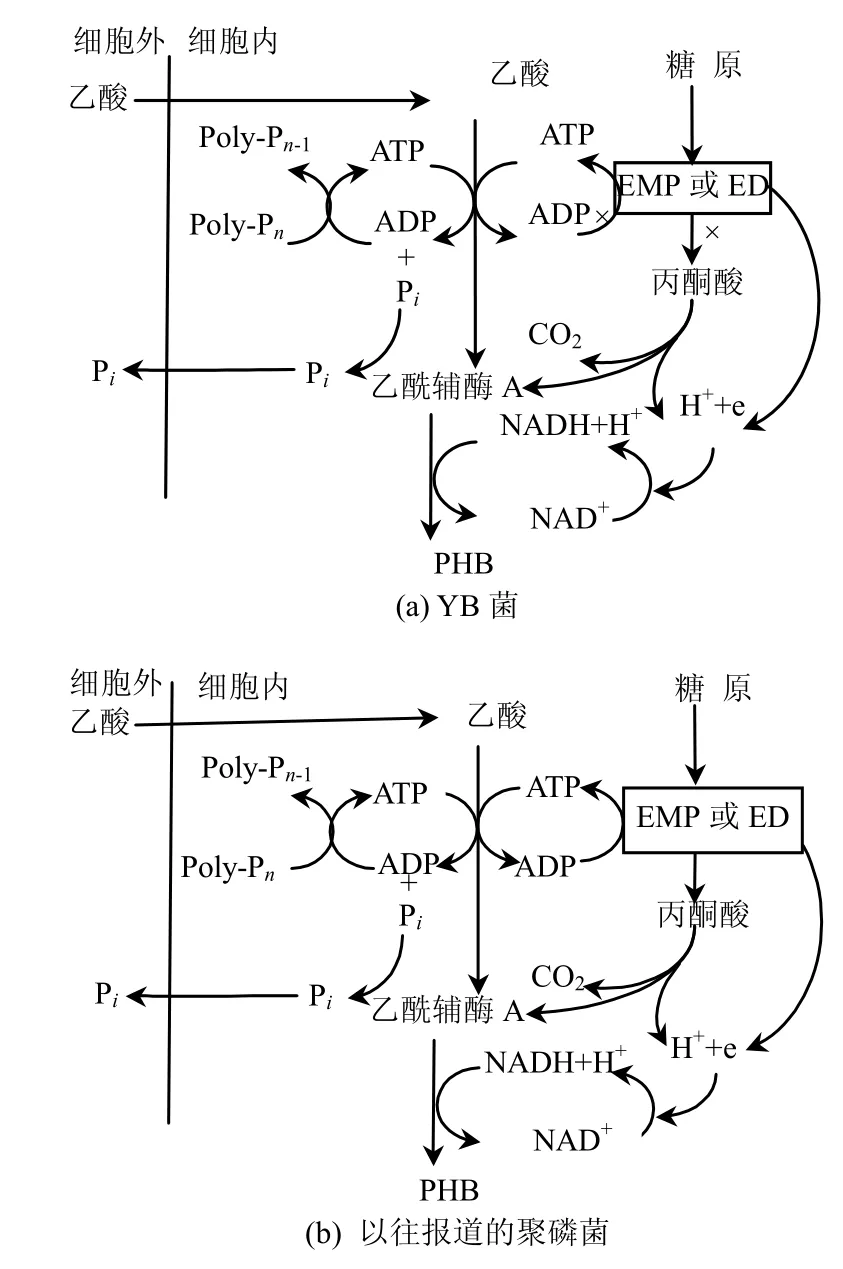
圖5 厭氧條件下聚磷菌代謝模式Fig.5 The metabolism of PAO under anaerobic condition
2.6 PHB在厭氧釋磷/缺氧反硝化聚磷階段的作用
2.6.1 PHB在厭氧釋磷階段的作用 厭氧2h后,△P/△PHB=0.11,即每合成 1mgPHB 釋放0.11mgP.表現出較好的厭氧釋磷特性.因為菌株
YB菌株作為非發酵菌,只能通過體內聚磷酸鹽的釋放來獲得能量,所以合成等量的PHB,YB菌株釋放的磷較高.因此在研究厭氧釋磷時,△P的大小將決定△PHB的合成,△PHB的合成影響后繼的缺氧聚磷效果,需要重點跟蹤△P/△PHB,而不是△P/△COD.
2.6.2 PHB在缺氧反硝化聚磷階段的作用 厭氧2h后,投加硝酸作為電子受體進行反硝化聚磷,如圖 4所示.缺氧 4h后,PO43--P的濃度下降了17.2mg/L,去除率為 96.1%.PHB的濃度下降115.9mg/L(以 COD 計為 193.6mg/L).同時NO3--N的濃度下降了71.6mg/L,去除率為99.6%.糖原的濃度由14.5mg/L上升為15.6mg/L,△糖原為 1.1mg/L(以 COD 計,為 1.2mg/L).根據5CH3COOH+8NO3-→10CO2+4N2+6H2O+8OH-可知,每 1mg NO3--N 還原為 N2時將消耗COD2.84mg,則去除71.6mg/L的NO3--N需要消耗 COD 203.3mg/L.而缺氧時 COD僅下降了23.9mg/L,因此 NO3--N下降所需的碳源不是來自水中的乙酸.
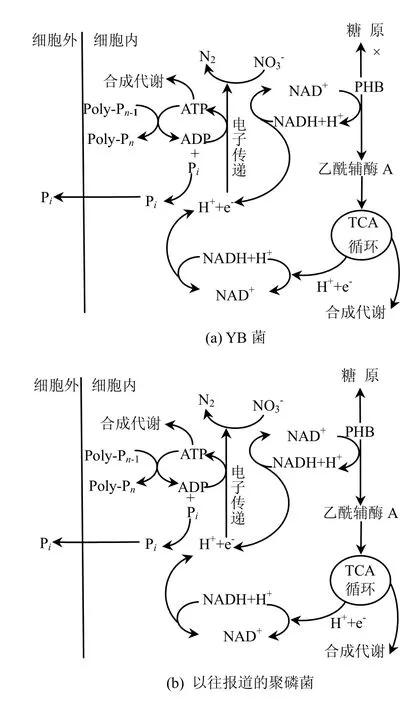
圖6 缺氧條件下聚磷菌代謝模式Fig.6 The metabolism of PAO under anoxic condition
另一方面,菌體胞內的 PHB分解,根據CH1.5O0.5+NO3-+1.5H+→CO2+0.5N2+1.5H2O 可知,每去除1mg的NO3--N所需要的 PHB為1.55mg,則去除71.6mg/L的NO3--N,需要△PHB為111.0mg/L.而實際測得的△PHB為115.9mg/L,兩者之間非常接近.因此菌體內的 PHB以NO3--N為電子受體,分解產生的乙酰輔酶通過電子傳遞作用將硝酸還原為氮氣.YB菌株在反硝化過程中所需要的碳源不是來自外部,而是來自菌體內的 PHB.因此研究反硝化效果時,應重點 跟 蹤 △NO3--N/△PHB,而 不 是 △NO3--N/△COD.
YB菌株在反硝化過程中,PHB與硝酸反應產生的 ATP為聚磷過程提供足夠的能量,此時△/PHB=0.15大于厭氧時△P/PHB=0.11,因此YB菌株吸收過量的磷.細菌體內的PHB在反硝化和聚磷過程中比外加的碳源COD起著更加重要的作用,一方面以NO3--N為電子受體,將NO3-還原成了 N2,同時在此過程中產生的 ATP又為聚磷過程提供能量,因此在研究反硝化聚磷效果時,應重點跟蹤△P/△PHB和△NO3--N/△PHB,而不是 △P/△COD、 △NO3--N/△COD 或 者△P/△NO3--N.
3 結論
3.1 YB菌株的來源及功效、生長特征、碳源利用、生理生化特征、系統發育學特征等與脫氮副球菌屬最相似,是一類非發酵的反硝化聚磷菌.
3.2 厭氧階段,YB菌株合成1mg的PHB釋放0.11mg的 P,作為非發酵菌,合成PHB所需要的能量ATP大部分來自聚磷酸鹽的釋放.在缺氧階段,YB菌株每分解1mg的PHB聚0.15mg的P,PHB分解產生的ATP多用于聚磷,因此與以前報道的聚磷菌在厭氧和缺氧條件下的代謝模式不同.
3.3 厭氧階段聚磷酸鹽的釋放將影響 PHB的合成,進一步影響反硝化聚磷效果,因此應重點跟蹤△P/△PHB的變化和△NO3--N/△PHB的變化,而不是△P/△COD、△NO3--N /△COD或者△P/△NO3--N的變化.
[1] Johwan Ahn,Tomotaka Daidou,Satoshi Tsuneda, et al. Characterization of denitrifying phosphate-accumulating organisms cultivated under different electron acceptor conditions using polymerase chain reaction-denaturing gradient gel electrophoresis assay [J]. Water Research, 2002,36:403-412.
[2] Satoshi Tsuneda, Takashi Ohno,Koichi Soejima,et al. Simultaneous nitrogen and phosphorus using denitrifying phosphate-accumulating organisms in a sequencing batch reactor [J]. Biochemical Engineering Journal, 2006,27:191-196.
[3] Satoshi Tsuneda, Ryuki Miyauchi Takashi Ohno. Characterization of denitrifying polyphosphate- accumulating organisms in activated sludge based on nitrite reductase gene [J]. Journal of Bioscience and Bioengineering, 2005,99(4):403-407.
[4] Naohiro Kishida, Juhyun Kim, Satoshi Tsuneda, et al. Anaerobic/aerobic/anoxic granular sludge process as an effective nutrient removal process utilizing denitrifying polyphosphateaccumulating organisms [J]. Wat. Res., 2006,40:2303-310.
[5] Cui Youwei, Wang Shuying, Li Jing. On-line monitoring for phosphorus removal process and bacterial community in sequencing batch reactor [J]. Chinese Journal of Chemical Engineering, 2009,17(3):484-492.
[6] 蔣軼峰,朱潤曄,鄭建軍.亞硝酸為電子受體的反硝化除磷工藝特性 [J]. 中國環境科學, 2008,28(12):1094-1099.
[7] 支霞輝,黃 霞,薛 濤,等.亞硝酸型反硝化除磷污泥馴化方式的比較 [J]. 中國環境科學, 2009,29(5):493-496.
[8] Adrian Oehmen, Aaron M Saunders, Teresa Vives M, et al. Competition between polyphosphate and glycogen accumulating organisms in enhanced biological phosphorus removal systems with acetate and propionate as carbon sources [J]. Journal of Biotechnology, 2006,123:22-32.
[9] Randall A A, Liu Y. Polyhydroxyalkanoates form potentially a key aspect of aerobic phosphorus uptake in enhanced biological phosphorus removal [J]. Water Res., 2002,36:3474-3478.
[10] Puig M S Coma, H Monclu′s, vanLoosdrecht M C M,et al. Balaguer Selection between alcohols and volatile fatty acids as external carbon sources for EBPR [J]. Water Research, 2008, 42:557-566.
[11] Zhang Chao, Chen Yinguang, Liu Yan. The long-term effect of initial pH control on the enrichment culture of phosphorus-and glycogen-accumulating organisms with a mixture of propionic and acetic acids as carbon sources [J]. Chemosphere, 2007,69: 1713-1721.
[12] Chen Y, Chen Y, Xu Q, et al. Comparison between acclimated and unacclimated biomass affecting anaerobic-aerobic transformations in removal of phosphorus [J]. Process Biochemistry the biological., 2005,40:723-732.
[13] GB 18918-2002 城鎮污水處理廠污染物排放標準 [S].
[14] George M, Garrity S D. Bergey’s manual of systematic bacteriology [M]. Vol 2. London: Williams and Wilkins Baltimore, 2004.
[15] 王愛杰,任南琪.環境中的分子生物學診斷技術 [M]. 北京:化學工業出版社, 2004:132-165.
[16] Donovan P Kelly, Jean P Euzeby, Celia F Goodhew, et al. Redefing paracoccus denitrificans and Paracoccus pantotrophus and the case for a reassessment of the strains held by international culture collections [J]. International Journal of systematic and evolutionary microbiology, 2006,56:2495-2500.
[17] Filipe C D M, Glen T, Daigger C P, et al. A metabolic model for acetate up take anaerobic conditions by glycogen accumulating organisms: stoichiometry, kinetics, and the effects of pH [J]. Biotech. Bioeng., 2001,76(1):17-31.
[18] Wang Yayi, Peng Yongzhen, Stephenson Tom. Effect of influent nutrient ratios and hydraulic retention time (HRT) on simultaneous phosphorus and nitrogen removal in a two-sludge sequencing batch reactor process [J]. Bioresource Technology, 2009,100:3506-3512.
[19] Wang Yayi, Jiang Fan zhang, Xiang Zhao, et al. The long-term effect of carbon source on the competition between polyphosphorus accumulating organisms and glycogen accumulating organism in a continuous plug-flow anaerobic/aerobic (A/O) process [J]. Bioresource Technology, 2010,101:98-104.
[20] Oehmen A, Vives TM, Lu H B, et al. The effect of pH on the competition between polyphosphate-accumulating organisms and glycogen-accumulating organisms [J]. Water Research, 2005, 39(15):3727-3737.
[21] Oehmen A, Lemos P C, Carvalho G, et al. Advances in enhanced biological phosphorus removal: from micro to macro scale [J]. Water Research, 2007,41:2271-2300.
[22] Paulo C Lemos,Dai Yu, Yuan Zhiguo, et al. Elucidation of metabolic pathways in glycogen-accumulating organisms with in vivo 13C nuclear magnetic resonance [J]. Environmental Microbiology, 2007,9(11):2694-2706.
Screening and metabolism of non- fermentive denitrifying phosphorus accumulating bacteria (DPB).
LIU Hui1,2,3, SUN Yan-fu2, JIA Xiao-shan1*, LI Jun3, ZHOU Kang-qun2, XIONG Di-cheng3, QU Xiang-dong2(1.School of Environmental Science and Engineering, Sun Yat-Sen University, Guangzhou 510275, China;2.Department of Environmental Science and Engineering, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China;3. College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 100124, China).China Environmental Science, 2011, 2011,31(6):958~964
The activated sludge and bio-membrane system was used to enrich denitrifying phosphorus bacteria (DPB) for removing nitrogen and phosphorus simultaneously. A DPB strain was screened after enrichment and denitrifying phosphorus accumulating experiments were investigated. The change of HAC/phosphate/nitrate/PHB and glycogen were studied in order to analyze the anaerobic and anoxic metabolism and the function of PHB during the process. Strain YB was similar to Paracoccus denitrificans. It was a kind of non-fermentive DPB. Strain YB released 0.11mg P per 1mg PHB during anaerobic stage. As a kind of non-fermentive bacteria, the energy was mostly from the release of poly-phosphate. Strain YB accumulated 0.15 mg P per 1mg PHB during anoxic stage. ATP from the breakdown of PHB was mostly used to accumulate phosphate. The metabolism was different from that of reported phosphate accumulating organisms (PAO). The release of poly-phosphate affected the synthesis of PHB and the impact of denitrifying and accumulating phosphate. It was very important to monitor △P/△PHB and △NO3--N /△PHB, not △P/△COD、△NO3--N /△COD or △P/△NO3--N.
denitrifying phosphorus accumulating bacteria;Paracoccus denitrificans;non-fermentive bacteria;metabolism
X172
A
1000-6923(2011)06-0958-07
2010-10-10
國家重大科技專項“水體污染控制與治理”(2008ZX07211-003);國家自然科學基金資助項目(51078008);廣東自然科學基金資助項目(06022869,07003251);廣東省教育廳項目(LYM08067)
* 責任作者, 教授, eesjxs@mail.sysu.edu
劉 暉(1973-),女,湖南岳陽人,副教授,博士,主要從事環境生物學和污水脫氮除磷的研究.發表論文30余篇.

