n-Gluc-Lys([Al18F]NOTA)-TOCA的制備和初步生物學評價
郭飛虎,陳玉清,劉 婷,陳寶軍,梁積新,徐 琪,邱 芊,陳大明,杜 進
1.中國原子能科學研究院 同位素研究所,北京 102413;2.原子高科股份有限公司,北京 102413;3.環境保護部 核與輻射安全中心 政策法規研究所,北京 100082;4.杭州中肽生化有限公司,浙江 杭州 310018;5.中國同輻股份有限公司,北京 100045
生長抑素(somatostatin,SST)是一種含有14或28個氨基酸的天然多肽類激素,廣泛分布于人體中樞內分泌系統和許多腦外組織,對垂體、胰腺和胃腸組織的各種分泌過程有抑制作用,通過與存在于細胞組織上的受體特異性結合發揮作用[1]。由于生長抑素在體內的生物半衰期非常短(約3 min),從而限制了它在臨床的應用[2]。奧曲肽是一種人工合成的生長抑素類似物,含有8個氨基酸,其性質與SST相似,與SSTR2、SSTR5亞型保持高親和力,但其結構中引入了D-型氨基酸,增強了抗酶降解的能力,體內半衰期約為2 h[3]。研究發現在奧曲肽的結構中引入糖基,可優化其體內代謝動力學特性,降低小分子多肽的親脂性和肝膽代謝程度,增加腎臟排泄[4-7]。而腫瘤細胞組織上常有一些生長抑素受體(SSTR)的過表達。因此,可用放射性核素標記奧曲肽及其衍生物對SSTR陽性腫瘤進行診斷和治療[8-9]。
早在20世紀80年代晚期,人們已經對生長抑素受體顯像進行了深入研究[4]。在放射性核素標記的生長抑素類似物中,111In-DTPA-Octreotide 作為世界上第一個獲美國FDA批準的多肽類放射性藥物,已在臨床上廣泛用于生長抑素受體陽性腫瘤的診斷[10],[123I]-Tyr3-octreotide已經用作臨床研究[11],[99Tcm]depreotide也已被批準用于肺癌的評估[4]。與SPECT相比,PET顯像有更好的優越性,如更高的靈敏度和空間分辨率,能夠對生物分布和代謝過程進行定量研究,所以對正電子核素標記的生長抑素類似物的研究也越來越多。18F半衰期為109.6 min,和奧曲肽的體內生物半衰期相匹配,β+能量較低(0.635 MeV),是一個臨床應用最廣泛、核素性質非常理想的正電子核素。18F標記的糖基化奧曲肽衍生物[18F]FP-Gluc-TOCA已經用作臨床研究,顯像效率明顯優于[111In]DTPA-octreotide。但是由于其放化合成過程繁瑣,合成時間長,放化產率低(衰變校正后僅為25%~35%),這在很大程度上影響臨床使用[4-5]。
McBride等[12-13]研究了一種通過Al18F復合物和偶聯1,4,7-三氮環壬烷-1,4,7-三乙酸(1,4,7-triazacyclononane-1,4,7-triacetic acid,NOTA)或其衍生物的多肽通過螯合反應制備18F標記正電子藥物的方法,方法新穎,合成過程簡單,尤其是在標記過程中免去了通常采用的需要嚴格控制無水條件的親核取代反應。穩定性試驗研究表明,[Al18F]NOTA在體內外都非常穩定,適合用作臨床研究。D’Souza[14]和Shetty等[15]用X射線晶體衍射對[Al19F]NOTA的空間結構進行了分析,結果顯示其空間結構為扭曲的八面體,鋁原子在八面體中心。
2010年Laverman等[16]通過該法制備了[Al18F]NOTA-octreotide。它的小動物PET/CT顯像顯示,腫瘤的輪廓清晰可見,在骨中的攝取很低。該法目前也有用作18F標記蛋白[17]、RGD[18-19]及其它多肽[14-15,20-22]研究的報道。
本工作擬在上述研究的基礎上以Fmoc保護的氨基酸、n-Gluc-Lys(Fmoc)-OH、Bis(tBu)NOTA和苯并三氮唑-N,N,N′,N′-四甲基脲六氟磷酸鹽(2-(1H-benzotriazole-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate,HBTU)等為原料設計合成偶聯雙功能螯合劑NOTA的糖基化奧曲肽衍生物n-Gluc-Lys(NOTA)-TOCA,再用Al18F標記,并測定標記物體外穩定性、水溶性及正常鼠體內分布情況,以為進一步研究Al18F復合物標記的奧曲肽衍生物作為生長抑素受體陽性腫瘤顯像劑提供實驗依據。
1 實驗內容
1.1 儀器和材料
ECLIPSE HP型回旋加速器(11 MeV),德國西門子公司;CRC?-15PET放射性活度計,美國Capintec公司;ESI-MS質譜儀,美國ThermoFinnigan公司;高效液相Agilent 1100(多肽分析),美國安捷倫公司;高效液相Waters 4000(多肽制備),美國Waters公司;高效液相系統ProStar 320系統(標記),美國Varian 公司;GABI型高效液相色譜放射性檢測儀,德國Raytest公司;Hypersil SDS2依利特色譜柱,5 μm,250 mm×4.6 mm,大連依利特分析儀器有限公司;多用恒溫箱,天津奧特賽斯儀器有限公司;MILLIPORE水凈化系統,法國Millipore S.A.公司;Oasis? HLB 1cc(30 mg)萃取柱、Sep Pak light QMA柱,美國Waters公司;液相分析條件:流動相A—水(含0.1%三氟乙酸(TFA)),流動相B—乙腈(含0.1%三氟乙酸);流速:1.0 mL/min;0 min,95%A;5 min,95%A;8 min,15%A;18 min,15%A;20 min,95%A;紫外檢測器,波長220 nm。
芴甲氧羰基-O-叔丁基-L-蘇氨酸-樹脂(Fmoc-Thr(t-Bu)-Resin)、芴甲氧羰基-S-三苯甲基-L-半胱氨酸(Fmoc-Cys(Trt)-OH)、芴甲氧羰基-O-叔丁基-L-蘇氨酸(Fmoc-Thr(t-Bu)-OH)、N-芴甲氧羰基-N′-叔丁氧羰基-L-賴氨酸(Fmoc-Lys(Boc)-OH)、N-芴甲氧羰基-N′-叔丁氧羰基-L-色氨酸(Fmoc-DTrp-(Boc)-OH)、芴甲氧羰基-O-叔丁基-L-酪氨酸(Fmoc-Tyr(t-Bu)-OH)、N-芴甲氧羰基-L-苯丙氨酸(Fmoc-DPhe-OH)、N-鏈式葡萄糖-N′-芴甲氧羰基-L-賴氨酸(n-Gluc-Lys(Fmoc)-OH)、HBTU、N-甲基嗎啉(N-methylmorpholine,NMM)、二異丙基碳化二亞胺(1,3-diisopropylcarbodiimide,DIC),純度99%,杭州中肽生化有限公司;1,4,7-三氮雜環壬烷-1,4,7-三乙酸二叔丁酯(bis-tert-butyl-1,4,7-triazacyclononane-1,4,7-triacetic acid,bis-t-Bu-NOTA),純度95%,法國CheMatech公司;冰醋酸,純度99.99%,美國Sigma-Aldrich公司;六水合三氯化鋁,光譜純,天津市光復精細化工研究所;H218O,純度98%,常熟華益化工有限公司;乙腈,色譜純,德國Merck公司;三氟乙酸,色譜純,百靈威科技有限公司;L-(+)-抗壞血酸鈉(分析純)、鄰苯二甲酸氫鉀(KHP)(優級純)、無水乙酸鈉(分析純),國藥集團化學試劑有限公司。除特別說明外,所有的商品化試劑使用前均未進一步純化處理。雄性昆明小鼠,4~6周齡(約20 g),北京華阜康生物技術有限公司。
1.2 實驗方法
1.2.1多肽的結構 擬合成多肽的結構示于圖1。
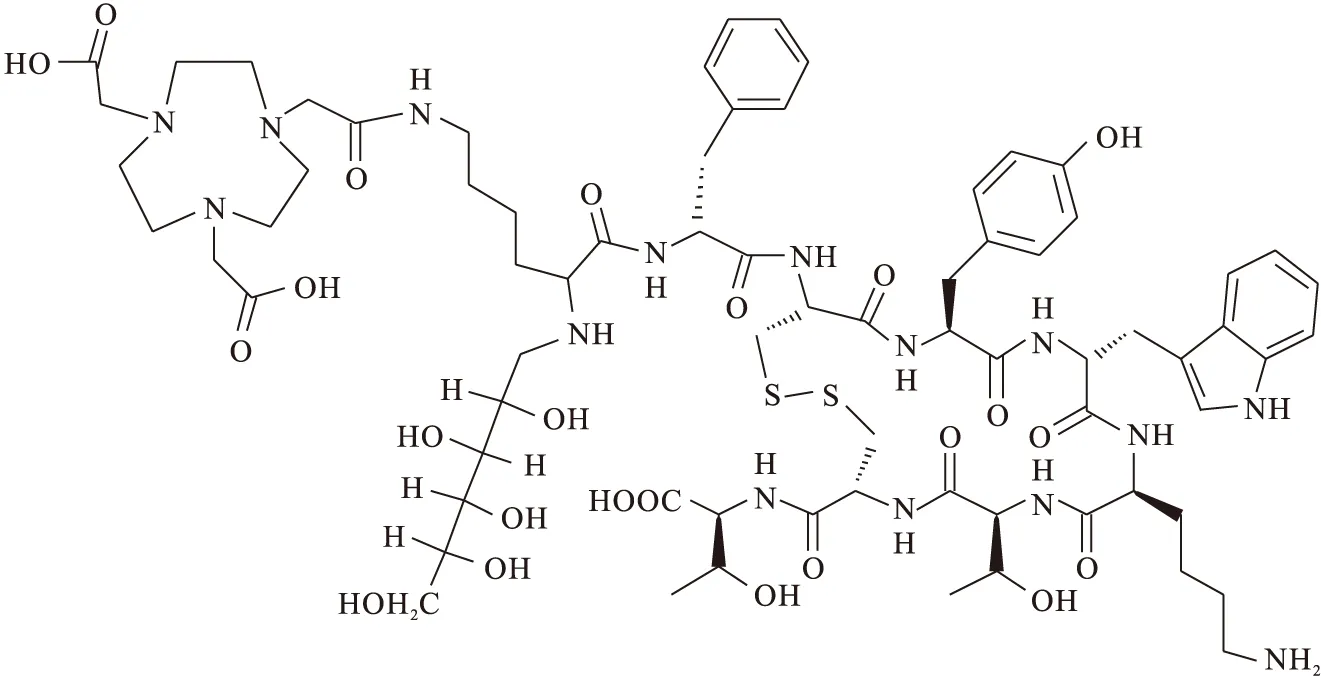
圖1 n-Gluc-Lys(NOTA)-TOCA的化學結構
1.2.2n-Gluc-Lys(NOTA)-TOCA的合成 n-Gluc-Lys(NOTA)-TOCA的合成路線示于圖2。在多肽反應器中加入260 mg Fmoc-Thr(tBu)-樹脂(1)和20%哌啶,常溫下反應30 min脫去Fmoc,用N,N-二甲基甲酰胺(DMF)洗滌3次,然后加入174 mg Fmoc-Cys(Trt)-OH、864 mg HBTU、532 μL NMM 在DMF 中反應50 min,茚三酮檢測為陰性,過濾洗滌得到Fmoc-Cys(Trt)-Thr(tBu)-Resin,重復上述操作依次加入相應的氨基酸:120 mg Fmoc-Thr(t-Bu)-OH、140 mg Fmoc-Lys(Boc)-OH、168 mg Fmoc-DTrp(Boc)-OH、69 mg Fmoc-Tyr(t-Bu)-OH、174 mg Fmoc-Cys(Trt)-OH、116 mg Fmoc-DPhe-OH、74 mg n-Gluc-Lys(Fmoc)-OH,最終得到n-Gluc-Lys(Fmoc)-Dphe-Cys(Trt)-Tyr(tBu)-DTrp(Boc)-Lys(Boc)-Thr(tBu)-Cys(Trt)-Thr(tBu)-樹脂(2)。加入20%哌啶常溫下反應30 min脫去Fmoc,用DMF洗滌3 次,然后加入42 mg Bis-t-Bu-NOTA、16 μL DIC、864 mg HOBt、532 μL NMM在DMF中反應8 h,用DMF洗滌后干燥得到肽樹脂n-Gluc-Lys(Bis-t-Bu-NOTA)-DPhe-Cys(Trt)-Tyr(tBu)-DTrp(Boc)-Lys(Boc)-Thr(tBu)-Cys(Trt)-Thr(tbu)-樹脂(3),然后在三氟乙酸中酸解2次,每次2 h,過濾,濾液用乙醚沉淀后離心,并用乙醚洗滌2次得到粗品:n-Gluc-Lys(NOTA)-DPhe-Cys-Tyr-DTrp-Lys-Thr-Cys-Thr(4)。粗品用乙腈和水溶解,用I2氧化后用高效液相(HPLC)純化,凍干后得到n-Gluc-Lys(NOTA)-TOCA,最后用質譜定性分析,用HPLC定量分析。
1.2.3n-Gluc-Lys([Al19F]NOTA)-TOCA的制備 向1.5 mL EP管中加入30 μL 2 mmol/L AlCl3的0.1 mol/L pH=4.0 的醋酸鈉緩沖液,10 μL 65 mmol/L KF的0.1 mol/L pH=4.0醋酸鈉緩沖液,20 μL 2.0 g/L的n-Gluc-Lys(NOTA)-TOCA的去離子水溶液。混合物搖勻后在105 ℃反應20 min,冷卻至常溫,用HPLC純化后用質譜進行定性分析。
1.2.4n-Gluc-Lys([Al18F]NOTA)-TOCA的制備 n-Gluc-Lys([Al18F]NOTA)-TOCA的合成路線示于圖3。
(1)18F-生理鹽水溶液的制備
在回旋加速器上用核反應18O(p,n)18F制得[18F]F-,然后富集在Sep-Park light QMA 柱上(QMA柱分別用10 mL 0.5 mol/L pH=8.4 NaOAc溶液和10 mL 去離子水淋洗),用5 mL去離子水淋洗以除去吸附在QMA柱上的金屬雜質離子,用0.2~1 mL生理鹽水洗脫得到生理鹽水溶液。
(2)AlCl3用量對標記率的影響
向5個1.5 mL EP管中分別加入10 μL 2.0 g/L n-Gluc-Lys(NOTA)-TOCA的去離子水溶液,10 μL 10 g/L抗壞血酸的0.122 mol/L鄰苯二甲酸氫鉀(KHP)溶液,100 μL 37~74 MBq18F-的生理鹽水溶液,用0.1 mol/L的稀鹽酸調節pH至4.0,再依次加入3 μL 0.5、1、2、3、4 mmol/L AlCl3的去離子水溶液。混合物搖勻后在105 ℃反應20 min,冷卻至常溫,用1 mL去離子水稀釋,取其中20 μL用HPLC測定其標記率。
(3)pH值對標記率的影響
向5個1.5 mL EP管中分別加入3 μL 1 mmol/L AlCl3的去離子水溶液,10 μL 2.0 g/L n-Gluc-Lys(NOTA)-TOCA的去離子水溶液,10 μL 10 g/L抗壞血酸的0.122 mol/L KHP溶液,100 μL 37~74 MBq18F-的生理鹽水溶液,用1 mol/L或0.1 mol/L的稀HCl將pH調至3.00、3.50、3.83、4.00、4.32和4.88。混合物搖勻后在105 ℃反應20 min,冷卻至常溫。用1 mL去離子水稀釋,取其中20 μL用HPLC測定其標記率。

圖2 n-Gluc-Lys(NOTA)-TOCA的合成路線
Fig.2 Synthesis of n-Gluc-Lys(NOTA)-TOCA
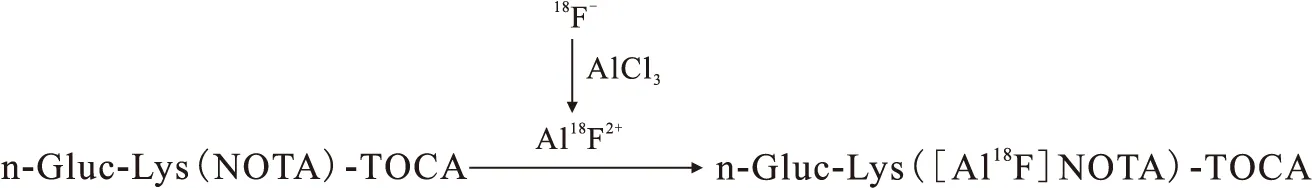
圖3 n-Gluc-Lys([Al18F]NOTA)-TOCA的合成路線
(4)不同緩沖體系對標記率的影響
取3個反應管分別編號①②③,① 號管中加入3.0 μL 1 mmol/L AlCl3pH=4的0.1 mol/L醋酸鈉溶液,10.0 μL 2.0 g/L n-Gluc-Lys(NOTA)-TOCA的0.5 mol/L醋酸鈉溶液,10 μL 10 g/L抗壞血酸的0.122 mol/L KHP溶液,100 μL 37~74 MBq18F-的生理鹽水溶液,用1.0 mol/L的稀鹽酸調節pH至4.0;② 號管加入3.0 μL 1 mmol/L AlCl3去離子水溶液,10.0 μL 2.0 g/L n-Gluc-Lys(NOTA)-TOCA的去離子水溶液,10 μL 10 g/L抗壞血酸的0.122 mol/L KHP溶液,100 μL 37~74 MBq18F-的生理鹽水溶液,用0.1 mol/L的稀鹽酸調節pH至4.0;③ 號管加入3.0 μL 0.5 mol/L AlCl3pH=4的0.1 mol/L醋酸鈉溶液,10.0 μL 2.0 g/L n-Gluc-Lys(NOTA)-TOCA pH=4的0.5 mol/L的醋酸鈉溶液,100 μL約37 MBq pH=4的[18F]F-的醋酸鉀溶液。分別搖勻后在105 ℃反應20 min,冷卻至常溫,用1 mL去離子水稀釋,取其中20 μL用HPLC測定其標記率。
(5)乙醇對標記率的影響
向反應管中加入10 μL 2.0 g/L n-Gluc-Lys(NOTA)-TOCA的去離子水溶液,3 μL 1 mmol/L AlCl3的去離子水溶液,10 μL 10 g/L抗壞血酸的0.122 mol/L KHP溶液,100 μL 37~74 MBq18F-的生理鹽水溶液,用0.1 mol/L的稀鹽酸調節pH至4.0,最后分別加入100、500 μL乙醇。搖勻后在105 ℃反應20 min,冷卻至常溫。用1 mL去離子水稀釋,取其中20 μL用HPLC測定其標記率。
(6)產品純化和質量控制
將以上反應液緩慢注入事先活化過的HLB柱,再用2 mL蒸餾水淋洗除去水溶性雜質,吹干后用500 μL 75%(體積比,下同)的乙醇淋洗,淋洗液用生理鹽水稀釋至乙醇含量小于10%,用HPLC測定其保留時間和放化純,觀察其外觀性狀是否為無色澄清透明液體,用精密pH試紙測定其pH值。
1.2.5脂水分配系數的測定 取5 μL約24 000 s-1的n-Gluc-Lys([Al18F]NOTA)-TOCA的生理鹽水溶液分別加入3個含有0.5 mL正辛醇和0.5 mL磷酸緩沖液(PBS)的1.5 mL EP管中,密封后在室溫下渦旋2 min,3 500 r/min條件下離心5 min。用移液器依次取出有機相和水相各200 μL置于γ計數管中,用γ計數器測定計數。由公式lgP=lg(有機相計數/水相計數)計算標記物的平均lgP值。
1.2.6體外穩定性研究 取20 μL約3.7 MBq的n-Gluc-Lys([Al18F]NOTA)-TOCA生理鹽水溶液,分別置于3個1 mL磷酸緩沖液(pH=7.24,0.02 mol/L)和小牛血清中,置于37 ℃下,孵育30、60、120 min后,用HPLC測定其放射化學純度,觀察其體外穩定性。
1.2.7正常小鼠體內分布 取15只正常小鼠,分為3組,每組5只,經尾靜脈注射100 μL約550 kBq的n-Gluc-Lys([Al18F]NOTA)-TOCA注射液,分別于注射后30、60、120 min時處死,取心、肝、脾、胰腺、肺、腎、胃、腸、肌肉、骨頭、血、甲狀腺等相應器官置于事先稱量好的計數管底部,稱重,測量計數。測量計數經衰變校正后計算每克組織百分注射劑量率(%ID/g)。
2 結果與討論
2.1 n-Gluc-Lys(NOTA)-TOCA的鑒定
該化合物是在奧曲肽衍生物TOCA的基礎上通過三功能連接體Lys偶聯了鏈狀葡萄糖基和NOTA。合成方法是先將葡萄糖基和NOTA引入肽鏈,再從樹脂上酸解后氧化關環,最終制備了18 mg n-Gluc-Lys(NOTA)-TOCA,收率為11%。通過質譜分析可知m/z為814.2[(M+2H)/2],與計算值相符(C73H107N15O23S2,M計算=1 626.9),通過HPLC分析可知其純度大于95.0%,保留時間為11.876 min,結果示于圖4(a)。該方法避免了用市場現有的奧曲肽連接糖基和NOTA時副反應多、收率過低甚至得不到最終產品的問題[23]。
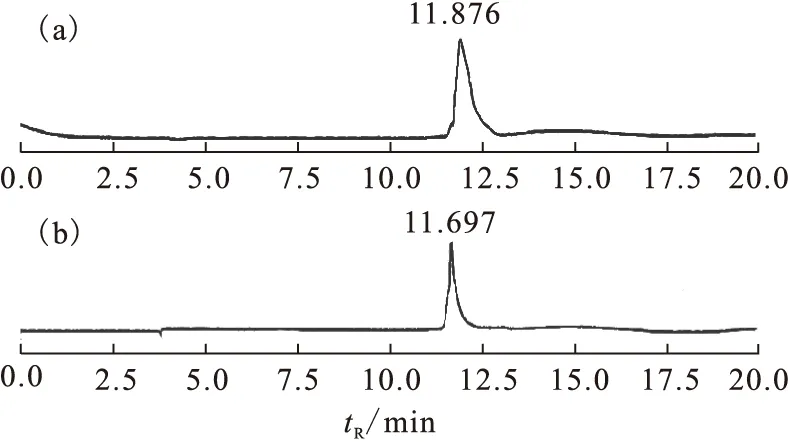
圖4 n-Gluc-Lys(NOTA)-TOCA(a)和n-Gluc-Lys([Al19F]NOTA)-TOCA(b)HPLC分析圖譜
2.2 n-Gluc-Lys([Al19F]NOTA)-TOCA的分析
用HPLC純化后的化合物通過質譜分析可知m/z為836.6[(M+2H)/2],與計算值相符(C73H107Al19FN15O23S2,M計算=1 671.7)。HPLC分析圖譜示于圖4(b),保留時間為11.697 min。
2.3 n-Gluc-Lys([Al18F]NOTA)-TOCA的合成
(1)18F-的生理鹽水溶液
18F-通常是吸附在QMA柱上后用碳酸氫鉀等堿性溶液淋洗,由于本實驗中pH是影響標記率的關鍵因素,需要用冰醋酸調節pH至4.0,這會導致實驗過程相對繁瑣,帶來較大誤差。該法先將18F-富集在用10 mL 0.5 mol/L pH=8.4 NaOAc溶液和10 mL去離子水活化過的QMA柱上,再用生理鹽水洗脫,結果顯示0.2 mL生理鹽水能洗脫約80%的18F-。
(2)AlCl3的用量
AlCl3用量對標記率的影響結果示于圖5。由圖5可知,當加入AlCl3的濃度為1 mmol/L,反應體系中AlCl3的濃度為48 μmol/L(n-Gluc-Lys(NOTA)-TOCA和AlCl3的物質的量之比為4.1∶1)時,標記率達最大值69%。可能的原因是:AlCl3的加入量不足時,Al18F的濃度過低,標記率降低;當AlCl3過量時,因為Al3+與NOTA能形成穩定絡合物[24-25],所以主要是Al3+與Al18F競爭螯合,導致標記率降低。
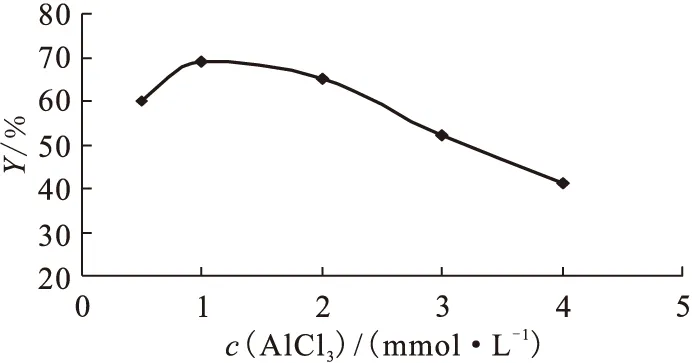
圖5 AlCl3濃度對標記率(Y)的影響
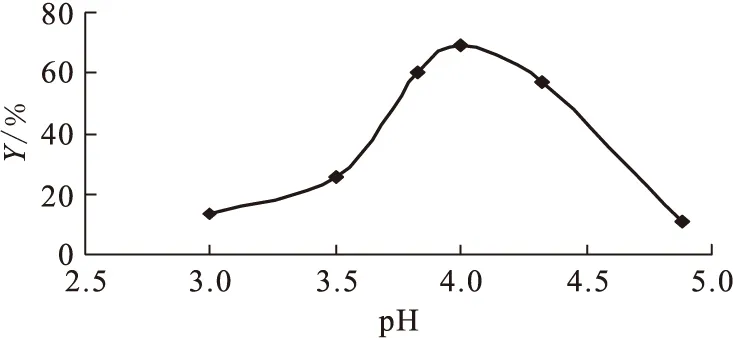
圖6 pH值對標記率(Y)的影響
(3)反應體系的pH值
其它條件保持不變的情況下,pH值對標記率的影響結果示于圖6。由圖6可知:pH值是影響標記率的關鍵因素,pH=4.00時標記率達最大值69%,這是因為pH<4時,18F-質子化為HF,pH值越小,18F-質子化程度越高,反應體系中游離的18F-濃度越低,標記率越低;當pH>5時,Al3+開始水解,溶液中游離Al3+的濃度減小,pH值越大,其水解程度越大,體系中Al3+的濃度越小,標記率越低。由文獻[26]計算可知,當pH=4.00時,AlF2+的條件形成常數lgK達最大值6.04。這和本實驗結果相符。
(4)不同緩沖體系的選擇
其它條件保持不變的情況下,比較了KHP和醋酸鈉混合緩沖體系、KHP緩沖體系、醋酸鈉緩沖體系對標記率的影響。緩沖體系①(9.76 mmol/L KHP和42.4 mmol/L醋酸鈉)的標記率為64%;緩沖體系②(9.76 mmol/L KHP)的標記率為69%;緩沖體系③(42.4 mmol/L醋酸鈉)的標記率為61%。結果表明,不同緩沖體系對標記率有一定影響,其原因可能為醋酸體系的pH受溫度的影響較大,并且加熱時醋酸會有一定程度的揮發,KHP體系pH受溫度影響較小(溫度由5 ℃升至60 ℃時pH僅由4.00升為4.09),而pH值是影響標記率大小的關鍵因素,因此,KHP緩沖體系②的標記率為最高值69%。
(5)加入乙醇的體積
其它條件保持不變的情況下,分別向反應體系中加入100 μL和500 μL乙醇時標記率分別為55%和13%,加入乙醇反而使標記率降低,這可能是因為加入乙醇降低了離子強度的同時,反應物的濃度也明顯降低。雖然降低離子強度能夠提高標記率,但是反應物的濃度也是影響標記率高低的主要因素。
總之,用n-Gluc-Lys(NOTA)-TOCA和Al18F復合物通過螯合反應快速方便的制備了n-Gluc-Lys([Al18F]NOTA)-TOCA,合成時間為25~30 min,合成時間短,有利于標記物今后的臨床應用。最佳標記條件為:10 μL 2.0 g/L n-Gluc-Lys(NOTA)-TOCA的去離子水溶液,3 μL 1 mmol/L AlCl3的去離子水溶液,10 μL 10 g/L抗壞血酸的0.122 mol/L KHP溶液和100 μL 37~74 MBq18F-的生理鹽水溶液混合后,用0.1 mol/L的稀鹽酸調節pH至4.0。混合物搖勻后在105 ℃反應20 min。即:在pH=4.0的KHP緩沖體系中,18F-的活度為37~74 MBq,反應體系中多肽濃度為196.6 μmol/L,多肽和AlCl3的物質的量之比為4.1∶1時,標記率達最大值69%。據文獻[18]報道,NOTA-Octreotide的濃度為765 μmol/L時的最佳標記率為50%,和文獻值相比,在減少多肽用量和降低多肽濃度的條件下,標記率提高19%。這可能和n-Gluc-Lys(NOTA)-TOCA的結構有關,該化合物是用賴氨酸殘基Lys將NOTA和TOCA偶聯,Lys側鏈較長,減小了空間位阻,這些因素可能在一定程度上影響其標記率。
(6)產品純化和分析
標記物經HLB柱純化后用HPLC進行分析,放化純大于95%,保留時間為12.12 min,比n-Gluc-Lys([Al19F]NOTA)-TOCA的保留時間滯后約0.42 min,如圖7,這是因為放射性檢測器連接在紫外檢測器之后。標記物生理鹽水溶液的外觀性狀為無色澄清透明液體,用精密pH試紙測得pH=5~6。
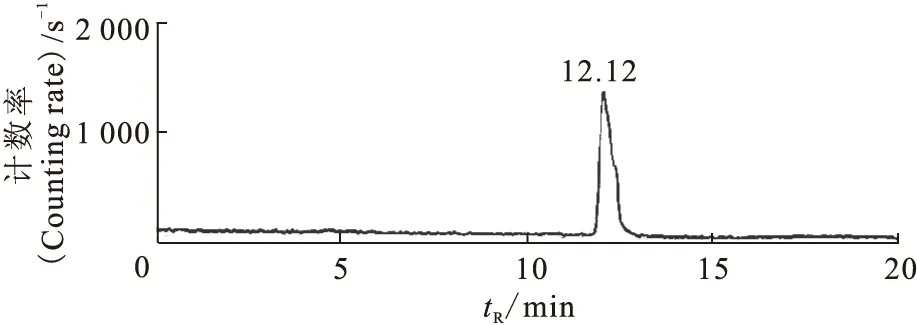
圖7 n-Gluc-Lys([Al18F]NOTA)-TOCA HPLC分析圖譜
2.4 脂水分配系數
為了研究n-Gluc-Lys([Al18F]NOTA)-TOCA的水溶性,測得其在正辛醇和PBS中的脂水分配系數lgP=-4.20±0.09(n=3),說明該化合物水溶性高,利于腎臟代謝,能夠降低肝膽中的攝取。文獻[16]報道[Al18F]NOTA-octreotide的lgP=-2.44±0.12。說明該化合物C末端的羧基和糖基化作用增加了標記物的水溶性,這和預期的結果一致。
2.5 體外穩定性
n-Gluc-Lys([Al18F]NOTA)-TOCA在磷酸緩沖液(PBS)(pH =7.24,0.02 mol/L)和小牛血清(BS)中37 ℃下孵育30、60、120 min后放化純沒有顯著變化,均大于95%,表明標記物體外穩定。120 min的HPLC分析圖譜示于圖8。
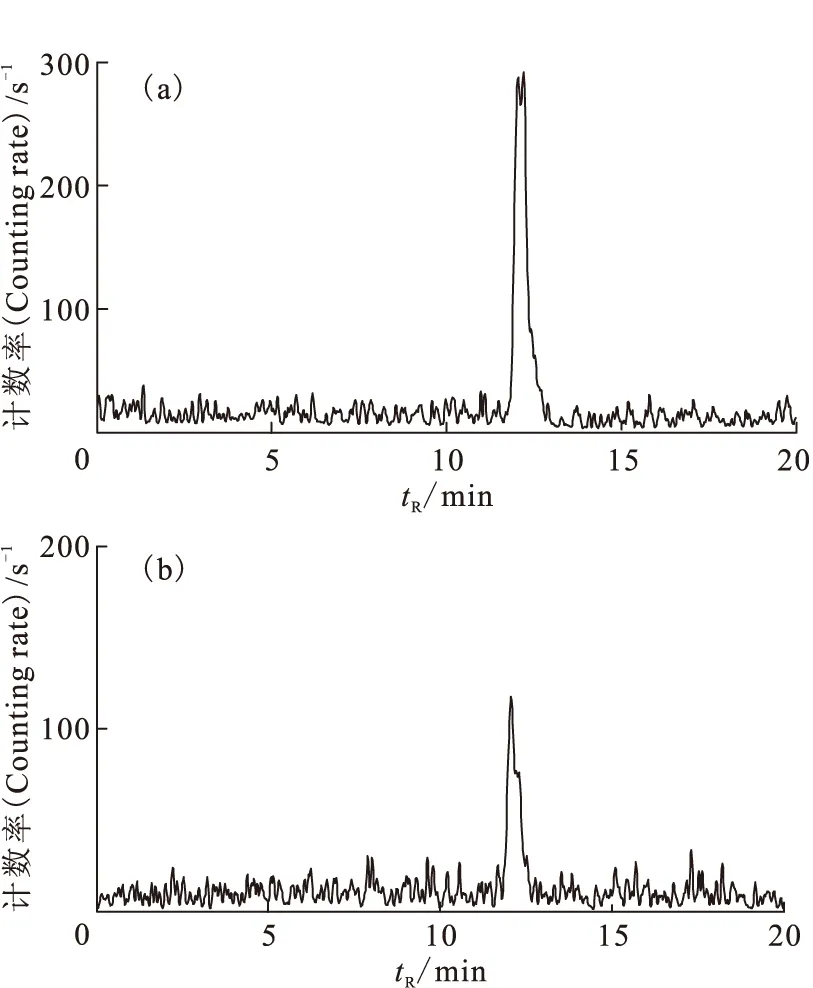
圖8 n-Gluc-Lys([Al18F]NOTA)-TOCA體外穩定性分析圖譜
2.6 正常鼠體內分布實驗
n-Gluc-Lys([Al18F]NOTA)-TOCA在正常鼠體內分布數據列入表1。由表1可知:標記物注入體內30、60、120 min時,腎臟的放射性攝取值均為最高,說明標記物主要通過腎臟代謝;在血液中的攝取低、清除快;30、60、120 min時肝臟中的攝取很低,分別為(0.34±0.04)、(0.23±0.04)、(0.08±0.01)%ID/g,說明標記物不是通過肝膽代謝,這和最初的設計目標一致;120 min時,骨中的放射性攝取僅為(0.46±0.13)%ID/g,進一步證明了標記物在體內不易脫[18F]氟和Al18F,這和體外穩定性結果一致;標記物在SSTR有表達的胰腺中有攝取,表明其與生長抑素受體有親和力。總之,從正常鼠體內分布結果可以推斷,在后續顯像研究中,顯像本底較低,有利于獲取良好的PET顯像。荷瘤裸鼠體內分布實驗和PET顯像研究正在進行。
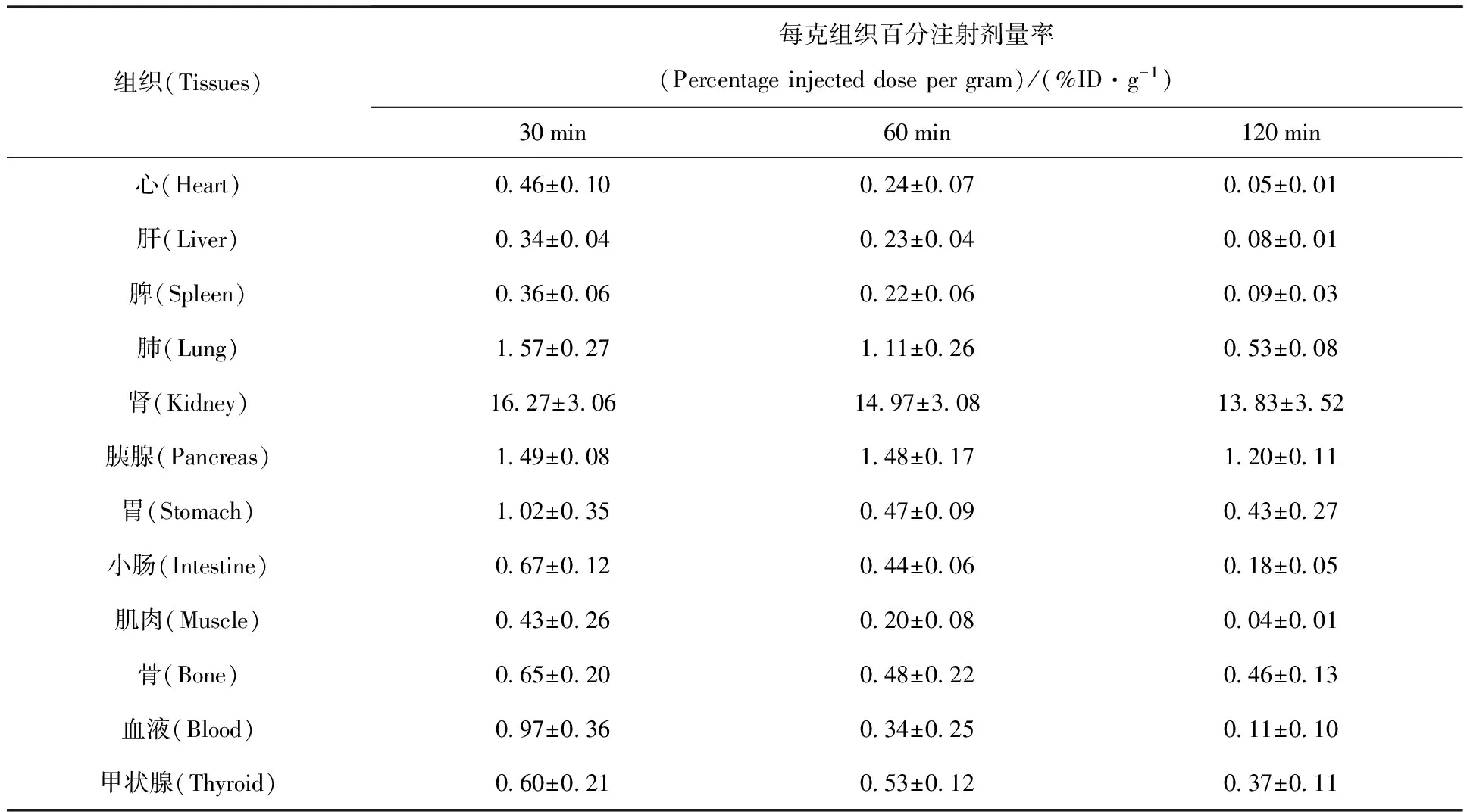
表1 n-Gluc-Lys([Al18F]NOTA)-TOCA的正常鼠體內分布
注(Note):n=5
3 結 論
用Al18F復合物和n-Gluc-Lys(NOTA)-TOCA通過螯合反應制備了n-Gluc-Lys([Al18F]NOTA)-TOCA。標記物水溶性高、體外穩定、體內外無脫[18F]氟和Al18F現象,主要通過腎臟代謝,與生長抑素受體有親和力。血液本底低,在肝臟、肌肉、骨等其它正常組織中的攝取低。本工作為進一步研究Al18F復合物標記的奧曲肽衍生物作為生長抑素受體陽性腫瘤顯像劑提供了實驗依據。
致謝:感謝趙貴植研究員、鄧雪松、岳文強、溫凱、石翠燕、江曉、劉強、葛彪、殷胤、李雯等人在本文完成過程中給予的幫助,感謝原子高科醫學三部提供18F離子。
[1]Reichlin S.Somatostatin[J].N Engl J Med,1983(309):1 495-1 563.
[2]王麗華,汪勇先,尹端沚.生長抑素及其類似物的標記技術的發展[J].核技術,2003,26:537-544.
[3]Bardfeid P A,Chervu L R,Myrty D Rk.The Organ Distribution of131I-Tyrosyl Somatostatin[J].Br J Radiol,1976(49):381-382.
[4]Wester H J,Schottelius M,Scheidhauer K,et al.PET Imaging of Somatostatin Receptors:Design,Synthesis and Preclinical Evaluation of a Novel18F-Labelled,Carbohydrated Analogue of Octreotide[J].Eur J Nucl Med Mol Imaging,2003,30:117-122.
[5]Günther M,Thorsten P,Alexander S,et al.Gluc-Lys ([18F]FP)-TOCA PET in Patients With SSTR-Positive Tumors:Biodistribution and Diagnostic Evaluation Compared With [111In]DTPA-Octreotide[J].J Nucl Med,2006,47:566-573.
[6]Schottelius M,Poethko T,Herz M,et al.First18F-Labeled Tracer Suitable for Routine Clinical Imaging of SST Receptor-Expressing Tumors Using Positron Emission Tomography[J].Clin Cancer Res,2004(10):3 593-3 606.
[7]Carmen W,Beatrice W,Andrea A,et al.One-Step18F-Labeling of Carbohydrate-Conjugated Octreotate-Derivatives Containing a Silicon-Fluoride-Acceptor (SiFA):InVitroandinVivoEvaluation as Tumor Imaging Agents for Positron Emission Tomography(PET)[J].Bioconjugate Chem,2010,21 (12):2 289-2 296.
[8]Hofland L J,Lamberts S W,van Hagen P M,et al.Crucial Role for Somatostatin Receptor Subtype 2 in Determining the Uptake of [111In-DTPA-D-Phe1]octreotide in Somatostatin Receptor-Positive Organs[J].J Nucl Med,2003,44(8):1 315-1 321.
[9]武鳳玉.放射性核素標記奧曲肽腫瘤受體顯像研究進展[J].國外醫學腫瘤學分冊,2005,32(10):760-763.
[10]Krenning E P,Bakker W H,Kooij P P M,et al.Somatostatin Receptor Scintigraphy With In-111-DTPA-D-Phe-1-octreotide in Man:Metabolism,Dosimetry and Comparison With Iodine-123-Try-3- Octreotide[J].J Nucl Med,1992,33:652-658.
[11]Krenning E P,Kwekkeboom D J,Bakker W H,et al.Somatostatin Receptor Scintigraphy With [111In]-DTPA-D-phe1]and [125I-Tyr3]-Octreotide:The Rotterdam Experience With More Than 1 000 Patients[J].Eur J Nucl Med,1993,20:716-731.
[12]McBride W J,Sharkey R M,Karacay H D S,et al.A Novel Method of18F Radiolabeling for PET[J].J Nucl Med,2009,50:991-998.
[13]McBride W J,Karacay H D S,Sharkey R M,et al.Improved18F Labeling of Peptides With a Fluoride-Aluminum-Chelate Complex[J].Bioconjugate Chem,2010,21:1 331-1 340.
[14]D’Souza C A,McBride W J,Sharkey R M,et al.High-Yielding Aqueous18F-Labeling of Peptides via Al18F Chelation[J].Bioconjugate Chem,2011,22:1 793-1 803.
[15]Shetty D,Choi S Y,Jeong J M,et al.Stable Aluminium Fluoride Chelates With Triazacyclononane Derivatives Proved by X-Ray Crystallography and18F-Labeling Study[J].Chem Commun,2011,47:9 732-9 734.
[16]Laverman P,McBride W J,Sharkey R M,et al.A Novel Facile Method of Labeling Octreotide With18F-Fluorine[J].J Nucl Med,2010,51:454-461.
[17]McBride W J,D’Souza C A,Sharkey R M,et al.The Radiolabeling of Proteins by the[18F]AlF Method[J].Appl Radiat Isot,2012,70:200-204.
[18]Liu S L,Liu H G,Jiang H,et al.One-Step Radiosynthesis of18F-AlF-NOTA-RGD2for Tumor Angiogenesis PET Imaging[J].Eur J Nucl Med Mol Imaging,2011,38:1 732-1 741.
[19]Lang L X,Li W H,Guo N,et al.Comparison Study of [18F]FAl-NOTA-PRGD2,[18F]FPPRGD2,and [68Ga]Ga-NOTA-PRGD2for PET Imaging of U87MG Tumors in Mice[J].Bioconjugate Chem,2011,22:2 415-2 422.
[20]郭飛虎,陳玉清,劉婷,等.Al18F復合物標記奧曲肽類似物的研究[C]∥第十一屆全國放射性藥物和標記化合物會議論文集.廣州:中國核學會同位素分會.2011.
[21]王立振,楊敏,徐宇平,等.Al18F-NOTA-PRGD2的制備與小動物PET顯像[C]∥第十一屆全國放射性藥物和標記化合物會議論文集.廣州:中國核學會同位素分會.2011.
[22]翟創彥,王淑俠,何山震,等.Al18F絡合標記NOTA-RGD的體外穩定性研究[C]∥第十一屆全國放射性藥物和標記化合物會議論文集.廣州:中國核學會同位素分會.2011.
[23]羅聯哲.生長抑素類似物99Tcm-EDDA/HYNIC-Lys0-TOCA的制備及其糖基化衍生物合成方法研究[D].北京:中國原子能科學研究院,2006.
[24]Bossek U,Hanke D,Wieghardt K.Pendent Arm Macrocyclic Complexes:Crystal Structures of Al(TCTA)and In(TS-TACN)[J].Polyhedron,1993,12(1):1-5.
[25]Andre J P,Macke H,Kaspar A,et al.InVivoandinVitro27Al NMR Studies of Aluminum(Ⅲ)Chelates of Triazacyclononane Polycarboxylate Ligands[J].J Inorg Biochem,2002,88:1-6.

