多黏菌素臨床藥理學(xué)研究新進展
趙 苗, 張 菁, 張嬰元
多黏菌素臨床藥理學(xué)研究新進展
趙 苗, 張 菁, 張嬰元
多黏菌素; 藥動學(xué); 藥效學(xué); 臨床應(yīng)用
近年來,廣譜抗菌藥物廣泛用于治療革蘭陰性桿菌所致的醫(yī)院內(nèi)重癥感染,導(dǎo)致耐多藥(multidrug resistant,MDR)菌和泛耐藥(extreme-drug resistant,XDR)菌逐年上升,尤其是銅綠假單胞菌、鮑曼不動桿菌等不發(fā)酵糖革蘭陰性桿菌最為突出,由于這些病原菌對許多抗菌藥物存在天然耐藥,且極易獲得耐藥性,造成治療失敗或患者的病死率增加,然而近期除了替加環(huán)素批準(zhǔn)用于治療MDR鮑曼不動桿菌(但該藥對銅綠假單胞菌無效)外,再無其他新研發(fā)的針對這類細(xì)菌感染的藥物,所以多黏菌素這一老藥被再次啟用,作為治療XDR革蘭陰性桿菌感染的最后選擇。
盡管過去的數(shù)十年里,多黏菌素使用較少,藥動學(xué)(PK)和藥效學(xué)(PD)資料很少,但近年來該藥的使用明顯增多,且出現(xiàn)了耐藥性,包括異質(zhì)性耐藥,因此,對多黏菌素的藥理特性進行研究,獲得最佳的臨床治療方案,并防止耐藥性的產(chǎn)生,迫在眉睫。本文對多黏菌素的PK和PD研究現(xiàn)狀,以及臨床應(yīng)用和不良反應(yīng)研究進展進行綜述。
一、概述
多黏菌素是于1947年從多黏芽孢桿菌培養(yǎng)液中獲得的一類陽離子多肽類抗生素,它有5種不同的化學(xué)結(jié)構(gòu)(多黏菌素A、B、C、D和E)。但是由于其他幾種毒性太大,只有多黏菌素B和E(又稱黏菌素,colistin)用于臨床。但之后因報道稱多黏菌素引起顯著的腎毒性和神經(jīng)毒性,于20世紀(jì)70年代末逐漸被眾多低毒廣譜抗菌藥物所取代[1]。
多黏菌素B和E都是由30多種成分組成的混合物,其中主要成分為B1、B2和E1、E2。其結(jié)構(gòu)中含有1個氨基酸組成的環(huán)狀七肽,在該環(huán)狀肽上又連接了1個連有脂肪酸的三肽側(cè)鏈,B和E在結(jié)構(gòu)上僅有1個氨基酸的不同。多黏菌素具有兩親性,不被腸道吸收,可被脂肪酶酶解失活,固態(tài)時非常穩(wěn)定。目前可用的商品化產(chǎn)品有多黏菌素E硫酸鹽,多黏菌素E甲磺酸鹽(colistin methanesulphonate,CMS),多黏菌素B硫酸鹽。CMS由多黏菌素E與甲醛和亞硫酸鈉反應(yīng)而得,在體內(nèi)外均不穩(wěn)定,易水解[2]。
多黏菌素E硫酸鹽可用作口服給藥或者局部給藥。CMS多用于靜脈注射,也有用作肌內(nèi)注射,霧化吸入或鞘內(nèi)注射。多黏菌素B硫酸鹽用于靜脈注射,肌內(nèi)注射,霧化吸入。目前廣泛使用的制劑的商品規(guī)格見表1,前兩種均為CMS制劑,此外美國和歐洲所使用的計量單位不統(tǒng)一。
二、抗菌活性和耐藥性
(一)抗菌活性和耐藥性 多黏菌素B和E的抗菌譜相近。兩者均對絕大多數(shù)革蘭陰性菌具有強大抗菌作用。所有革蘭陽性菌、真菌、厭氧菌以及部分革蘭陰性球菌(淋病奈瑟菌、腦膜炎奈瑟菌)、寄生蟲等對其固有耐藥。
多黏菌素B和E的殺菌作用均呈濃度依賴性,濃度在MIC左右或更高時有很快的起始?xì)⒕饔茫欢螘r間后會出現(xiàn)再生長現(xiàn)象,在高濃度時對標(biāo)準(zhǔn)菌株有輕微的抗生素后效應(yīng)(1 h),對臨床菌株幾乎沒有[4]。一些細(xì)菌的敏感性見表2,由于CMS是無活性的前藥,測定多黏菌素E的MIC值時以硫酸鹽作為參考標(biāo)準(zhǔn)。根據(jù)美國臨床實驗室標(biāo)準(zhǔn)化委員會規(guī)定,對于銅綠假單胞菌和鮑曼不動桿菌,MIC≤2 mg/L為敏感[5]。
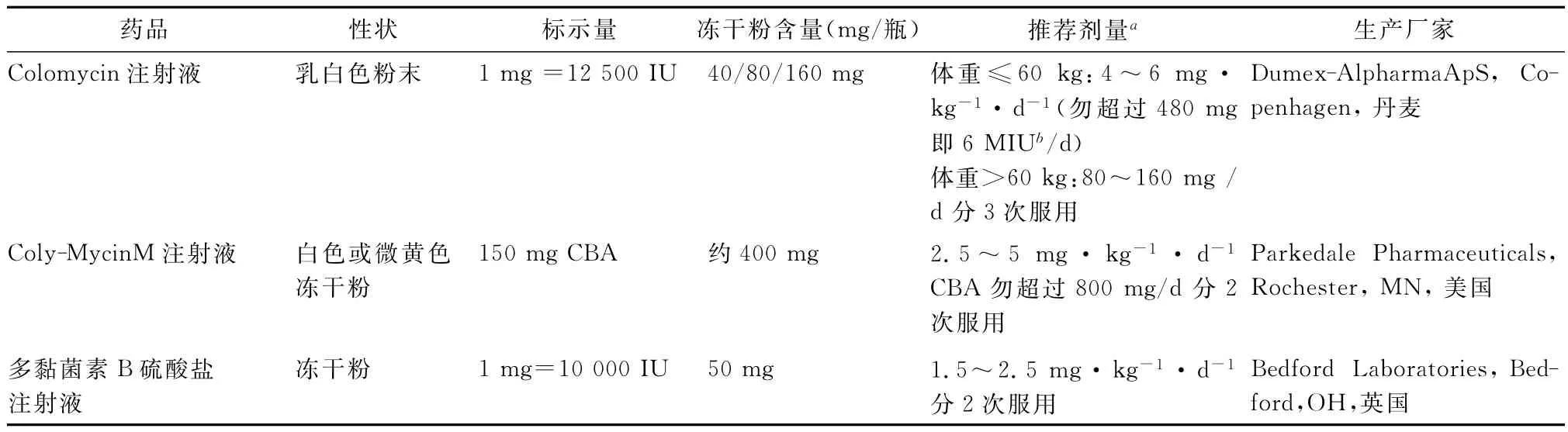
表1 多黏菌素商品規(guī)格[2-3]Table 1.Commercial products of polymyxins
近年來隨著多黏菌素被越來越多的關(guān)注和應(yīng)用,耐藥菌株也隨之出現(xiàn),且多黏菌素B和E存在交叉耐藥。此外,鮑曼不動桿菌存在異質(zhì)性耐藥菌株[6]。
(二)機制 多黏菌素的陽離子環(huán)狀多肽與磷酸根陰離子結(jié)合,置換Ca2+、Mg2+離子,破壞細(xì)胞膜完整性,使其通透性增加導(dǎo)致胞內(nèi)重要物質(zhì)外漏,從而死亡[7]。膜完整性的破壞也使得其對親水性抗生素如利福平,碳青霉烯類、糖肽類抗生素和四環(huán)素的敏感性增加,這可能也是多黏菌素與這些藥物產(chǎn)生協(xié)同作用的原因。
耐藥的機制一般認(rèn)為是由于細(xì)菌脂多糖的修飾,也有研究報道與基因突變有關(guān)[8]。此外,關(guān)于多黏菌素耐藥菌危險因素的病例對照研究顯示多黏菌素的使用是唯一的獨立風(fēng)險因素[9]。
三、PK特征
盡管多黏菌素從發(fā)現(xiàn)至今已50多年,但過去一直采用微生物法研究其PK特性,近年來高效液相和液質(zhì)聯(lián)用分析方法的發(fā)展為多黏菌素的PK研究提供了更為精確、靈敏、特異的工具,使我們對多黏菌素的認(rèn)識更加清晰。以下我們僅對采用這些新方法的藥動學(xué)研究做一概述。
(一)多黏菌素E
1.臨床前PK研究:CMS作為前藥[10],靜脈注射后在體內(nèi)代謝為活性藥物colistin,并很快(5 min)達到峰濃度,但只有6.8%CMS代謝為colistin,這意味著要達到有效的殺菌濃度,必須使用大劑量的CMS。CMS主要分布在細(xì)胞外液中,半衰期短(約20 min),主要經(jīng)腎排泄(60%~70%),而且可能存在腎小管分泌。
Colistin的血漿蛋白結(jié)合率較高(56%),主要分布在細(xì)胞外液中,半衰期較CMS長。存在腎小管的重吸收[11],這可能會導(dǎo)致藥物在腎臟蓄積,從而引發(fā)腎毒性。整個體內(nèi)過程可用圖1表示。此外,研究表明肝功能不全對多黏菌素E的PK特性無顯著影響[12]。

表2 常見革蘭陰性菌對多黏菌素B和E的敏感性[5]Table 2.Antimicrobial activity of polymyxin B and colistin against the common Gram-negative isolates
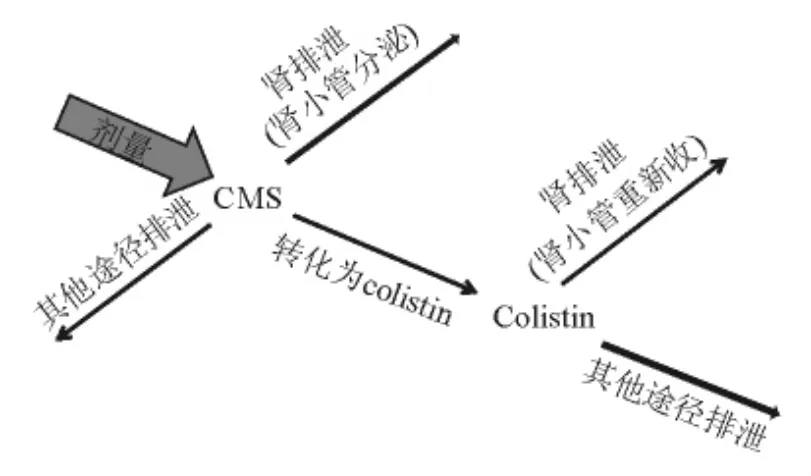
圖1 CMS靜脈注射后體內(nèi)過程FIG.1.Physiological disposition of CMS afterintravenous injection
CMS霧化吸入時與靜脈注射不同,colistin達到峰濃度很慢(163 min),CMS的Cmax也低得多,但colistin的血藥濃度-時間曲線下面積是靜脈注射時的4倍左右。一般認(rèn)為局部噴霧給藥可降低全身血液中藥物的暴露程度,降低不良反應(yīng),但研究表明并非如此。上皮襯液中藥物濃度很高,足以達到殺菌要求[13]。
2.臨床PK研究:與臨床前研究結(jié)果相似,在人體內(nèi)CMS也是主要經(jīng)腎途徑排泄,colistin主要經(jīng)非腎途徑排泄,colistin半衰期較CMS長,但在不同的患者人群中,colistin半衰期不同,健康志愿者中最短,其次是囊性纖維化患者(約4 h)[14],危重患者的藥物半衰期顯著增加,見表3。雖然colistin主要經(jīng)非腎途徑排泄,但腎功能降低時,由于CMS排泄減少,更多的代謝為colistin,通過重吸收而使colistin血藥濃度增加,從而使得半衰期延長。從表3中可以看出,在給藥方案為2~3 MIU CMS,每8小時1次,colistin的Cmax普遍不能或剛達到有效的治療濃度。這些都提示為達到更好的殺菌效果,應(yīng)增大給藥劑量,延長給藥間隔[15]。

表3 人體內(nèi)colistin和CMS的藥動學(xué)特征Table 3.Pharmacokinetic characteristics of colistin and CMS in human
一項在革蘭陰性菌感染危重患者中進行的CMS靜脈給藥群體藥動學(xué)研究[18]顯示,給予CMS 3 MIU,每8小時1次時,第1次給藥后最大血藥濃度很低,即使在穩(wěn)態(tài)時Cmax也只有2.3 mg/L。這可能會導(dǎo)致重癥患者的病死率增高,產(chǎn)生耐藥菌株。這提示應(yīng)當(dāng)給予負(fù)荷劑量,優(yōu)化給藥方案,且作者也對此進行了模擬,結(jié)果顯示常用給藥方案(3 MIU,每8小時1次)在2~3 d后colistin血藥濃度才達到穩(wěn)態(tài),而給予負(fù)荷劑量9 MIU,維持劑量為4.5 MIU,每12小時1次,達穩(wěn)態(tài)時間明顯縮短。且一項臨床研究已證實該給藥方案的療效,其臨床治愈率高達82.1%,腎毒性發(fā)生率為17.8%,且在停藥后10 d內(nèi)逆轉(zhuǎn)[21]。
一項更大范圍的群體PK研究[20](105例患者,包含接受血液透析12例和連續(xù)性腎替代治療4例患者)結(jié)果顯示:colistin的穩(wěn)態(tài)血藥濃度與肌酐清除率呈負(fù)相關(guān),腎功能受損患者在目前的給藥劑量下反而可以得到合適的colistin濃度。此外作者還給出了具體的負(fù)荷劑量和維持劑量(均指CBA的劑量)調(diào)整計算公式,如下所示:
負(fù)荷劑量(mg)=Ccoli,sstarget2.0體重(kg)
維持劑量(mg)=Ccoli,sstarget(1.5CrCL+30)
其中 CrCL 單位為(m L/min)/1.73 m2,但當(dāng)Cr CL>70時,要達到治療濃度,所需藥物劑量太大,因此作者認(rèn)為對于腎功能中度損害或腎功能正常的患者以及MIC≥1.0 mg/L的細(xì)菌最好聯(lián)合使用其他抗生素。
此外,臨床PK研究與臨床前研究略有不同:①在人體內(nèi)colistin濃度是緩慢升高的;②臨床研究多采用群體藥動學(xué)方法,結(jié)果顯示CMS符合二房室模型,colistin符合一房室模型;③由于沒有關(guān)于直接服用colistin硫酸鹽的臨床研究,無法計算CMS在人體內(nèi)轉(zhuǎn)化成colistin的比例。
(二)多黏菌素B硫酸鹽 多黏菌素B的PK研究非常少,見表4。與多黏菌素E硫酸鹽類似,多黏菌素B也主要經(jīng)非腎途徑代謝,可能存在腎小管的重新收。在一項研究中,Cmax遠(yuǎn)遠(yuǎn)超過MIC值,但是由于蛋白結(jié)合率非常高(78.5%~92.4%),真正的游離藥物濃度可能低于或者剛好在MIC值附近。此外,危重患者的平均蛋白結(jié)合率遠(yuǎn)遠(yuǎn)高于健康人,可能是由于危重患者血中α1-酸性糖蛋白濃度高所致。因此在調(diào)整給藥方案時,應(yīng)將這些因素考慮在內(nèi)。
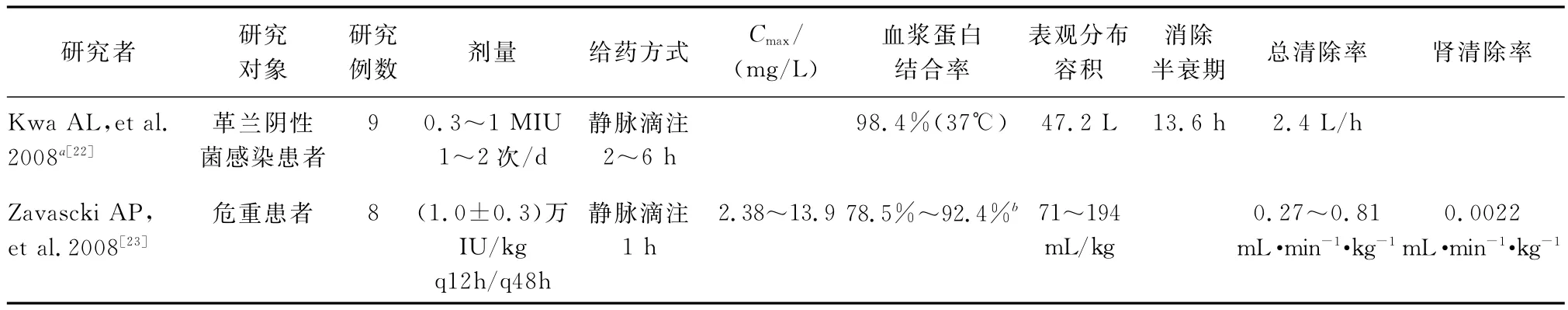
表4 人體內(nèi)多黏菌素B硫酸鹽藥動學(xué)特征Table 4.Pharmacokinetic characteristics of polymyxin B in human
四、PK/PD研究
近期的研究多采用劑量分割法來探討能夠指示殺菌效力的最佳PK/PD參數(shù)。1項體外PK/PD模型研究了colistin硫酸鹽對3株銅綠假單胞菌的殺菌作用,并考慮藥物與培養(yǎng)基的結(jié)合率問題,結(jié)果顯示f AUC/MIC為最佳指示參數(shù)。大鼠的腿部和肺部感染模型中,對3株銅綠假單胞菌[24]和3株鮑曼不動桿菌[25](其中2株異質(zhì)性耐藥)的研究也證實了這一點。
目前,幾乎沒有多黏菌素B的PK/PD研究,僅有1項研究中采用PD感染模型的研究,結(jié)果顯示初期對銅綠假單胞菌有快速殺滅作用,但無論給藥間隔如何,均出現(xiàn)細(xì)菌再生長,表明多黏菌素B的殺菌療效與AUC/MIC關(guān)系最大[26]。
五、臨床應(yīng)用
(一)多黏菌素E
1.CMS:CMS被廣泛用于多重耐藥的革蘭陰性菌(特別是銅綠假單胞菌、鮑曼不動桿菌和肺炎克雷伯菌)所引起的重癥感染。最近1項薈萃分析表明,無論是靜脈注射還是霧化吸入,在使用多黏菌素E治療呼吸機相關(guān)性肺炎時無顯著性差異,臨床有效率為72%,病死率為34%[27]。1項針對115例革蘭陰性菌重癥感染患者的研究結(jié)果顯示靜脈注射CMS 5 mg·kg-1·d-1(腎功能減退者減量),臨床有效率為51%[28]。另1項研究采用9 MIU負(fù)荷劑量,4.5 MIU維持劑量,每12小時1次的給藥方案,臨床有效率達82.1%[21]。
雖然FDA未批準(zhǔn)CMS的吸入治療,但是該方法在臨床上仍有應(yīng)用,特別是對于囊性纖維化患者,也有將其用于危重患者和呼吸道相關(guān)性肺炎患者。但由于它常與CMS靜脈給藥或其他抗菌藥合用,無法對其療效單獨給予評價[29]。
也有文獻報道采用CMS的鞘內(nèi)或腦室內(nèi)給藥治療神經(jīng)系統(tǒng)感染,但這只有在靜脈給藥無效時才會考慮。推薦劑量是3.2~10 mg/d,不能超過20 mg/d[30]。
2.多黏菌素E硫酸鹽:該劑型應(yīng)用極少,僅有1項研究報道,對15例革蘭陰性菌嚴(yán)重感染患者使用多黏菌素E硫酸鹽靜脈注射治療,(1.28±0.25)MIU/d,持續(xù)使用(22.3±6.2)d,結(jié)果顯示:臨床有效率為73.3%,微生物清除率為60%,病死率為20%[30]。
(二)多黏菌素B 多黏菌素B的臨床使用與多黏菌素E類似。臨床有效率為76%~95%,病死率為20%~48%。另外與多黏菌素E最大的不同是多黏菌素B固定纖維化柱可用于治療感染性休克[31]。
六、不良反應(yīng)
多黏菌素的不良反應(yīng)主要為劑量依賴性的腎毒性和神經(jīng)毒性。其他不良反應(yīng)有過敏反應(yīng)如瘙癢、皮炎,肌內(nèi)注射引起疼痛,靜脈給藥引起血栓性靜脈炎,藥物熱,嗜酸粒細(xì)胞增多等。腎毒性是該藥的應(yīng)用受到限制的主要原因,但通常在停藥數(shù)周到數(shù)月內(nèi)會逆轉(zhuǎn)。大多數(shù)的神經(jīng)毒性會伴隨腎毒性同時發(fā)生[32]。
將早期(1962—1977年)及近年(1995—2005年)的多黏菌素不良反應(yīng)發(fā)生率進行對比結(jié)果顯示:近年的研究中不良反應(yīng)發(fā)生率較早期研究為低,文中指出出現(xiàn)這種差異的原因可能是早期使用劑量過大、肌內(nèi)注射制劑用作靜脈注射、患者本身具有腎損害、發(fā)現(xiàn)毒性的早期未及時調(diào)整給藥方案,與其他具有腎毒性藥物合用等[33]。因此我們預(yù)見,如果結(jié)合PK和PD研究結(jié)果,設(shè)計更加規(guī)范科學(xué)的給藥方案,其不良反應(yīng)發(fā)生率可控制在較低水平。
七、結(jié)語
由于MDR和XDR革蘭陰性菌的迅速增多,使多黏菌素的應(yīng)用日益廣泛,但由于對其PK、PD和不良反應(yīng)等性質(zhì)缺乏了解,使其臨床應(yīng)用仍受到限制,特別是國內(nèi)這方面的研究很少。因此,迫切需要更多的關(guān)注和研究以闡明多黏菌素的各方面特點,特別是其PK和PD性質(zhì),從而制訂優(yōu)化的給藥策略,減少不良反應(yīng)發(fā)生,提高療效和安全性。
[1] Falagas ME,Kasiakou SK.Colistin:the revival of polymyxins for the management of multidrug-resistant gram-negative bacterial infections[J].Clin Infect Dis,2005,40(9):1333-1341.
[2] Landman D,Georgescu C,Martin DA,et al.Polymyxins revisited[J].Clin Microbiol Rev,2008,21(3):449-465.
[3] Li J,Nation RL,Turnidge JD,et al.Colistin:the re-emerging antibiotic for multidrug-resistant Gram-negative bacterial infections[J].Lancet Infect Dis,2006,6(9):589-601.
[4] Owen RJ,Li J,Nation RL,et al.Invitropharmacodynamics of colistin againstAcinetobacterbaumanniiclinical isolates[J].J Antimicrob Chemother,2007,59(3):473-477.
[5] Gales AC,Jones RN,Sader HS.Contemporary activity of colistin and polymyxin B against a worldwide collection of Gram-negative pathogens:results from the SENTRY Antimicrobial Surveillance Program (2006-09)[J].J Antimicrob Chemother,2011,66(9):2070-2074.
[6] Li J,Rayner CR,Nation RL,et al.Heteroresistance to colistin in multidrug-resistantAcinetobacterbaumannii[J].Antimicrob A-gents Chemother,2006,50(9):2946-2950.
[7] Gupta S,Govil D,Kakar PN,et al.Colistin and polymyxin B:a re-emergence[J].Indian J Crit Care Med,2009,13(2):49-53.
[8] Miller AK,Brannon MK,Stevens L,et al.PhoQ mutations promote lipid A modification and polymyxin resistance ofPseudomonasaeruginosafound in colistin-treated cystic fibrosis patients[J].Antimicrob Agents Chemother,2011,55(12):5761-5769.
[9] Matthaiou DK,Michalopoulos A,Rafailidis PI,et al.Risk factors associated with the isolation of colistin-resistant gram-negative bacteria:a matched case-control study[J].Crit Care Med,2008,36(3):807-811.
[10] Bergen PJ,Li J,Rayner CR,et al.Colistin methanesulfonate is an inactive prodrug of colistin againstPseudomonasaeruginosa[J].Antimicrob Agents Chemother,2006,50(6):1953-1958.
[11] Ma Z,Wang J,Nation RL,et al.Renal disposition of colistin in the isolated perfused rat kidney[J].Antimicrob Agents Chemother,2009,53(7):2857-2864.
[12] Couet W,Gregoire N,Marchand S,et al.Colistin pharmacokinetics:the fog is lifting[J].Clin Microbiol Infect,2012,18(1):30-39.
[13] Marchand S,Gobin P,Brillault J,et al.Aerosol therapy with colistin methanesulfonate:a biopharmaceutical issue illustrated in rats[J].Antimicrob Agents Chemother,2010,54(9):3702-3707.
[14] Li J,Coulthard K,Milne R,et al.Steady-state pharmacokinetics of intravenous colistin methanesulphonate in patients with cystic fibrosis[J].J Antimicrob Chemother,2003,52(6):987-992.
[15] Roberts JA,Lipman J.Editorial commentary:Closing the loopa colistin clinical study to confirm dosing recommendations from PK/PD modeling[J].Clin Infect Dis,2012,54(12):1727-1729.
[16] Couet W,Gregoire N,Gobin P,et al.Pharmacokinetics of colistin and colistimethate sodium after a single 80-mg intravenous dose of CMS in young healthy volunteers[J].Clin Pharmacol Ther,2011,89(6):875-879.
[17] Markou N,Markantonis SL,Dimitrakis E,et al.Colistin serum concentrations after intravenous administration in critically ill patients with serious multidrug-resistant,gram-negative bacilli infections:a prospective,open-label,uncontrolled study[J].Clin T-her,2008,30(1):143-151.
[18] Plachouras D,Karvanen M,F(xiàn)riberg LE,et al.Population pharmacokinetic analysis of colistin methanesulfonate and colistin after intravenous administration in critically ill patients with infections caused by gram-negative bacteria[J].Antimicrob Agents Chemother,2009,53(8):3430-3436.
[19] Imberti R,Cusato M,Villani P,et al.Steady-state pharmacokinetics and BAL concentration of colistin in criticallyⅢpatients after IV colistin methanesulfonate administration[J].Chest,2010,138(6):1333-1339.
[20] Garonzik SM,Li J,Thamlikitkul V,et al.Population pharmacokinetics of colistin methanesulfonate and formed colistin in critically ill patients from a multicenter study provide dosing suggestions for various categories of patients[J].Antimicrob Agents Chemother,2011,55(7):3284-3294.
[21] Dalfino L,Puntillo F,Mosca A,et al.High dose,extended-in-terval colistin administration in critically ill patients:is this the right dosing strategy?a preliminary study[J].Clin Infect Dis,2012,54(12):1720-1726.
[22] Kwa AL,Lim TP,Low JG,et al.Pharmacokinetics of polymyxin B1 in patients with multidrug-resistant Gram-negative bacterial infections[J].Diagn Microbiol Infect Dis,2008,60(2):163-167.
[23] Zavascki AP,Goldani LZ,Cao G,et al.Pharmacokinetics of intravenous polymyxin B in critically ill patients[J].Clin Infect Dis,2008,47(10):1298-1304.
[24] Dudhani RV,Turnidge JD,Coulthard K,et al.Elucidation of the pharmacokinetic/pharmacodynamic determinant of colistin activity againstPseudomonasaeruginosain murine thigh and lung infection models[J].Antimicrob Agents Chemother,2010,54(3):1117-1124.
[25] Dudhani RV,Turnidge JD,Nation RL,et al.f AUC/MIC is the most predictive pharmacokinetic/pharmacodynamic index of colistin againstAcinetobacterbaumanniiin murine thigh and lung infection models[J].J Antimicrob Chemother,2010,65(9):1984-1990.
[26] Zavascki AP,Goldani LZ,Li J,et al.Polymyxin B for the treatment of multidrug-resistant pathogens:a critical review[J].J Antimicrob Chemother,2007,60(6):1206-1215.
[27] Florescu DF,Qiu F,McCartan MA,et al.What is the efficacy and safety of colistin for the treatment of ventilator-associated pneumonia?A systematic review and meta-regression[J].Clin Infect Dis,2012,54(5):670-680.
[28] Cheng CY,Sheng WH,Wang JT,et al.Safety and efficacy of intravenous colistin(colistin methanesulphonate)for severe multidrug-resistant Gram-negative bacterial infections[J].Int J Antimicrob Agents,2010,35(3):297-300.
[29] Nation RL,Li J.Colistin in the 21st century[J].Curr Opin Infect Dis,2009,22(6):535-543.
[30] Balaji V,Jeremiah SS,Baliga PR.Polymyxins:Antimicrobial susceptibility concerns and therapeutic options[J].Indian J Med Microbiol,2011,29(3):230-242.
[31] Kwa A,Kasiakou SK,Tam VH,et al.Polymyxin B:similarities to and differences from colistin(polymyxin E)[J].Expert Rev Anti Infect Ther,2007,5(5):811-821.
[32] Mendes CA,Burdmann EA.[Polymyxins-review with emphasis on nephrotoxicity][J].Rev Assoc Med Bras,2009,55(6):752-759.
[33] Falagas ME,Kasiakou SK.Toxicity of polymyxins:a systematic review of the evidence from old and recent studies[J].Crit Care,2006,10(1):R27.
Update of researches on the pharmacology of polymyxins
ZHAOMiao,ZHANGJing,ZHANGYingyuan. (InstituteofAntibiotics,HuashanHospital,F(xiàn)udan University,Shanghai200040,China)
R978.16
A
1009-7708(2012)06-0466-06
國家科技部重大新藥創(chuàng)制科技重大專項(2012ZX 09303004-001);上海市自然科學(xué)基金(09ZR1405400)。
復(fù)旦大學(xué)附屬華山醫(yī)院抗生素研究所,上海 200040。
趙苗(1989—),女,碩士研究生,主要從事抗菌藥物臨床藥理學(xué)研究。
張菁,E-mail:zhangj61@fudan.edu.cn。
2012-03-31
·病例報告·

