E-鈣粘蛋白、β-catenin和HER-2在惡性皮膚腫瘤中的表達及其意義
邵哲人 姜方震 滿孝勇 包祺 王璐 錢歡 胡學慶
E-鈣粘蛋白、β-catenin和HER-2在惡性皮膚腫瘤中的表達及其意義
邵哲人 姜方震 滿孝勇 包祺 王璐 錢歡 胡學慶
目的 希望能夠找到通過對皮膚腫瘤進行侵襲性評估的方法,來指導臨床腫瘤擴大切除范圍,以及切除后創面修復方法的選擇。方法 選取包括正常皮膚、脂溢性角化癥、皮膚基底細胞癌和皮膚鱗癌臨床病理標本,石蠟包埋后連續切片,進行E-cadherin、β-catenin和 HER-2的免疫熒光染色,觀察染色結果以評價不同病理類型腫瘤的侵襲性。結果 正常皮膚及SK皮膚表皮細胞高表達E-cadherin和β-catenin,而皮膚基底細胞癌與皮膚鱗癌的表達下降。皮膚基底細胞癌與皮膚鱗癌中HER-2的表達水平較正常皮膚及SK皮膚升高。結論 E-cadherin、β-catenin和HER-2在皮膚腫瘤中的表達是評估腫瘤侵襲性的重要指標,對于臨床手術治療具有指導性意義。
皮膚腫瘤 腫瘤侵襲性 上皮型鈣粘蛋白 β-連環蛋白 2型人類表皮生長因子受體
皮膚腫瘤的局部侵襲和轉移能力與發病率和死亡率相關。轉移性皮膚腫瘤中,當腫瘤細胞脫離主要病灶,可橫向或縱向侵襲,并通過周圍的間質遷移,侵入血管和淋巴管形成腫瘤播散灶,這一過程與腫瘤細胞間黏附功能的降低有關。上皮型鈣粘蛋白(E-cadherin)是重要的上皮細胞粘附分子,可與其胞內域相連接的β-連環蛋白(β-catenin)構成E-鈣粘蛋白-連環蛋白復合體(E-cadherin/catenin)發揮細胞間黏附作用,對抑制皮膚腫瘤的侵襲轉移具有重要意義。針對E-鈣粘蛋白復合體調控機制的進一步深入研究,對于闡明皮膚腫瘤的侵襲轉移有著重要的意義,有可能通過糾正E-鈣粘蛋白和β-連環蛋白的表達和分布異常,以增強細胞之間黏附作用,從而降低腫瘤細胞的侵襲轉移潛能,將為皮膚腫瘤的靶向治療提供新的思路。
2型人類表皮生長因子受體(Human epidermal growth factor receptor type 2,HER-2) 由原癌基因HER-2/neu編碼,對細胞的生長、分化及存活有著重要的調節作用。在乳腺癌、卵巢癌、肺腺癌、腎細胞癌等許多腫瘤中有不同程度的表達,但在皮膚腫瘤中的相關報道較少。研究表明,HER-2被激活后,可通過多種途徑增強腫瘤細胞的浸潤、轉移能力,如促進腫瘤細胞增殖、抑制凋亡、增加基質金屬蛋白酶(Matrix metal10proteinase,MMP)和血管內皮生長因子(Vascular endothelial growth factor,VEGF)等的表達。闡明HER-2與皮膚腫瘤浸潤轉移的關系,將有可能為延長患者生存期,減少腫瘤復發、轉移的針對性治療方案提供理論依據。
整形外科皮膚惡性腫瘤的臨床治療過程中,常面臨腫瘤擴大切除范圍,以及切除后創面修復方法的選擇,腫瘤的侵襲性是重要的考慮因素之一。腫瘤侵襲性的強弱是其惡性程度的重要特質,直接關系到術后是否有腫瘤細胞的殘留,以及是否存在短期內復發的可能。本研究擬通過對皮膚基底細胞癌(Basal Cell Carcinoma,BCC) 和皮膚 鱗 狀 細 胞 癌(Squemous Cell Carcinoma,SCC) 組織中 E-鈣粘蛋白、β-catenin和HER-2的表達來評估其侵襲性,以正常皮膚和脂溢性角化癥(Seborrheic keratosis,SK)作為對照。通過對皮膚腫瘤侵襲性的評估,結合臨床病例術后轉歸的分析,希望能夠找到通過對皮膚腫瘤進行侵襲性評估的方法,來指導臨床腫瘤擴大切除范圍,以及切除后創面修復方法的選擇。
1 材料與方法
1.1 實驗材料
1.1.1 組織標本
包括正常皮膚、脂溢性角化癥、皮膚基底細胞癌和皮膚鱗癌,均取自臨床病理標本。
1.1.2 抗體及免疫組織熒光試劑
兔抗人 β-catenin(Santa Cruz,SC-7199);兔抗人 E-cadherin(Santa Cruz,SC-7870);兔抗人 HER-2(Santa Cruz,SC-284);熒光二抗 cy3 dunkey antirabbit(Jackson,715-165-150);DAPI(Roche,236276)。
1.1.3 主要儀器
熒光顯微鏡(Olympus IX71)及數碼照相機CCD(DP72 和相關軟件);石蠟切片機(LEICA,RM2135)。
1.2 實驗方法
組織標本石蠟包埋后連續切片,二甲苯梯度乙醇脫蠟至水;去離子水漂洗3次,10 MM枸櫞酸鈉100℃中10 min抗原熱修復,去離子水漂洗3次,10%胎牛血清37℃封閉1 h后傾去液體,分別滴加兔抗人 β-catenin(1∶100);兔抗人 E-cadherin(1∶100);兔抗人HER-2(1∶100)置濕盒內4℃冰箱孵育過夜。棄去一抗后去離子水漂洗3次,滴加Cy3 dunkey anti-rabbit熒光二抗;去離子水漂洗3次,熒光顯微鏡下檢測染色結果,數碼相機拍照。另有連續石蠟切片,二甲苯梯度乙醇脫蠟至水;去離子水漂洗3次,DAPI核襯染,去離子水漂洗3次,熒光顯微鏡下檢測染色結果,數碼相機拍照。
2 實驗結果
2.1 E-cadherin
E-cadherin主要在表皮細胞的細胞膜上表達。實驗結果提示,正常皮膚以及SK增厚的表皮層中E-cadherin表達清晰,熒光信號強。在BCC標本上,E-cadherin的表達較前述對照標本的表達減弱,而SCC標本E-cadherin的表達更弱,且信號不連續,說明隨著腫瘤惡性程度的提高,E-cadherin的表達依次遞減(圖1)。

圖1 E-cadherin在惡性皮膚腫瘤中的表達Fig.1 Expression of E-cadherin in manignent skin tumor
2.2 β-catenin
β-catenin主要表達在表皮細胞的細胞漿中。與E-cadherin的結果相似,正常皮膚與SK標本的表皮細胞內有β-catenin的強烈表達。BCC標本中βcatenin的表達減弱,在SCC標本中,我們觀察到βcatenin的表達隨著與角化珠的距離增大而逐漸減弱(圖2)。
2.3 HER-2
HER-2是細胞膜受體,表達在表皮細胞的胞膜上。正常皮膚標本和SK皮膚標本上雖有表達,但BCC中HER-2的表達明顯加強,而在SCC中HER-2的表達呈現彌漫性,表達范圍較廣,提示了SCC表達HER-2的特殊性(圖3)。
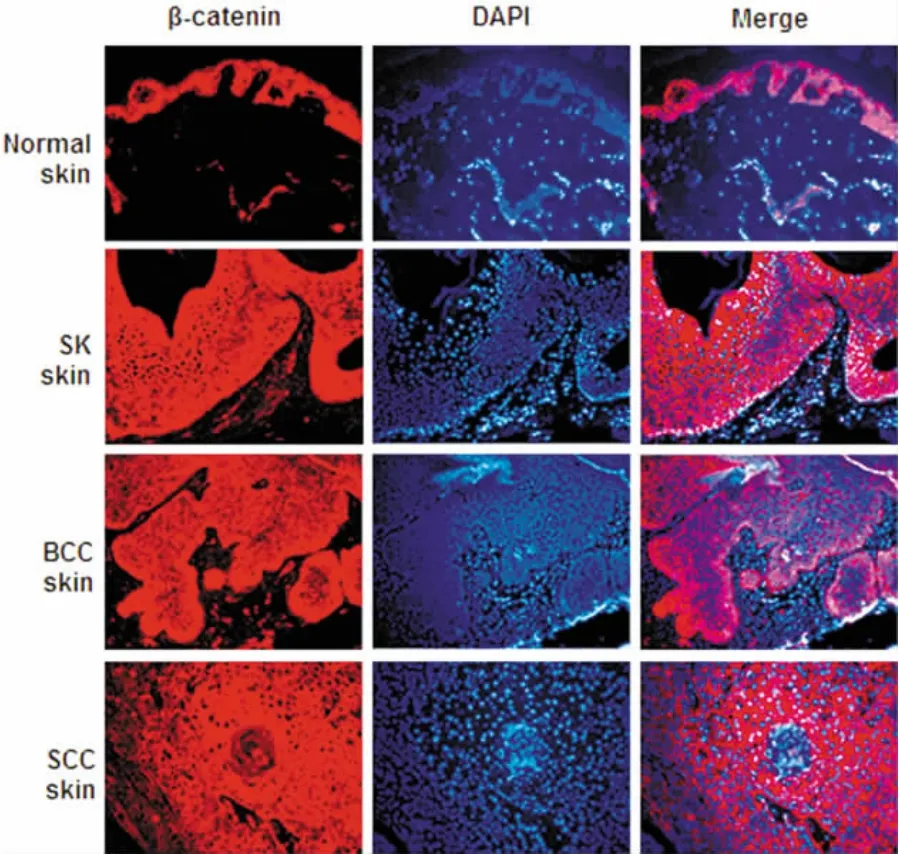
圖2 β-catenin在惡性皮膚腫瘤中的表達Fig.2 Expression of β-catenin in manignent skin tumor
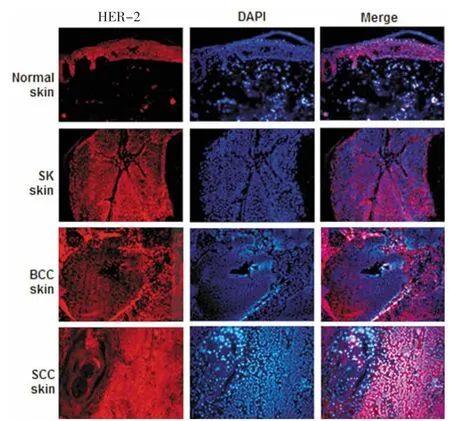
圖3 HER-2在惡性皮膚腫瘤中的表達Fig.3 Expression of HER-2 in manignent skin tumor
3 討論
3.1 E-cadherin與皮膚腫瘤侵襲性
越來越多的研究發現,細胞黏附分子在轉移性癌癥細胞的細胞連接中起著重要作用。而鈣粘蛋白是一種介導同質細胞間相互粘附的Ca2+依賴性跨膜糖蛋白。可分為3個亞型:上皮型鈣粘蛋白(E-cadherin)、胎盤型鈣粘蛋白(P-cadherin)和神經型鈣粘蛋白(N-cadherin)。E-cadherin在表皮黑色素細胞和角質形成細胞上表達增高,在胃癌、肝癌、乳腺癌和肺癌等癌細胞中表達降低。皮膚疾病中,天皰瘡和毛囊角化癥(Darier氏病)患者的皮膚病理示棘細胞層E-cadherin表達顯著減少。E-cadherin表達減少或不穩定也見于皮膚鱗狀細胞癌、惡性黑色素瘤和Paget病,但其在皮膚基底細胞癌中的表達目前尚無定論。
關于皮膚黑色素瘤的研究表明,黑色素細胞遷移粘附至基底膜后,將通過其細胞樹突與角質形成細胞形成復雜的聯系,角質形成細胞可控制黑素細胞的生長和表面受體的表達。信號受體,如E-鈣粘蛋白、P-鈣粘蛋白和橋粒芯糖蛋白(Desmoglein)的下調,是黑色素瘤細胞逃避角質形成細胞調控的主要機制之一[1]。經典的鈣粘蛋白,即E-cadherin、N-cadherin和P-cadherin,可決定皮膚黑素細胞的定位。在痣和黑色素瘤發展過程中,兩種生長因子信號通路下調,隨之而來的是E-cadherin表達的變化,導致痣細胞和黑色素細胞在皮膚中重新定位[2]。
研究發現,使痣和黑色素瘤細胞中強制表達E-cadherin,可以重建角質細胞對黑色素細胞的控制,從而逆轉黑色素細胞的惡性表型。即使在高度侵襲性黑素瘤細胞中,抑制腫瘤浸潤和轉移相關基因的表達對黑色素瘤的治療有重要意義[2]。
3.2 β-連環蛋白與E-cadherin形成復合體參與皮膚腫瘤的侵襲調控機制
β-連環蛋白是一種胞內可溶性的多功能蛋白,其肽鏈的中部有12~14個由42個氨基酸殘基組成的重復序列(稱arm區域),該區域可以和多種蛋白受體結合而發揮功能。β-連環蛋白在細胞內存在有兩種形式:①游離型,主要存在于細胞漿中,通過與大腸腺瘤樣息肉蛋白(Adenomatous polyposis coli,APC)、糖原合成酶激酶-3β(Glycogen synthase kinase-3β,GSK-3β)和軸蛋白(Axin)形成的“破壞復合物”結合后,被GSK-3β和酪蛋白激酶1α(Casein kinase 1,CK1α)磷酸化,進而泛素化被蛋白水解酶降解,從而使其在細胞漿中維持一個較低的水平;②結合型,β-連環蛋白由胞漿轉移至細胞膜下和E-cadherin形成復合體,參與細胞之間的粘附[3]。
研究表明,E-cadherin表達的變化可引起黑色素瘤細胞與環境的相互作用,并改變β-catenin信號。表皮中E-cadherin表達于黑色素細胞和表皮角質形成細胞上,使兩者緊密聯系[4]。黑色素細胞與基底細胞層未分化的表皮細胞接觸,可抑制黑色素細胞增殖,抑制其表達黑色素瘤標記物,以及導致黑色素細胞產生更多樹突[5]。另外,通過刺激β-catenin的信號通路,E-cadherin的表達可增加黑色素瘤生存能力[6]。
E-cadherin是參與細胞之間粘附連接的主要分子,發揮著維持細胞極性和結構完整性的功能。它的抑癌作用主要是通過與β-連環蛋白形成復合體介導同質細胞之間的相互粘附,抑制腫瘤細胞的遷移和侵襲性,同時E-cadherin競爭性和β-連環蛋白結合,降低細胞內游離型β-連環蛋白水平,從而抑制其參與Wnt信號通路細胞增殖基因的表達。E-cadherin復合體中無論鈣粘蛋白本身或其組分的異常變化都可能引起細胞之間的粘附能力減弱以及腫瘤細胞的運動能力增強,從而導致細胞容易脫離、侵襲和轉移[7]。
E-cadherin復合體功能異常可能通過以下幾個環節參與皮膚腫瘤侵襲轉移的調控。①基因突變:是引起蛋白表達水平改變和功能障礙的主要機制之一。多種消化道惡性腫瘤的研究報道,E-cadherin基因的點突變、缺失均可導致E-cadherin表達水平的下調和功能結合區域的改變,從而引起細胞之間連接疏松[8]。β-catenin基因突變能穩定β-catenin蛋白[9]或增加其核內聚集[10]。核內β-catenin的水平增加可使MITF及CCND1表達上升,激活異常的Wnt信號通路,影響其參與的粘附功能,從而促進黑色素瘤細胞增值和擴散[11]。②基因轉錄抑制:是E-cadherin表達下調的重要機制。E-cadherin啟動子區域存在的E-box含有保守的5′-CACCTG序列,該序列為helix-loop-helix(HLH)轉錄因子家族的結合位點。在上皮腫瘤細胞中,當E-cadherin基因啟動子的E-box結合轉錄抑制因子后可下調E-cadherin的表達。 這些轉錄抑制因子有 Slug[12]、Twist[13]、Snail和ZEB[14]等。此外,這些轉錄抑制因子和C D H 1基因的啟動子結合,能夠誘導上皮細胞向間質細胞表型的轉化(Epithelial-mesenchymal transition,EMT),同時伴隨E-cadherin向N-cadherin轉化,使腫瘤細胞獲得侵襲的能力[15]。③磷酸化:當E-cadherin和β-連環蛋白發生異常磷酸化時將改變其分子的帶電性和(或)分子的空間構象,影響復合體的正常形成和功能[3]。關于黑色素瘤的研究顯示,在Wnt信號途徑中,WNTs分泌蛋白對神經嵴細胞,特別是黑色素細胞的發展有重要作用。WNT蛋白與及其受體結合,可滅活磷酸化β-catenin的GSK-3β激酶[16]。被酪氨酸磷酸化的β-catenin和E-cadherin失去聯系,βcatenin轉運至細胞核內,與T細胞因子/淋巴細胞增強 因 子 (T cell factor/lymphoid enhancer factor,Tcf/LEF)結合,參與細胞內基因的表達,引起細胞的增殖。但磷酸化的β-連環蛋白進入細胞核后,雖能與TcF/LEF相互作用,卻不能和DNA結合,無法啟動相應靶基因的轉錄。④細胞內異常分布:有報道顯示,E-cadherin表達較高的腫瘤仍具有較高的侵襲轉移能力,細胞內異常分布可能是原因之一[17]。β-連環蛋白在細胞膜和細胞核具有不同的生物功能,應用免疫組化方法對多數惡性腫瘤的研究結果大都顯示β-連環蛋白的細胞內異常分布,如細胞膜上分布減少,出現核內的聚集[18]。⑤其他影響因素:磷酸化、糖基化、調節蛋白,如p120-catenin等。
E-cadherin復合體表達下調或/和功能喪失與皮膚腫瘤的分化、侵襲轉移和預后密切相關。對上皮型鈣粘蛋白和β-連環蛋白在皮膚腫瘤中的表達和動態平衡的研究,有助于更好地理解腫瘤細胞與角質形成細胞、成纖維細胞、血管內皮細胞和其周圍微環境的聯系,侵襲和轉移的機制[3]。
3.3 HER-2與腫瘤侵襲的其他通路
HER-2蛋白是一種由原癌基因HER-2/neu編碼的跨膜糖蛋白,由胞外區、跨膜區及胞內區構成。原癌基因HER-2/neu對于調節正常細胞的生長與分化是必須的,同時還與多條信號轉導通路相關聯[19]。HER-2可通過Ras/MAPK途經使轉錄因子ER81磷酸化,活化的ER81則直接與MMP-2啟動子區結合而促進其轉錄。在轉移潛能較高的HER-2陽性乳腺癌細胞中,HER-2能增強白明膠酶的表達[20]。白明膠酶(Gelatinases)屬于基質金屬蛋白酶(Matrix metal-loproteinase,MMP,包括 MMP-2 和 MMP-9),是MMP家族中鋅依賴的內肽酶,能降解基底膜的主要成分Ⅳ型膠原,與腫瘤的浸潤、轉移密切相關。
細胞外基質(Extracellular matrix,ECM)的降解是浸潤的重要起始之一。ECM降解后,HER-2可通過降低腫瘤細胞間的黏附作用,促進腫瘤細胞的浸潤轉移。激活的HER-2可磷酸化粘附分子βcatenin,后者通過裂解E-cadherin復合體,增強Wnt信號傳導,可促進乳腺癌細胞的增殖和侵襲[21]。
HER-2還可通過促進Fnl4(Fibroblast growth factor-inducible 14)的表達[22]和增強腫瘤細胞對乙醇的敏感性等途徑增強腫瘤細胞的浸潤作用[23]。另外,在過表達HER-2的腫瘤中,表面熱休克蛋白90(Heat shock protein 90,HSP90)在腫瘤細胞的浸潤中起著重要作用。HSP90作為一種分子伴侶,參與各種蛋白的折疊、組裝、細胞內定位和蛋白質水解。HSP90結合HER-2胞內段時,可穩定HER-2的結構。運用特異抗HSP90的單克隆抗體(Monoclonal antibody,mAb)4C5阻斷HSP90與HER-2的結合,可抑制腫瘤浸潤[24]。
綜上所述,E-cadherin、β-catenin 和 HER-2 在皮膚腫瘤中的表達是評估腫瘤侵襲性的重要指標,對于臨床治療具有指導性意義。本實驗結果提示,正常皮膚及SK皮膚表皮細胞高表達E-cadherin和β-catenin,而惡性腫瘤中兩者的表達下降并與腫瘤的惡性程度(侵襲性)相關,HER-2的表達水平與腫瘤的侵襲性呈正相關。
皮膚惡性腫瘤的首選治療方法是手術切除。因此,切除范圍和切除后創面修復方法的選擇,必須考慮腫瘤的侵襲性。惡性程度相對較低的腫瘤,其擴大切除的范圍較小,一般選擇距離腫瘤邊緣0.5 cm確定切緣,也可以通過Mohs顯微切除的方法進行。涉及面部等部位需考慮美容需求,一般考慮以皮瓣進行修復。對于具有較高侵襲性的腫瘤,如SCC和惡性黑色素瘤等,則擴大切除的范圍應增加到2~3 cm,其擴大切除后創面修復方法的選擇需視具體情況而定。運用皮瓣方法進行修復具有諸多優點,修復后的外觀、彈性、質地以及功能恢復等均較佳。但是,有學者認為皮瓣修復將掩蓋腫瘤的復發,不利于早期發現,而且手術過程會導致腫瘤細胞種植轉移,因此主張進行皮膚移植修復。因此,我們需要術前對腫瘤的侵襲性進行評估,綜合手術部位、功能重建和美容需求等因素來選擇手術方案。
相同病理類型的惡性腫瘤,其表現與轉歸是不盡相同的,重要因素之一就是腫瘤的侵襲性。如果術前經過腫瘤活檢能夠確定病理診斷,同時通過E-cadherin、β-catenin和HER-2在皮膚腫瘤中的表達來對其侵襲性進行分級,對于手術方案的選擇以及改善患者的預后是有實際意義的。我們將通過擴大樣本量和長期隨訪等方法,進行更為深入的研究。
[1]Haass NK,Herlyn M.Normal human melanocyte homeostasis as a paradigm for understanding melanoma[J].J Investig Dermatol Symp Proc,2005,10(2):153-163.
[2]Herlyn M,Berking C,Li G,et al.Lessons from melanocyte development for understanding the biological events in naevus and melanoma formation[J].Melanoma Res,2000,10(4):303-312.
[3]Wang H,Zhou Q.E-cadherin/beta-catenin and the invasion and metastasis of lung cancer[J].Zhongguo Fei Ai Za Zhi.2010,13(3):254-259.
[4]Widlund HR,Horstmann MA,Price ER,et al.Beta-catenin-induced melanoma growth requires the downstream target Microphthalmiaassociated transcription factor[J].J Cell Biol 2002;158(6):1079-1087.
[5]Shtutman M,Zhurinsky J,Simcha I,et al.The cyclin D1 gene is a target of the beta-catenin/LEF-1 pathway[J].Proc Natl Acad Sci U S A,1999,96:5522-5527.
[6]Gottardi CJ,Wong E,Gumbiner BM.E-cadherin suppresses cellular transformation by inhibiting beta-catenin signaling in an adhesionindependent manner[J].J Cell Biol,2001,153(5):1049-1060.
[7]Takahashi Y,Nishikawa M,Suehara T,et al.Gene silencing of β-catenin in melanoma cells retards their growth but promotes the formation of pulmonary metastasis in mice[J].Int J Cancer,2008,123(10):2315-2320.
[8]Becker KF,Atkinson MJ,Reich U,et al.E-cadherin gene mutation provides clues to diffuse type gastric carcinomas[J].Cancer Res,1994,54(14):3845-3852.
[9]Rubinfeld B,Robbins P,El-Gamil M,et al.Stabilization of betacatenin by genetic defects in melanoma cell lines[J].Science,1997,275:1790-1792.
[10]Cowley GP,Smith ME.Cadherin expression in melanocytic naevi and malignant melanomas[J].J Pathol,1996;179(2):183-187.
[11]Sanders DS,Blessing K,Hassan GA,et al.Alterations in cadherin and catenin expression during the biological progression of melanocytic tumours[J].Mol Pathol,1999;52(3):151-157.
[12]Shih JY,Tsai MF,Chang TH,et al.Transcription repressor slug promotes carcinoma invasion and predicts outcome of patients with lung adenocarcinoma[J].Clin Cancer Res,2005,11(22):8070-8078.
[13]Yang J,Mani SA,Donaher JL,et al.Twist,a master regulator of morphogenesis,plays an essential role in tumor metastasis[J].Cell,2004,117(7):927-939.
[14]Chinnadurai G.CtBP,an unconventional transcriptional corepressor in development and oncogenesis[J].Mol Cell,2002,2(9):213-224.
[15]Bolós V,Peinado H,Pérez-Moreno MA,et al.The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions:a comparison with Snail and E47 repressors[J].J Cell Sci,2003,116(Pt 3):499-511.
[16]Bienz M.Beta-catenin:a pivot between cell adhesion and Wnt signalling[J].Curr Biol,2005,15(2):R64-67.
[17]Rodríguez-Sastre MA,González-Maya L,Delgado R,et al.Abnormal distribution of E-cadherin and beta-catenin in different histologic types of cancer of the uterine cervix[J].Gynecol Oncol,2005,97(2):330-336.
[18]Nakopoulou L,Mylona E,Papadaki I,et al.Study of phospho-betacatenin subcellular distribution in invasive breast carcinomas in relation to their phenotype and the clinical outcome[J].Mod Pathol,2006,19(4):556-563.
[19]Schechter AL,Stern DF,Vaidyanathan L,et a1.The neu oncogene:an erb-B-related gene encoding a 185,000-Mr tumour antigen[J].Nature,1984,312(5994):513-516.
[20]Pellikainen JM,Ropponen KM,Kataja VV,et al.Expression of matrix metalloproteinase(MMP)-2 and MMP-9 in breast cancer with a special reference to activator protein-2,HER-2,and prognosis[J].Clin Cancer Res,2004,10(22):7621-7628.
[21]Wang K,Ma Q,Ren Y,et al.Geldanamycin destabilizes HER-2 tyrosine kinase and suppresses Wnt/beta-catenin signaling in HER-2 overexpressing human breast cancer cells[J].Oncol Rep,2007,17(1):89-96.
[22]Kleer CG,van Golden KL,Braun T,et a1.Persistent E-cadherin expression in inflammatory breast cancer[J].Mod Pathol,2001,14(5):458-464.
[23]Willis AL,Tran NL,Chatigny JM,et al.The fibroblast growth factor-inducible 14 receptor is highly expressed in HER-2-positive breast tumors and regulates breast cancer cell invasive capacity[J].Mof Cancer Res,2008,6(5):725-734.
[24]Sidera K,Gaitanou M,Stellas D,et al.A critical role for HSP90 in cancer cell invasion involves interaction with the extracellular domain of HER-2[J].J Biol Chem,2008,283(4):2031-2041.
Expression of E-cadherin,β-catenin and HER-2 in Manignent Skin Tumor
SHAO Zheren1,JIANG Fangzheng1,MAN Xiaoyong2,BAO Qi1,WANG Lu1,QIAN Huan1,HU Xueqing1.1 Department of Plastic Surgery;2 Department of,The Second Hospital of Zhejiang University School of Medicine,Zhejiang 310009,China.
ObjectiveTo instruct the extent of extended resection and choose the proper method of wound reparation after tumor removal through the assessment of tumor invasiveness.MethodsFour kinds of pathological specimens including normal skin,seborrheic keratosis,basal cell carcinoma and squamous cell carcinoma were used in this study.After paraffinembedded serial sections of all the specimens,immunofluorescent staining of E-cadherin,β-catenin,and HER-2 are carried out to observe the staining results in order to evaluate tumor invasiveness of different pathological types.ResultsThe expression of E-cadherin and β-catenin is higher in epidermal cells of the normal skin and seborrheic keratosis but decreased in that of basal cell carcinoma and squamous cell carcinoma.HER-2 expression in basal cell carcinoma and squamous cell carcinoma is higher than that in normal skin and increased skin SK.ConclusionE-cadherin,β-catenin,and HER-2 expression in skin tumors is an important indicator in the assessment of tumor invasiveness which plays a role in guiding clinical surgical treatment.
Skin Tumor;Tumor Invasiveness;E-cadherin;β-catenin;HER-2
R739.5
A
1673-0364(2012)05-0264-05
10.3969/j.issn.1673-0364.2012.05.005
浙江省教育廳科研計劃項目(ZC200805548)。
310009 浙江省杭州市 浙江大學醫學院附屬第二醫院整形外科(邵哲人,姜方震,包祺,王璐,錢歡,胡學慶);皮膚科(滿孝勇)。
2012年8月16日;
2012年9月11日)

